光生物调节疗法对细菌的双向调节作用的研究进展
2024-01-26吕越阴慧娟
吕越 阴慧娟
收稿日期:2023-05-23;修回日期:2023-08-18。
基金項目:国家自然科学基金面上项目(62175261)。
作者简介:吕越,硕士研究生。
* 通信作者:阴慧娟,研究员,主要从事激光医学的基础和应用研究。E-mail: yinzi490@163.com。
摘 要:非侵入性激光照射可以诱导细胞和组织的光生物调节效应。光生物调节(PBM)应用广泛,特别是在抗微生物感染和改善炎症方面有着很好的效果。然而,研究发现,PBM对细菌和炎症有双向调节现象,抗菌-促菌和抑炎-促炎在不同的试验条件下会发生变化。近些年来,PBM的临床应用受到越来越多的关注,特别是在抗菌领域,因为它是一种无创的策略,禁忌症少。然而,由于双向调节效应,研究人员仍然对PBM的应用方式存疑,必须根据其临床应用进行光照波长、剂量等参数的修改。因此,本文总结了PBM对细菌的双向调节效应,分析了这种双向调节效应产生的影响因素及其分子机制。PBM对细菌的双向调节作用受光照波长、剂量、细菌类别及细菌状态的影响。更好地了解低强度激光治疗中双向剂量反应的程度能够探索PBM使用的最可靠机制,并最终使各种疾病患者的治疗标准化,这对于优化临床治疗是必要的。此外,研究人员对PBM双向调节机制的合理利用使其可以达到促进或抑制细菌生长的作用,这在微生物制造、菌群调节、改善和治疗疾病等领域有广阔的应用前景。
关键词:光生物调节;双向调节;分子机制;肠道菌群;抗菌-促菌
中图分类号:R318.51 文献标志码:A DOI:10.3969/j.issn.1007-7146.2023.05.002
Research Progress on Bidirectional Regulation of Photobiomodulation Therapy on Bacteria
LYU Yue, YIN Huijuan*
(Chinese Academy of Medical Sciences & Peking Union Medical College Institute of Biomedical Engineering,
Tianjin 300192, China)
Abstract: Non-invasive laser irradiation can induce photobiomodulation of cells and tissues. Photobiomodulation (PBM) is widely used, especially in antimicrobial infection and improving inflammation. However, studies have found that PBM has a bidirectional regulation of bacteria and inflammation. Antibacterial and pro-bacterial, anti-inflammatory and pro-inflammatory will change under different experimental conditions. In recent years, the clinical applications of PBM have received more and more attentions, especially in the field of antibacterial, because it is a noninvasive strategy with few contraindications. However, due to the bidirectional regulatory effect, researchers still have doubts about the application mode of PBM, and the parameters such as light wavelength and dose must be modified according to its clinical application. Therefore, this paper summarizes the bidirectional regulation effects of PBM on bacteria, and analyzes the influencing factors and molecular mechanism of this bidirectional regulation effect. The bidirectional regulation effect of PBM on bacteria is affected by light wavelength, dose, bacterial category and bacterial state. A better understanding of the degree of bidirectional dose-response in low-intensity laser therapy is necessary to optimize clinical treatment. It can also help explore the most reliable mechanism of PBM use and ultimately standardize the treatment of patients with various diseases. In addition, rational use of the bidirectional regulation mechanism of PBM can promote or inhibit the growth of bacteria, which has broad application prospects in the fields of microbial manufacturing, flora regulation, improvement and treatment of diseases.
Key words: photobiomodulation; bidirectional regulatory; molecular mechanism; intestinal flora; antibacterial-promoting bacteria
(Acta Laser Biology Sinica, 2023, 32(5): 393-402)
细菌感染对健康构成威胁,其导致的慢性难愈合脓创、败血症等疾病严重影响人们的工作和生活[1]。自1928年青霉素被发现后,抗生素疗法成为治疗细菌感染最有效的策略之一。然而,近年来,抗生素的过度使用甚至滥用导致耐药细菌种类不断增加,甚至出现“超级细菌”,抗生素的疗效逐年下降,患者临床治疗时间延长,严重增加了经济负担。同时,抗生素的大量使用虽然可以在一定程度上抑制细菌感染的发生,但会产生一定的副作用,造成人体免疫系统功能紊乱等。因此,设计能够代替抗生素、新型有效的抗菌策略已成为细菌治疗领域的研究热点。此外,人类肠道微生物组(gut microbiome,GM)包括复杂而动态的微生物种群,这些微生物对生物体的健康和生存至关重要。肠道菌群的失调与各种疾病密切相关,因此,设法改善肠道菌群的失衡来改善治疗疾病备受关注。
近年来,光生物调节 (photobiomodulation,PBM)作为一项非侵入性、无药物的生物物理治疗方法受到广泛关注和应用。PBM对于细菌表现出双向调节作用。不同波长、不同剂量的光照会表现出促进细菌增殖或抑制细菌生长的作用。这样的特性使得PBM对抗细菌感染,以及调节肠道菌群的组成来改善肠道菌群的失调成为可能。基于此,本文总结了PBM双向调节细菌的相关研究,总结了其双向调节作用的影响因素、相关分子机制以及应用进展。
1 PBM疗法
激光在医学上的研究和临床应用的历史可以追溯到20世纪60年代末[2]。在19世纪后期,丹麦医生Niles Finsen证明了阳光中的红光和蓝光对皮肤分枝杆菌(Mycobacterium)感染的有益作用。1903年,他還因为这一发现被授予诺贝尔医学和生理学奖[3]。从此,低能激光治疗(low level laser therapy,LLLT)被用于改善几乎所有人类和动物系统的生理机能[4-5]。2016年,国际上达成共识,将LLLT和旧术语“低水平”(low-level)改为使用新术语“光生物调节”[6]。做出这一决定的其中一个原因就是PBM的双相剂量反应,即同一波长下,随着能量密度的改变,PBM可产生抑制或刺激作用。目前PBM已经应用于多个领域并发挥出有效作用。这些研究证明,PBM可促进神经再生,加速创面愈合,提高各种移植物存活率,促进损伤后骨骼和肌肉愈合[7-10]。
PBM的基本原理是利用细胞内的光化学反应,将光子能量转化为细胞可以使用的化学能[11]。光化学反应发生在光子与细胞内的“光受体”之间。PBM的光子能量低,既不向组织发射热量(热能),也不向组织发射辐射(电离辐射),是一种非热非辐射疗法。世界激光治疗协会(World Association for Photobiomodulation Therapy,WALT)和北美光治疗学会(North American Association for Photobiomodulation Therapy,NAALT)将PBM定义为一种使用非电离光源(如激光二极管、发光二极管以及可见光和红外光谱中的宽带光)的光治疗形式[12-14]。
2 PBM的双向调节
2.1 双向调节理论
PBM相关研究中需要考虑的最关键因素是光学传输系统,其专注于制造易于操作且能满足特定应用要求的设备[15]。设备参数在很大程度上是围绕着光生物学的传统线性原理描述的,即本生-罗斯科定律(Bunsen-Roscoe law)。这一定律规定了强度和持续时间的负相关性,而整体的生物效应与总能量成正比[16-18]。
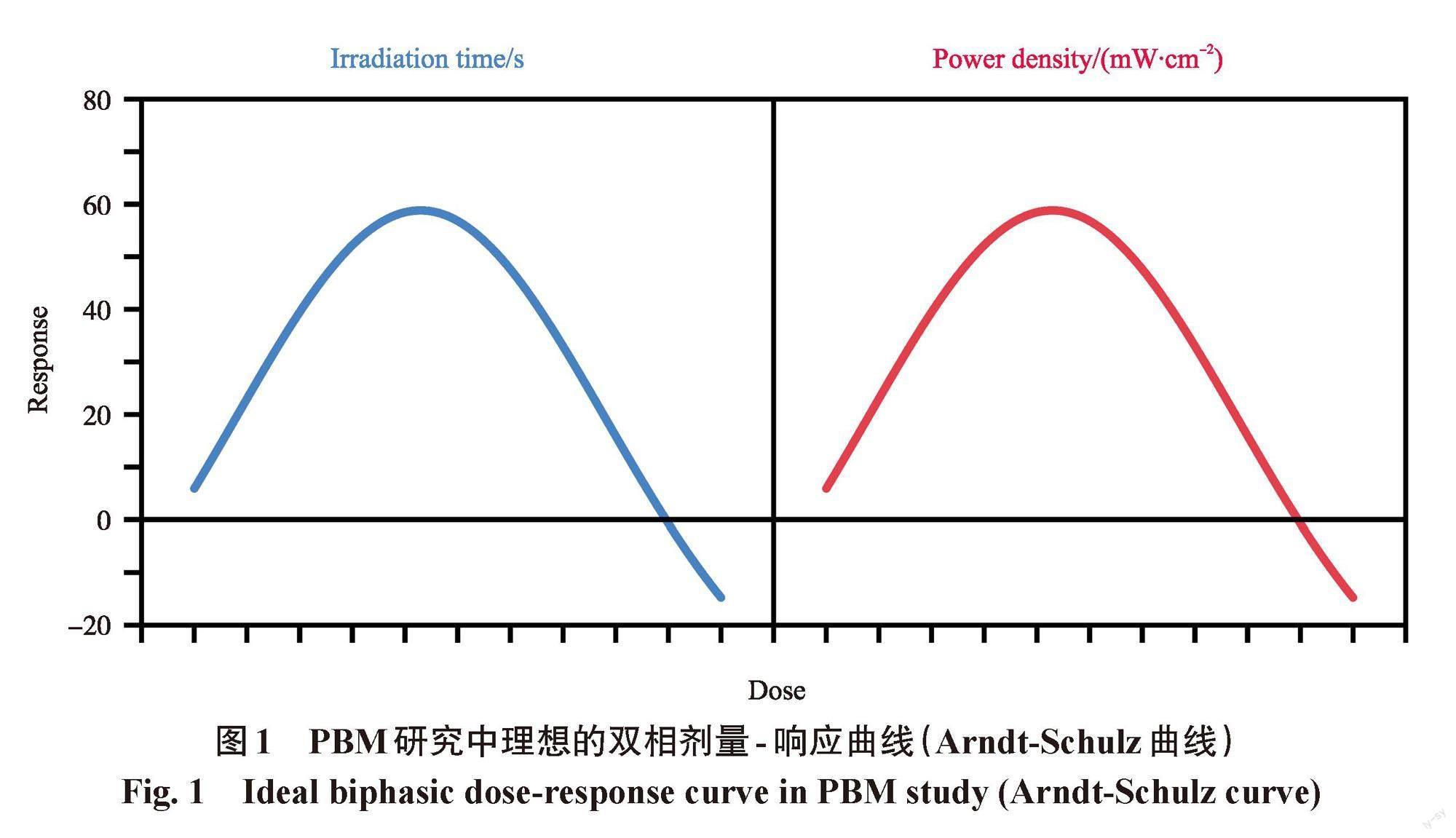
本生-罗斯科定律对于特定的线性吸收事件,以及在特定的剂量范围内当然是有效的,但PBM生物反应通常会引起非线性双相反应,这时本生-罗斯科定律就不再适用。PBM作用引起的非线性双相反应被称为Arndt-Schulz定律。这一定律的原理是:在非常低剂量范围内光对组织没有影响,随着剂量增加开始对组织有积极的影响,直到达到一个平稳期;如果光剂量继续增加超过某个阈值,有益的组织效应会逐渐减少,直到接近基线(即没有效果);而再增加剂量将会开始对组织产生破坏性影响。这种曲线在毒理学领域是众所周知的,这种现象被称为“毒素兴奋效应”[19]。该效应在图像上表示为“U”或“J”型曲线。出现这种“U”或“J”型曲线的部分解释是,小剂量的潜在毒性药物或有害干预可以诱导细胞内一系列保护性因子(如抗氧化酶和抗凋亡蛋白)的表达,这些保护性因子将增强细胞修复功能,并保护细胞免受随后的致命挑战。而随着毒素剂量增加到一定程度,细胞内保护因子不能抗衡,细胞功能被明显抑制,细胞遭受持续伤害[20]。
“Arndt-Schulz定律”是描述这种治疗剂量依赖效应的常用模型[21-22]。在PBM研究中会使用“双相”曲线来描述细胞、组织或人体对PBM的预期剂量反应。Nie等[23]给出的关于PBM双向剂量效应的一个理想化的例子有助于理解这一概念(图1)。该图解释了两种情况下的PBM双相反应:一是功率密度固定,照射时间变化所导致的细胞响应的变化;二是辐照时间固定,功率密度变化导致的响应变化。
2.2 PBM双向调节现象
关于PBM双相反应的研究已有较多报道。Li等[24]使用不同剂量的650 nm波长激光对人脐静脉内皮细胞的增殖作用进行了研究。该试验研究了功率密度、照射时间和辐射暴露(即能量密度)3个参数对于细胞增殖的影响。结果表明:在能量密度为4 J/cm2的条件下,采用的功率密度分别为2.07、11.3 mW/cm2和31.4 mW/cm2时,细胞增殖效应随功率密度加大而升高;而在相同功率密度下(31.4 mW/cm2),随着照射时间的延长,细胞生长呈现典型的U型效应,在照射时间为128 s时细胞增殖效应达到最高,但是当照射时间继续增加,达到640 s时,光照对细胞生长则产生抑制作用。
Lee等[25]采用635 nm激光来评估LLLT对动物模型中口腔溃疡的治疗效果,所用激光能量密度分别为5、20、75 J/cm2。结果表明:20 J/cm2试验组,口腔溃疡治疗效果最为显著;5 J/cm2或75 J/cm2并不能促进溃疡愈合。此结果表现为典型的PBM U型双向调节。
Dixit等[26]研究比较了810 nm激光对革兰氏阳性菌和革兰氏阴性菌的抗菌效果,所用激光能量密度分别为13、18 J/cm2和30 J/cm2。结果表明,粪肠球菌(Enterococcus faecalis)在13 J/cm2和30 J/cm2的剂量下抑制生长,在18 J/cm2的剂量下促进生长。这表现为典型的PBM U型双向调节。此外,该激光对于不同种类的菌也表现出不一样的效果。所有剂量的激光照射对大肠杆菌(Escherichia coli)、化脓性链球菌(Streptococcus pyogenes)、伤寒沙门氏菌(Salmonella typhi)的生长均有抑制作用;所有剂量的激光照射均促进肺炎克雷伯氏菌(Klebsiella pneumonae)、志贺氏菌(Shigella sp.)、金黄色葡萄球菌(Staphylococcus aureus)增殖。此结果也表现为典型的双相调节作用。
3 PBM对细菌的双向调节研究
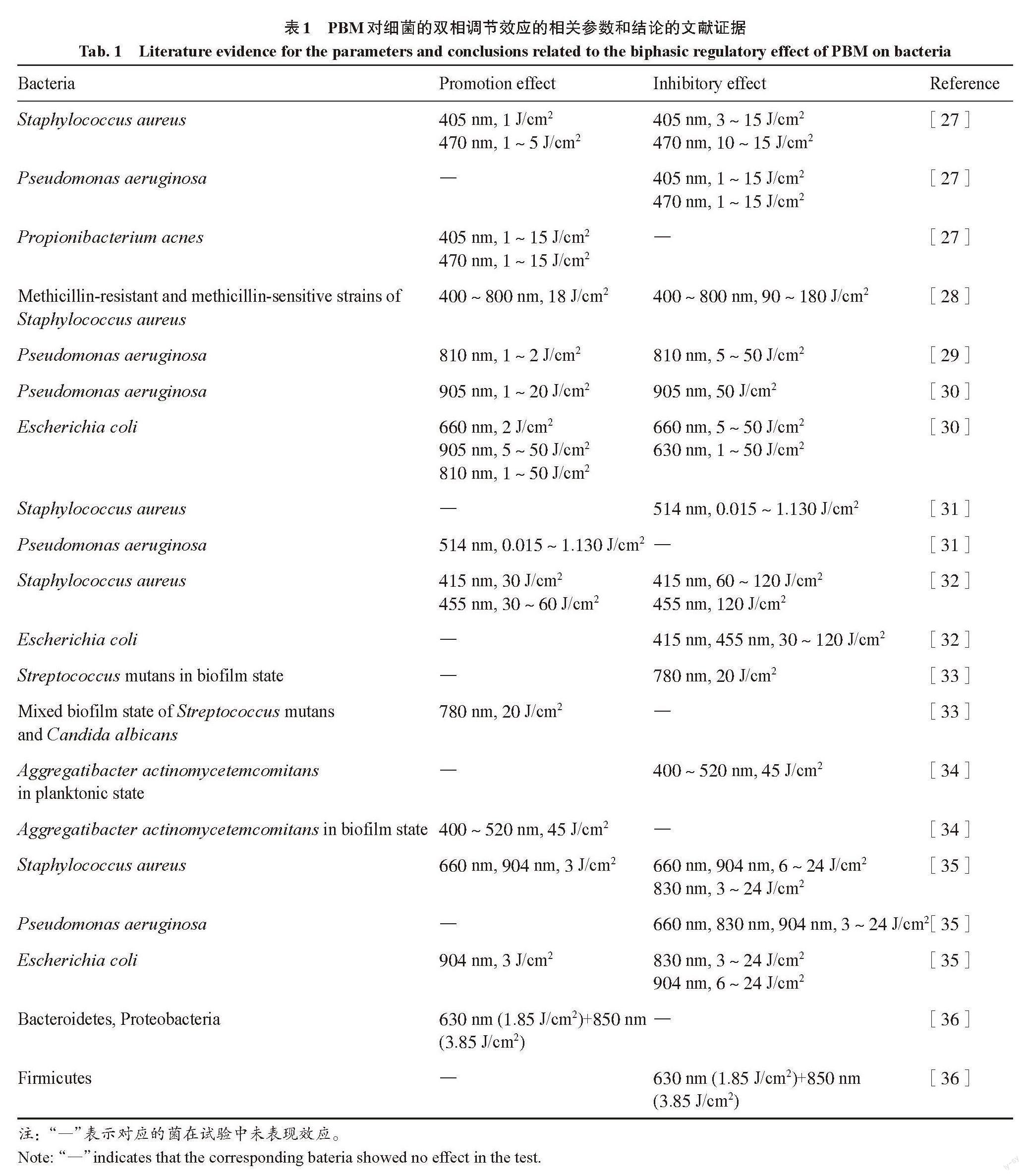
PBM双向效应在细菌的研究中表现也非常显著,主要与剂量、波长、细菌种类和细菌状态相关(表1)。
3.1 剂量的双向效应
Guffey等[27]研究了不同剂量PBM(1~15 J/cm2)在405 nm波长下对金黄色葡萄球菌和铜绿假单胞菌(Pseudomonas aeruginosa)的调节作用,结果表明:1 J/cm2剂量PBM对金黄色葡萄球菌有促进增殖的作用,而3~15 J/cm2则表现出抑制增殖的作用;但是同样的5个剂量对铜绿假单胞菌则都有杀菌效果,对痤疮丙酸杆菌(Propionibacterium acnes)都有促进增殖的效果。Lipovsky等[28]对甲氧西林敏感金黄色葡萄球菌(Methicillin-sensitive Staphylococcus aureus)和耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus)进行了PBM效果比较,他们发现:低剂量(18 J/cm2)白光照射对两种菌株均有促进增殖的作用,而高剂量(90 J/cm2)造成敏感株96.5%的杀菌率,耐药株59.3%的杀菌率;180 J/cm2则造成敏感株99.8%的杀菌率,耐药株55.5%的杀菌率。敏感株和耐药株对光剂量双向效应的响应差异,主要是因为敏感株内源性卟啉含量是耐药株的10倍,而对氧化应激的适应能力仅为耐药株的50%。Nussbaum等[29]发现,在810 nm光照下,光剂量为1 J/cm2 和2 J/cm2 时,对铜绿假单胞菌表现出明显的促生长作用,而当剂量增加到5~50 J/cm2,则会对铜绿假单胞菌产生抑制作用。Nussbaum等[30]还发现,在660 nm光照下,光剂量为5~50 J/cm2时,对大肠杆菌的生长产生抑制作用,而光剂量为2 J/cm2时对大肠杆菌的生长产生促进作用。此外,在905 nm光照下,光剂量为1~20 J/cm2时,对铜绿假单胞菌的生长产生促进作用,而光剂量为50 J/cm2时,对铜绿假单胞菌的生长产生抑制作用。这些研究表明,PBM对细菌表现出抑制或促进的双向效应与光照剂量密切相关,双向效应的U型或J型拐点与细菌的种类和状态相关。
3.2 波长的双向效应
Nussbaum等[30]使用630、660、810 nm和905 nm光在1~50 J/cm2剂量下对大肠杆菌进行照射,结果发现,630 nm的光照在1~50 J/cm2的剂量下均表现出抑制大肠杆菌增殖的作用,而810 nm波长则表现为促进大肠杆菌增殖的作用。他们还发现,在1 J/cm2剂量下,630 nm波长的光显著抑制铜绿假单胞菌生长,810 nm波长的光则促进其生长。此外,660 nm的光照在5~50 J/cm2的剂量下表现出对大肠杆菌的抑制生长作用,而905 nm光照在相同剂量下则表现为促进生长作用。Guffey等[27]使用405 nm和470 nm波长的光在1~15 J/cm2的剂量下对金黄色葡萄球菌进行光照,结果发现,在3 J/cm2和5 J/cm2剂量下,405 nm光照对金黄色葡萄球菌的生长表现出抑制作用,而470 nm光照则表现出促进作用。De Sousa等[35]分别使用660、830 nm和904 nm的光以及不同的光劑量来研究PBM抗菌作用,结果表明:3 J/cm2剂量下,660 nm的光对金黄色葡萄球菌有促进增殖的作用,而830 nm的光则是抑制生长的作用;同样剂量下,830 nm的光对大肠杆菌产生抑制作用,而904 nm的光产生促进增殖作用。这些研究表明了PBM对细菌表现出抑制或促进的双向效应与波长密切相关。
3.3 细菌种类的双向效应
Min等[36]采用630 nm/850 nm的双波长LED对十二指肠的肠道菌群进行光照。结果表明,照光1周后,厚壁菌门(Firmicutes)丰度减少,拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)丰度增加。这表明PBM的双向作用受细菌种类影响。Nussbaum等[30]使用630 nm和810 nm波长的光在1~50 J/cm2剂量下对铜绿假单胞菌和大肠杆菌进行光照,结果表明:在5~50 J/cm2剂量下,810 nm光照对铜绿假单胞菌表现出明显抑制生长的作用,而对大肠杆菌表现出明显促进生长的作用;在2 J/cm2剂量下,630 nm光照对铜绿假单胞菌表现出明显促进生长的作用,而对大肠杆菌表现出明显抑制生长的作用。Lipovsky等[32]使用415 nm和455 nm的光在30、60 J/cm2和120 J/cm2的剂量下对金黄色葡萄球菌和大肠杆菌进行照射。结果发现:在30 J/cm2剂量下,415 nm光照对金黄色葡萄球菌表现出促进生长的作用,而对大肠杆菌表现出抑制生长的作用;在120 J/cm2剂量下,455 nm光照对金黄色葡萄球菌表现出抑制生长的作用,而对大肠杆菌则表现出促进生长的作用。Dadras等[31]使用514 nm的激光在0.015~1.130 J/cm2剂量下对金黄色葡萄球菌和铜绿假单胞菌进行照射。结果显示,在514 nm光照下,所有剂量对铜绿假单胞菌均表现出显著地促进增殖作用,而对金黄色葡萄球菌则表现出显著地抑制增殖作用。这些研究表明了PBM对细菌表现出抑制或促进的双向效应与细菌种类密切相关。
3.4 细菌状态的双向效应
除了考虑细菌种类、光波长及光照剂量,细菌状态也是需要考虑的重要因素。虽然微生物可以独立共存,但它们经常相互作用,形成群落,被称为生物膜[37]。形成生物膜的微菌落可能由一种或多种微生物物种的种群组成,具体取决于它們形成的环境条件,例如,它们黏附的表面的性质,营养物质的存在,pH和氧气的可用性。Basso等[33]研究了780 nm 波长下PBM对变形链球菌(Streptococcus mutans)和白色念珠菌(Candida albicans)形成的生物膜的效应。他们发现,20 J/cm2对由变形链球菌形成的生物膜有90%的杀菌率,而对变形链球菌和白色念珠菌混合生长形成的生物膜表现为促进细菌增殖的作用。Song等[34]使用400~520 nm的卤素灯来研究光照对游离状态和生物膜状态的伴放线放线杆菌(Aggregatibacter actinomycetemcomitans)的生长影响。结果显示,45 J/cm2的剂量对浮游状态的伴放线放线杆菌表现出抑制生长作用,而对生物膜状态的伴放线放线杆菌表现出促进生长作用。这些研究表明了PBM对细菌表现出抑制或促进的双向效应与细菌状态密切相关。
4 PBM对细菌双向调节的影响因素与分子机制
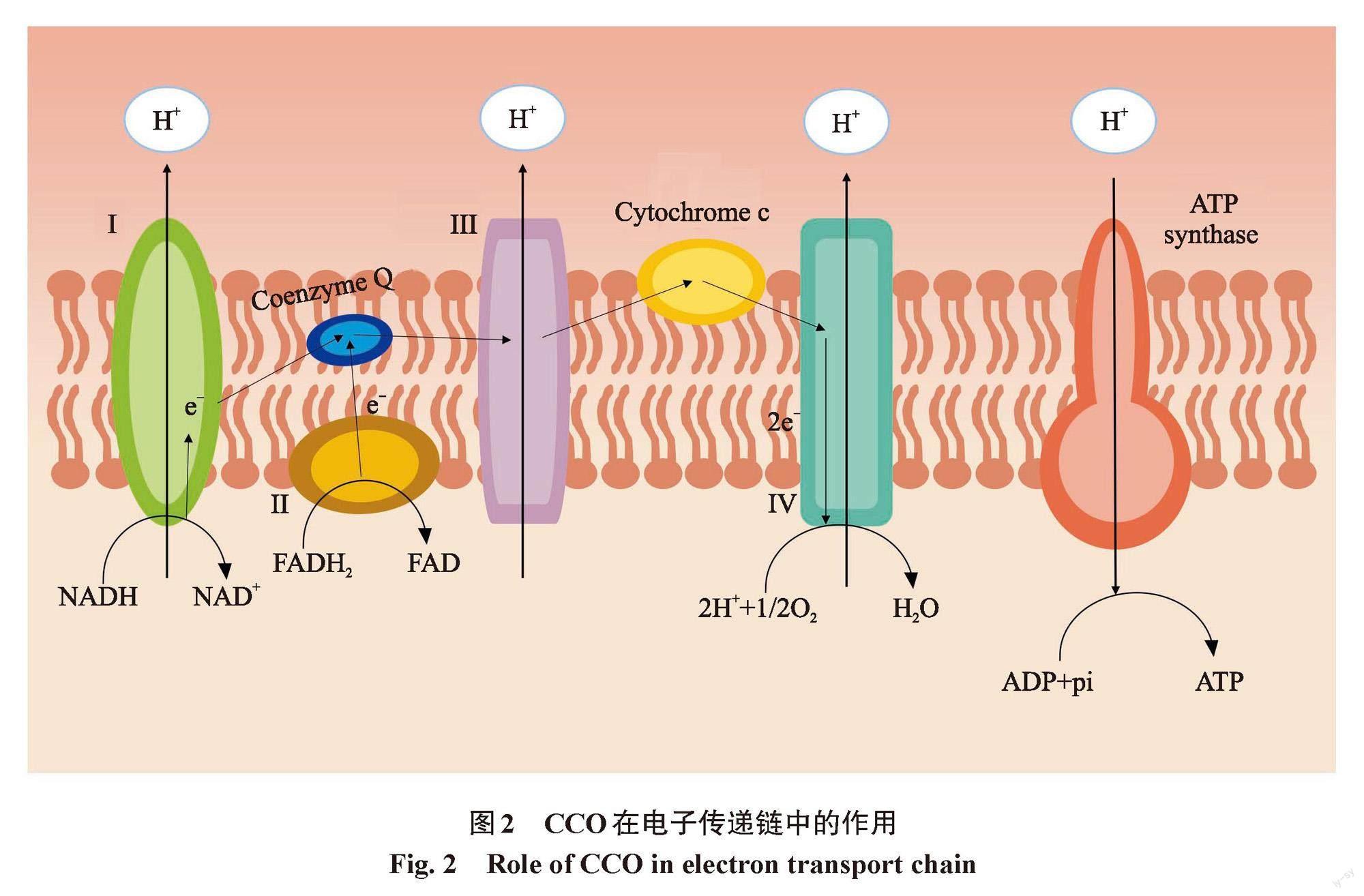
光生物调节对细菌的双向效应受到光的能量、波长、细菌类别、细菌状态等因素的影响。而产生这种双向效应的分子机制与细菌内的光靶点种类密切相关。细菌内光靶点主要包括两类:一类是光受体,即细胞内的生色基团,包括含有视网膜发色团的菌视紫红质、带有四吡咯发色团的拟菌植物色素、带有对香豆酸色基的光活性黄蛋白(photoactive yellow protein,PYP)、带有黄素单核苷酸(flavin mononucleotide,FMN)发色团的光氧电压(light-oxygen-voltage,LOV)结构域、带有黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)发色团的隐色剂和蓝光感应域等;另一类是内源性光敏剂,如卟啉类物质和黄素蛋白等。细胞色素c氧化酶(cytochrome c oxidase,CCO)是负责接收光照刺激从而诱导细胞内代谢活动发生变化的主要色团,它属于四吡咯发色团,是线粒体电子传递链中合成ATP的关键酶[38]。CCO含有两个铁离子和两个铜离子亚基,这些亚基的氧化和还原被认为是接收红/红外光辐射的发色团[39]。因此,在相应波长光的照射下,CCO被认为接收光子能量,促进电子转移,从而增加ATP合成。图2显示了CCO在ATP合成电子传递链中的作用。PBM可增加线粒体膜电位(mitochondrial membrane potential,MMP),从而增加电子传递。有研究表明,MMP的增加会产生活性氧(reactive oxygen species,ROS),功能失调的线粒体也会产生ROS[40]。线粒体中产生的ROS参与信号通路,引起细胞功能和状态的改变。
产生ROS过程的特征是一个自我放大的反馈回路,称为“ROS诱导的ROS释放(ROS-induced ROS release,RIRR)”[41]。在暴露于过度或长时间氧化应激的条件下,ROS的增加达到阈值水平,从而触发线粒体通道的打开,如线粒体通透性转变孔隙(mitochondrial permeability transition pore,MPTP)或线粒体内膜阴离子通道(inner membrane anion channels,IMAC)。这些通道的激活反过来导致MMP同时崩溃,并通过电子传递链增加ROS的生成[42]。足够多的ROS作为“第二信使”来激活邻近线粒体中的RIRR,作为另一个破坏性的反馈环来增加细胞损伤[43]。
有研究表明,PBM(810 nm)通过生成ROS作为信号分子来激活氧化还原敏感转录因子NF-κB[44]。NF-κB是一种负责细胞存活、抗凋亡和增殖的转录因子。也有报道称,高通量光照(包括红光和近红外)可通过产生高水平的ROS和Akt/GSK3beta信号通路诱导细胞凋亡,从而对细胞产生有害影响[45-46]。但有研究证明,低剂量产生非抑制性影响的PBM也通过相同的Akt/GSK3beta信号通路来抑制细胞凋亡[47]。Sharma等[48]用0.03、0.30、3、10 J/cm2或30 J/cm2的810 nm激光在不同时间以25 mW/cm2的功率密度来照射神经元,并在照射结束后5 min内使用荧光探针测量细胞内ROS、MMP和钙的水平。结果表明:在低至0.03 J/cm2时,ROS的初始浓度显著增加,在3 J/cm2时出现峰值,相当于基线ROS的3倍,但剂量增加到10 J/cm2时ROS显著下降(与3 J/cm2相比),30 J/cm2时,ROS再次显著增加(与10 J/cm2相比),比3 J/cm2时观察到的水平更高;此外,对于MMP和细胞内钙离子来说,3 J/cm2的影响最大,10 J/cm2或30 J/cm2效果降低,30 J/cm2使MMP降低到基线以下。这证明了PBM的双相剂量反应。同时结果表明了光诱导ROS可以在呼吸增加(有益)或呼吸减少(有害)时由线粒体产生。当线粒体被过量的ROS破坏时,呼吸作用降低,MMP也降低,这是诱导细胞凋亡的前奏。而合适剂量的光刺激可以从线粒体释放NO,增加ATP合成,同时产生适度水平的ROS,激活信号通路,但不产生细胞损伤,也不足以引发细胞凋亡。
此外,细胞内信号通路的活性受细胞内蛋白质的还原/氧化状态(氧化还原状态)的控制,这些蛋白质的状态会因为自由基特别是ROS的形成而发生改变。这些信号通路通过Ca2+ ATP酶、Na+/H+反向转运和Na+/Ca2+交换开启。钙离子通道接受光子后引起构象改变,Ca2+内流增加,引起系列变化。
细胞内的内源性光敏剂(如卟啉类物质和黄素蛋白等)具有吸收光并产生光化学反应的能力,不同的内源性光敏剂吸收光的波段范围有差异,对不同波段吸收能力也不同。如卟啉类物质在400~420 nm波段和610~620 nm波段均可被激发,但前者激发效率远高于后者;核黄素磷酸钠则可被375~400 nm波段和470 nm波长的光激发,前者激发效率更高。细菌接收特定波长的光源照射,处于基态的光敏剂吸收光能后会转化成高能量的单重态,单重态光敏剂通过发射荧光释放能量回到基态,或经系间跨越转化成稍稳定的三重态,三重态的光敏剂再释放能量回到基态,而释放出的能量可使周边的分子氧转换成为单态氧,或者通过氢离子、电子转移生成超氧化物和过氧化物等氧自由基。单态氧和氧自由基都属于ROS,ROS激活信号通路,按照上述机制,根据ROS产量的多少,或引起细胞坏死或凋亡,或激发细胞的代偿/修复机制[49]。图3展示了光敏剂分子在接收到光照后产生的光化学反应。正是由于内源性光敏剂的激发波长和激发效率的差异,PBM作用于不同的细菌种类通常会表现出不同的生物效应。
PBM对细菌生物膜的双向调节作用可能与生物膜浑浊有关。生物膜的存在会使得生物膜深处光的穿透力减少,接收到的光剂量降低,因此,与游离态的细菌相比,同种细菌组成的生物膜却可能表现出不同的生物效应。另外,生物膜内ROS的含量也可能是影响因素之一。Werner等[50]报告了铜绿假单胞菌生物膜内合成代谢模式的异质性。微电极探测表明,生物膜的底部是缺氧的,那里几乎没有细菌的生长和代谢活动。而细胞内ROS的产生是氧依赖性的,缺氧条件下ROS的产生受到阻碍,因此,与游离状态相比,生物膜状态下的细菌在接收光照后产生的ROS含量降低。由此可见,PBM对同一细菌的游离状态和生物膜状态会表现出不同的生物效应。
5 PBM对细菌双向作用的应用
PBM双向作用的典型应用是促进伤口愈合。LYU等[51]使用中心波长为465 nm和625 nm的红蓝光LED灯(red and blue led light,RBLL)对耐甲氧西林金黄色葡萄球菌、产β-内酰胺酶的超广谱大肠杆菌(extended-spectrum β-lactamases -producing Escherichia coli)和多重耐药的铜绿假单胞菌(multi-drug resistant Pseudomonas aeruginosa)感染的雄性小鼠(Sprague-Dawley rat)伤口分别进行照光,结果表明,RBLL降低了3种伤口表面致病菌的水平,加速了伤口愈合。这证实了PBM采用不同波长和剂量等参数的配伍可以实现对伤口感染细菌的抑制和伤口组织的修复。
近年来,PBM对细菌双向调节的特性被用于肠道菌群的调节。Bicknell等[52]发现,PBM照射到健康小鼠的腹部可以使肠道微生物组产生显著变化。在红外光照射(808 nm)14 d后,小鼠微生物群中有益细菌异杆菌属(Allobaculum)的比率显著上升。肠道菌群作为一个生态系统,庞大复杂,种类繁多,数量极大,与宿主之间保持着复杂的动态平衡,与机体的健康状态密切相关。肠道菌群在机体的新陈代谢中发挥着不同的生理功能,并与肠道内环境保持着动态平衡,一旦这种平衡被打破,则会导致相应的疾病。大量临床和试验数据表明,肠道各项生理功能的正常运转有赖于肠道内环境的稳定,这与肠道菌群、肠道上皮细胞及免疫系统间的动态平衡息息相关。一旦在药物、免疫力下降或其他内外因素的影响下,肠道菌群出现失调,则会不可避免地破坏免疫稳态,进而影响肠道的生理机能及免疫功能,对人体健康造成巨大影响。相反,当肠道菌群失调状态改善之后,相关疾病也能得到改善。Yao等[53]发现,小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)这一肠道微生物生态失调状况与肥胖和糖尿病之间密切相关。益生菌治疗可有效治疗SIBO,改善肠黏膜损伤,对改善肥胖和糖脂代谢参数有积极影响。这证实了肠道微生物组与肥胖和糖尿病之间的关联。Ni等[54]发现,长双歧杆菌(Bifidobacterium longum)和干酪乳杆菌(Lactobacillus casei)益生菌改变了炎症性肠病(inflammatory bowel disease,IBD)斑马鱼(wild-type AB zebrafish)的微生物群组成和功能,改善了斑马鱼模型的溃疡性结肠炎和克罗恩病。这表明,肠道微生物组与炎症性肠病密切相关。Qin等[55]发现,与健康人相比,肺癌患者具有独特的肠道菌群特征,并且密度和菌群多样性较低。此外,肺癌患者菌群科和属的结构较为复杂,具有特定的病原微生物群,这证实了肠道微生物组与肺癌的关联。Gagné等[56]发现,移植不含益生菌的生态失调微生物群使大鼠(Sprague-Dawley albino male rats)心肌梗死面积增加,证实了肠道菌群微生物组与心血管疾病的关联。Ishii等[57]发现,口服短双歧杆菌(Bifidobacterium breve)A1可促进帕金森(Parkinsons disease,PD)小鼠恐惧消退,改善PD小鼠的认知缺陷。大量研究表明,肠道菌群与肥胖、糖尿病、克罗恩病、免疫缺陷性肠道疾病、类风湿性关节炎、结直肠癌、肺癌、心血管疾病、神经退行性疾病等疾病密切相关。Min等[36]使用630 nm/850 nm的LED(由1.85 J/cm2剂量的630 nm光与3.85 J/cm2剂量的850 nm光组合)照射十二指肠,发现肠道菌群组成发生了显著改变,血清胰岛素上升,高血糖症状得到改善。本课题组在630、730、850 nm波长下,以100 J/cm2对阿尔兹海默症(Alzheimers disease,AD)小鼠腹部进行PBM干预,结果表明,3个波长的PBM都显著改变了肠道菌群的多样性和丰度,同时提高了AD小鼠的学习记忆能力,海马淀粉样变性和tau磷酸化减少,病情得到显著改善[58]。Pan等[59]使用了上转换光遗传学微纳米系统,通过腹部照光来观察对于AD治疗的作用,发现腹部照光改变了AD小鼠的肠道菌群微生物的多样性以及菌种丰度,减轻了全身炎症,并且改善了AD小鼠的认知能力,降低了AD小鼠的焦虑行为,达到了改善AD症状的作用。这些研究均提示了PBM对细菌的双向调节作用在肠道菌群失衡调节方面的应用潜力,PBM作为一种非侵入性的物理干预手段,必将受到越来越多的关注。
6 总结与展望
由细菌感染造成的疾病多种多样,不断威胁着人体健康。此外,近年来人体肠道菌群失调也被证明与人体多种疾病密切相关。寻找一种有效的促菌抗菌策略对于治疗细菌感染以及调节肠道菌群组成至关重要。PBM作为一种无创的物理干预手段备受关注。因此,本文总结了PBM对于细菌的双向调节作用,总结了多年来光生物调节作用于细菌的相关研究,总结了雙向调节的影响因素及其分子机制。
PBM对于细菌生长表现出双向调节作用,通过对不同PBM参数的结果进行比较,支持了这一观点。总结相关研究发现:1)在所有研究中,正向效应或者促进作用的光剂量一般在1~2 J/cm2,而抑制效应一般大于3 J/cm2,且波长越短剂量阈值越低,这是由于内源性光敏剂是细菌抑制的主要光靶点,而这些内源性光敏剂的激发光谱特点是波长越短激发效率越高;2)对于红光、近红外光和红外光,由于不能激发内源性光敏剂,其抑制细菌的作用机制是使得对应光受体在过量光子能量下发生破坏性效应,因此抑制剂量范围较大,多在10 J/cm2以上;3)不同的细菌由于含有的光受体不同,双向效应的U曲线也会前移或后移,具体应用上还需要深入验证。
PBM雙向调节的特性使得PBM在多个领域都有着重要应用。PBM最典型的应用在于通过有效的抗菌作用促进伤口修复。并且多项研究表明,PBM双向调节作用能够调节肠道菌群组成,改善肠道菌群失衡[57-59]。PBM在治疗与细菌相关的疾病方面发挥出巨大的潜力。然而,目前的研究还未对PBM参数的选择以及对应结果产生标准,并且PBM对细菌产生双向调节的具体分子机制还不够清晰,不同的PBM参数是否会导致细胞水平上不同分子通路的激活还有待继续研究。未来的研究应继续探索PBM剂量的具体参数,这是影响PBM临床效果的最大障碍。这将使PBM最终标准化为针对各种疾病的单药治疗或辅助治疗。PBM为那些由于医学禁忌症、经济成本或其他原因无法接受传统治疗的患者提供了新的希望。
参考文献(References):
[1] STRACY M, SNITSER O, YELIN I, et al. Minimizing treatment-induced emergence of antibiotic resistance in bacterial infections [J]. Science (New York, NY), 2022, 375(6583): 889-894.
[2] HANNA R, DALVI S, S?L?GEAN T, et al. Phototherapy as a rational antioxidant treatment modality in COVID-19 management; new concept and strategic approach: critical review [J]. Antioxidants (Basel, Switzerland), 2020, 9(9):875.
[3] ARANY P R. Craniofacial wound healing with photobiomodulation therapy: new insights and current challenges [J]. Journal of Dental Research, 2016, 95(9): 977-984.
[4] CARROLL J D, MILWARD M R, COOPER P R, et al. Developments in low level light therapy (LLLT) for dentistry [J]. Dental materials: Official Publication of the Academy of Dental Materials, 2014, 30(5): 465-475.
[5] ASSIS L, MORETTI A I, ABRAH?O T B, et al. Low-level laser therapy (808 nm) reduces inflammatory response and oxidative stress in rat tibialis anterior muscle after cryolesion [J]. Lasers in Surgery and Medicine, 2012, 44(9): 726-735.
[6] ANDERS J J, LANZAFAME R J, ARANY P R. Low-level light/laser therapy versus photobiomodulation therapy [J]. Photomedicine and Laser Surgery, 2015, 33(4): 183-184.
[7] LEE J H, CARPENA N T, KIM S, et al. Photobiomodulation at a wavelength of 633 nm leads to faster functional recovery than 804 nm after facial nerve injury [J]. Journal of Biophotonics, 2021, 14(10): e202100159.
[8] KASOWANJETE P, ABRAHAMSE H, HOURELD N N. Photobiomodulation at 660 nm stimulates in vitro diabetic wound healing via the Ras/MAPK pathway [J]. Cells, 2023, 12(7):1080.
[9] SERT G, KUCUKGUVEN A, ZIRH E B, et al. Photobiomodulation with polychromatic light (600~1 200 nm) improves fat graft survival by increasing adipocyte viability, neovascularization, and reducing inflammation in a rat model [J]. Lasers in Surgery and Medicine, 2022, 54(2): 268-280.
[10] YARAL ?EVIK Z B, KARAMAN O, TOPALO?LU N. Photobiomodulation therapy at red and near-infrared wavelengths for osteogenic differentiation in the scaffold-free microtissues [J]. Journal of Photochemistry and Photobiology B, Biology, 2023, 238: 112615.
[11] LIPKO N B. Photobiomodulation: evolution and adaptation[J]. Photobiomodulation, Photomedicine, and Laser Surgery, 2022, 40(4): 213-233.
[12] ZECHA J A, RABER-DURLACHER J E, NAIR R G, et al. Low level laser therapy/photobiomodulation in the management of side effects of chemoradiation therapy in head and neck cancer: part 1: mechanisms of action, dosimetric, and safety considerations [J]. Supportive Care in Cancer: Official Journal of the Multinational Association of Supportive Care in Cancer, 2016, 24(6): 2781-2792.
[13] RAMOS L, MARCOS R L, TORRES-SILVA R, et al. Characterization of skeletal muscle strain lesion induced by stretching in rats: effects of laser photobiomodulation [J]. Photomedicine and Laser Surgery, 2018, 36(9): 460-467.
[14] ALIODOUST M, BAYAT M, JALILI M R, et al. Evaluating the effect of low-level laser therapy on healing of tentomized Achilles tendon in streptozotocin-induced diabetic rats by light microscopical and gene expression examinations [J]. Lasers in Medical Science, 2014, 29(4): 1495-1503.
[15] HEISKANEN V, HAMBLIN M R. Photobiomodulation: lasers vs. light emitting diodes? [J]. Photochemical & Photobiological Sciences: Official Journal of the European Photochemistry Association and the European Society for Photobiology, 2018, 17(8): 1003-1017.
[16] RUPEL K, ZUPIN L, COLLIVA A, et al. Photobiomodulation at multiple wavelengths differentially modulates oxidative stress in vitro and in vivo [J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 6510159.
[17] PEREIRA F C, PARISI J R, MAGLIONI C B, et al. Antinociceptive effects of low-level laser therapy at 3 and 8 J/cm2 in a rat model of postoperative pain: possible role of endogenous opioids [J]. Lasers in Surgery and Medicine, 2017, 49(9): 844-851.
[18] HARORLI O T, HATIPOGLU M, ERIN N. Effect of photobiomodulation on secretion of IL-6 and IL-8 by human gingival fibroblasts in vitro [J]. Photobiomodulation, Photomedicine, and Laser Surgery, 2019, 37(8): 457-464.
[19] CALABRESE E J, IAVICOLI I, CALABRESE V. Hormesis: its impact on medicine and health [J]. Human & Experimental Toxicology, 2013, 32(2): 120-152.
[20] AGRAWAL T, GUPTA G K, RAI V, et al. Pre-conditioning with low-level laser (light) therapy: light before the storm [J]. Dose-response: a Publication of International Hormesis Society, 2014, 12(4): 619-649.
[21] HAWKINS D, ABRAHAMSE H. Effect of multiple exposures of low-level laser therapy on the cellular responses of wounded human skin fibroblasts [J]. Photomedicine and Laser Surgery, 2006, 24(6): 705-714.
[22] CHOW R T, HELLER G Z, BARNSLEY L. The effect of 300 mW, 830 nm laser on chronic neck pain: a double-blind, randomized, placebo-controlled study [J]. Pain, 2006, 124(1/2): 201-210.
[23] NIE F, HAO S, JI Y, et al. Biphasic dose response in the anti-inflammation experiment of PBM [J]. Lasers in Medical Science, 2023, 38(1): 66.
[24] LI Y, XU Q, SHI M, et al. Low-level laser therapy induces human umbilical vascular endothelial cell proliferation, migration and tube formation through activating the PI3K/Akt signaling pathway [J]. Microvascular Research, 2020, 129: 103959.
[25] LEE H S, LEE Y, JEONG U, et al. Transoral low-level laser therapy via a cylindrical device to treat oral ulcers in a rodent model [J]. Lasers in Surgery and Medicine, 2020, 52(7): 647-652.
[26] DIXIT S, AHMAD I, HAKAMI A, et al. Comparison of anti-microbial effects of low-level laser irradiation and microwave diathermy on gram-positive and gram-negative bacteria in an in vitro model [J]. Medicina (Kaunas, Lithuania), 2019, 55(7):330.
[27] GUFFEY J S, WILBORN J. In vitro bactericidal effects of 405-nm and 470-nm blue light [J]. Photomedicine and Laser Surgery, 2006, 24(6): 684-688.
[28] LIPOVSKY A, NITZAN Y, FRIEDMANN H, et al. Sensitivity of Staphylococcus aureus strains to broadband visible light [J]. Photochemistry and Photobiology, 2009, 85(1): 255-260.
[29] NUSSBAUM E L, LILGE L, MAZZULLI T. Effects of 810 nm laser irradiation on in vitro growth of bacteria: comparison of continuous wave and frequency modulated light [J]. Lasers in Surgery and Medicine, 2002, 31(5): 343-351.
[30] NUSSBAUM E L, LILGE L, MAZZULLI T. Effects of 630-, 660-, 810-, and 905-nm laser irradiation delivering radiant exposure of 1~50 J/cm2 on three species of bacteria in vitro [J]. Journal of Clinical Laser Medicine & Surgery, 2002, 20(6): 325-333.
[31] DADRAS S, MOHAJERANI E, EFTEKHAR F, et al. Different photoresponses of Staphylococcus aureus and Pseudomonas aeruginosa to 514, 532, and 633 nm low level lasers in vitro [J]. Current Microbiology, 2006, 53(4): 282-286.
[32] LIPOVSKY A, NITZAN Y, GEDANKEN A, et al. Visible light-induced killing of bacteria as a function of wavelength: implication for wound healing [J]. Lasers in Surgery and Medicine, 2010, 42(6): 467-472.
[33] BASSO F G, OLIVEIRA C F, FONTANA A, et al. In vitro effect of low-level laser therapy on typical oral microbial biofilms [J]. Brazilian Dental Journal, 2011, 22(6): 502-510.
[34] SONG H H, LEE J K, UM H S, et al. Phototoxic effect of blue light on the planktonic and biofilm state of anaerobic periodontal pathogens [J]. Journal of Periodontal & Implant Science, 2013, 43(2): 72-78.
[35] DE SOUSA N T, GOMES R C, SANTOS M F, et al. Red and infrared laser therapy inhibits in vitro growth of major bacterial species that commonly colonize skin ulcers [J]. Lasers in Medical Science, 2016, 31(3): 549-556.
[36] MIN S H, KWON J, DO E J, et al. Duodenal dual-wavelength photobiomodulation improves hyperglycemia and hepatic parameters with alteration of gut microbiome in type 2 diabetes animal model [J]. Cells, 2022, 11(21):3490.
[37] SHIRTLIFF M E, PETERS B M, JABRA-RIZK M A. Cross-kingdom interactions: Candida albicans and bacteria [J]. FEMS Microbiology Letters, 2009, 299(1): 1-8.
[38] KARU T. Primary and secondary mechanisms of action of visible to near-IR radiation on cells [J]. Journal of Photochemistry and Photobiology B, Biology, 1999, 49(1): 1-17.
[39] DE FREITAS L F, HAMBLIN M R. Proposed mechanisms of photobiomodulation or low-level light therapy [J]. IEEE Journal of Selected Topics in Quantum Electronics: a Publication of the IEEE Lasers and Electro-optics Society, 2016, 22(3):7000417.
[40] SUSKI J M, LEBIEDZINSKA M, BONORA M, et al. Relation between mitochondrial membrane potential and ROS formation [J]. Methods in Molecular Biology (Clifton, NJ), 2012, 810: 183-205.
[41] ZOROV D B, JUHASZOVA M, SOLLOTT S J. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release [J]. Physiological Reviews, 2014, 94(3): 909-950.
[42] ZOROV D B, FILBURN C R, KLOTZ L O, et al. Reactive oxygen species (ROS)-induced ROS release: a new phenomenon accompanying induction of the mitochondrial permeability transition in cardiac myocytes [J]. The Journal of Experimental Medicine, 2000, 192(7): 1001-1014.
[43] ZOROV D B, JUHASZOVA M, SOLLOTT S J. Mitochondrial ROS-induced ROS release: an update and review [J]. Biochimica et Biophysica Acta, 2006, 1757(5/6): 509-517.
[44] CHEN A C-H, HUANG Y Y, ARANY P R, et al. Role of reactive oxygen species in low level light therapy[C]//Mechanisms for Low-Light Theray Ⅳ, San Jose: SPIE BIOS, 2009: 716502.
[45] SUN X, WU S, XING D. The reactive oxygen species-Src-Stat3 pathway provokes negative feedback inhibition of apoptosis induced by high-fluence low-power laser irradiation [J]. The FEBS Journal, 2010, 277(22): 4789-4802.
[46] HUANG L, WU S, XING D. High fluence low-power laser irradiation induces apoptosis via inactivation of Akt/GSK3β signaling pathway [J]. Journal of Cellular Physiology, 2011, 226(3): 588-601.
[47] ZHANG L, ZHANG Y, XING D. LPLI inhibits apoptosis upstream of Bax translocation via a GSK-3beta-inactivation mechanism [J]. Journal of Cellular Physiology, 2010, 224(1): 218-228.
[48] SHARMA S K, KHARKWAL G B, SAJO M, et al. Dose response effects of 810 nm laser light on mouse primary cortical neurons [J]. Lasers in Surgery and Medicine, 2011, 43(8): 851-859.
[49] ESPADA J, CARRASCO E, CALVO-S?NCHEZ M I, et al. Stimulation of stem cell niches and tissue regeneration in mouse skin by switchable protoporphyrin IX-dependent photogeneration of reactive oxygen species in situ [J]. Journal of Visualized Experiments: JoVE, 2020, (159): e60859.
[50] WERNER E, ROE F, BUGNICOURT A, et al. Stratified growth in Pseudomonas aeruginosa biofilms [J]. Applied and Environmental Microbiology, 2004, 70(10): 6188-6196.
[51] LYU Y, CHEN Z, YANG Z, et al. Evaluation of the red & blue LED effects on cutaneous refractory wound healing in male Sprague-Dawley rat using 3 different multi-drug resistant bacteria [J]. Lasers in Surgery and Medicine, 2022, 54(5): 725-736.
[52] BICKNELL B, LIEBERT A, JOHNSTONE D, et al. Photobiomodulation of the microbiome: implications for metabolic and inflammatory diseases [J]. Lasers in Medical Science, 2019, 34(2): 317-327.
[53] YAO Q, YU Z, MENG Q, et al. The role of small intestinal bacterial overgrowth in obesity and its related diseases [J]. Biochemical Pharmacology, 2023, 212: 115546.
[54] NI Y, ZHANG Y, ZHENG L, et al. Bifidobacterium and Lactobacillus improve inflammatory bowel disease in zebrafish of different ages by regulating the intestinal mucosal barrier and microbiota [J]. Life Sciences, 2023, 324: 121699.
[55] QIN X, BI L, YANG W, et al. Dysbiosis of the gut microbiome is associated with histopathology of lung cancer [J]. Frontiers in Microbiology, 2022, 13: 918823.
[56] GAGN? M A, BARBEAU C, FR?GEAU G, et al. Dysbiotic microbiota contributes to the extent of acute myocardial infarction in rats [J]. Scientific Reports, 2022, 12(1): 16517.
[57] ISHII T, FURUOKA H, KAYA M, et al. Oral administration of probiotic bifidobacterium breve improves facilitation of hippocampal memory extinction via restoration of aberrant higher induction of neuropsin in an MPTP-induced mouse model of Parkinsons disease [J]. Biomedicines, 2021, 9(2): 167.
[58] CHEN Q, WU J, DONG X, et al. Gut flora-targeted photobiomodulation therapy improves senile dementia in an A beta-induced Alzheimers disease animal model [J]. Journal of Photochemistry and Photobiology B, Biology, 2021, 216: 112152.
[59] PAN H, SUN T, CUI M, et al. Light-sensitive Lactococcus lactis for microbe-gut-brain axis regulating via upconversion optogenetic micro-nano system [J]. ACS Nano, 2022, 16(4): 6049-6063.
