一株白地霉在低碳氮比废水中降氨氮新功能的研究
2024-01-26刘辉李晓超毛晓茜鲁冰花曾桂华李华林王雪景陈佳艳肖亚梅李庄刘文彬杨利平
刘辉 李晓超 毛晓茜 鲁冰花 曾桂华 李华林 王雪景 陈佳艳 肖亚梅 李庄 刘文彬 杨利平
摘 要:该文从垃圾渗滤液中筛选出一株低C/N营养条件下氨氮去除效果显著的菌株。ITS序列测序鉴定表明,该菌株为白地霉(Galactomyces candidum)。经不同pH、温度、C/N的培养条件下培养24 h,测定其生长密度及氨氮去除情况,结果发现,白地霉培养基最佳降氨氮条件为:pH 8.0,C/N 1.5,温度 30℃,其最佳氨氮去除率可达93.1%。该文发现了白地霉在污水处理,尤其是低C/N污水处理中具有氨氮去除的新功能,为其在低C/N污水生化处理工业化应用提供了新的菌株资源和技术途径。
关键词:白地霉;低C/N;降氨氮;废水处理;培养条件
中图分类号:X703 文献标志码:A DOI:10.3969/j.issn.1007-7146.2023.01.012
A Novel Function of Galactomyces candidum in Highly Efficient Ammonia Nitrogen Removal from Low C/N Wastewater
LIU Hui1#, LI Xiaochao1#, MAO Xiaoqian3#, LU Binghua1, ZENG Guihua1, LI Hualin1, WANG Xuejing2, CHEN Jiayan2, XIAO Yamei2, LI Zhuang3, LIU Wenbin2*, YANG Liping1*
(1. College of Environmental Resources, Changsha Environmental Protection College, Changsha 410004, China;
2. State Key Laboratory of Freshwater Fish Developmental Biology, College of Life Sciences, Hunan Normal University, Changsha 410012, China; 3. Hunan Ecological and Environmental Affairs Center, Changde 415003, China)
Abstract: A strain of microorganism that demonstrated efficient nitrogen removal potential under low C/N conditions was screened from landfill leachate. The strain was identified as Galactomyces candidum by ITS sequencing, and growth density and removal of ammonia nitrogen were assessed after 24 h of incubation. The results showed that the optimum ammonia nitrogen reduction conditions for G. candidum was at pH 8.0 and 30 ℃, with a C/N ratio of 1.5; the highest rate of ammonia nitrogen removal was 93.1%. This novel function of G. candidum offers great potential in the removal of ammonia nitrogen from sewage, especially in low C/N wastewater. Our study provides a new theoretical basis for the industrial application of microorganism in the biochemical treatment of wastewater and reduces environmental pollution.
Key words: Galactomyces candidum; low C/N; ammonia nitrogen reduction; wastewater treatment; culture conditions
(Acta Laser Biology Sinica, 2023, 32(1): 089-096)
氨氮去除是污水處理,尤其是低C/N污水处理中的一个热门研究[1-2]。在我国受污染河水、地下水、垃圾渗滤液以及石油化工、化肥、味精等行业的生产废水都具有低碳氮比的特点[3]。传统生物污水处理需耗费大量的能源与碳源才能完成脱氮过程[4]。因此,找到低碳条件下高效降氨氮菌株能在一定程度上解决低C/N废水脱氮问题。不同的真菌对碳氮比有不同的要求,且一般碳氮比>10[5]。邓玮玮等[6]报道称厌氧氨氧化菌与反硝化菌两种自养细菌针对低碳氮比污水的脱氮处理效果比较好。Li等[7]、Yang等[8]发现在低碳氮比营养条件下能高效率去除氨氮的菌株。
白地霉(Galactomyces candidum)是广泛存在于环境中的一类真核微生物,形态特征介于酵母菌与霉菌之间,常应用于奶酪[9]、啤酒[10]、白酒、腐乳等食品酿造中。它能够生产果胶酶[11]、辅酶Q、脂肪酶,提高中链脂肪酸含量和抗微生物活性[12]等。在污水处理方面,有研究表明,白地霉有降低废水中化学需氧量(chemical oxygen demand,COD)[13-15]的作用,但白地霉氨氮去除性能尚无文献报道。本文筛选的白地霉(以下简称GC菌)能够在低C/N营养条件下生长良好,且具有显著氨氮去除的效果。本研究结果表明,白地霉作为一种新的菌种,对氨氮去除具有显著效果,可在低C/N污水处理工艺中发挥重要作用。
1 材料与方法
1.1 培养基
矿质培养基(g/L):NH4Cl 0.246 g、MgSO4·7H2O 0.039 g、CaCl2 0.055 g、FeSO4·7H2O 0.010 g、CuSO4·5H2O 0.000 024 g、K2HPO4 0.348 g、葡萄糖3.603 g、瓊脂20.0 g、1 000 mL蒸馏水,115℃高温高压灭菌30 min [16]。
牛肉膏蛋白胨(Luria-Bertani,LB)培养基:胰蛋白胨10.0 g、酵母浸粉5.0 g、氯化钠10.0 g、琼脂20.0 g溶于1 L蒸馏水中,121℃、15 min灭菌。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:蛋白胨10.0 g、葡萄糖20.0 g、酵母粉5.0 g、琼脂粉20.0 g(固体),溶于1 L蒸馏水中,121℃、15 min灭菌。
乳酸细菌(De Man Rogosa and Sharp,MRS)培养基:蛋白胨10.00 g、牛肉浸粉5.00 g、酵母浸粉4.00 g、葡萄糖20.00 g、磷酸氢二钾2.00 g、柠檬酸三铵2.00 g、醋酸钠5.00 g、硫酸镁0.20 g、硫酸锰0.05 g、琼脂20.00 g、吐温801.0 mL,121℃、15 min灭菌。
1.2 菌种分离筛选
利用无菌生理盐水把从垃圾填埋处理场取来的垃圾渗滤液稀释 10倍。为使微生物细胞分散,形成均匀的菌悬液,在上述液体中加入数颗玻璃珠,充分震荡 20~30 min。在无菌条件下,将上述混合菌种的液体采用稀释平板法分别转接到LB、YPD、MRS固体培养基上,分别于37、30、30℃恒温培养箱倒置培养24~48 h后,将有单个菌形成的菌种圈挑出,进一步通过划线法纯化,直到得到纯菌株并将其保存于-80℃冰箱。将分离纯化的菌种活化培养,挑单菌落于5 mL灭菌后的LB、YPD、MRS液体培养基中,培养24 h。取1%菌液以12 000 r/min离心10 min,弃去上清液。加入生理盐水打散,混匀后离心。弃去液体,重复3次。将菌体加入100 mL氨氧化选择培养基中,放入30℃、150 r/min恒温培养箱中震荡培养。24 h后,用比浊法(OD600 nm)检测菌体数量。纳氏试剂法[17]检测其菌体培养基氨氮含量,以不接菌的培养基做对照,计算氨氮去除率并从中筛选出一株对氨氮去除效果最好的菌株GC。
1.3 菌种鉴定
按照真菌试剂盒上方法提取DNA,试剂盒购自BIOMIGA。采用扩增ITS基因的通用引物。前引物ITS1(5' TCCGTAGGTGAACCTGCGG3'),后引物ITS4(5' TCCTCCGCTTATTGATATGC3')。PCR反应条件为:94℃预变性5 min;94℃变性30 s;54℃退火45 s;72℃延伸1 min,经过 30个循环后,72 ℃再延伸10 min。将PCR产物送至公司测序(北京擎科新业生物技术有限公司长沙分公司),得到的基因序列上传至NCBI网站进行序列比对。最后,用MEGA6.0软件通过邻接法构建系统发生树。
1.4 培养基单因素优化
将GC菌用YPD培养基扩大培养。离心后,将离心管底部菌体接种到氨氧化培养基中,探讨其在不同培养基初始pH、不同培养温度和培养基不同C/N比时对氨氮去除能力的影响。pH调节为3.0、4.0、5.0、6.0、7.0、8.0、9.0,在30℃、150 r/min摇床中进行培养。温度选择10、20、25、30、37、42℃,在150 r/min摇床培养24 h。C/N等于0、1.0、1.5、2.0、3.0、4.0(培养基固定NH4Cl 为0.246 g,葡萄糖为唯一碳源),在30℃、150 r/min摇床进行培养。所有试验菌液的接种量均为1%,并以原培养基作对照。培养24 h后,比较氨氮浓度及600 nm光密度(optical density,OD)变化,所有试验重复3次。
1.5 分析方法
检测氨氮采用纳氏试剂紫外分光光度法[17]。
2 结果与分析
2.1 菌落形态
从垃圾渗滤液筛选出的降氨氮菌株可以在以NH4+-N为唯一氮源的选择培养基上生长,且降氨氮效果明显。在 30℃固体YPD培养基中菌落呈灰白色圆形,直径约为 2 mm,表面粗糙、湿润,中央不隆起,边缘不整齐(图1)。
2.2 菌种鉴定
GC菌ITS序列经琼脂糖凝胶电泳检测,GC菌基因组大小为20 kb左右(图2a)。ITS序列大小在350 bp左右(图2b)。
2.3 GC菌同源性分析及系统发育树
GC菌ITS序列长度为346 bp,扩增序列在NCBI(https://www.ncbi.nlm.nih.gov/)进行BLAST比对分析,该菌与Galactomyces candidum strain WM 04.493 KP132255.1 相似性为99%, 与Galactomyces candidum LC317625.1相似性为98%。用MEGA 6.0构建系统发育树[18],显示该菌与Galactomyces candidum LC317625.1最为相近(图3)。GC菌与Galactomyces candidum strain WM 04.493 KP132255.1在第4、42、43、319、338、339、340位碱基处有差异。与Galactomyces candidum LC317625.1在第65、91、92、319、338、339、340碱基处出现差异(图4)。
2.4 培养基单因素优化
2.4.1 生长曲线测定
为了了解GC菌生长浊度的变化,测定GC菌OD600 nm值。从图5可以看出,GC菌0~2 h为生长延迟期,2 h后开始进入对数期,符合硝化菌世代周期短、生长速率快的特点[19-20],24 h左右到达稳定期,细胞数量维持稳定。由于使用紫外分光光度计测量菌体浊度,死亡的细胞也被计入,因此,在稳定期后没有出现衰亡期。
2.4.2 最适pH
24 h后GC菌在不同pH条件下生长(图6)及降氨氮(图7)的变化表明:GC菌适合于偏碱性环境,最佳pH生长条件为9.0左右;但其氨氮去除效率在pH为9.0时并不是最好的,可能是因为过碱条件GC菌降氨氮酶体系受到一定的抑制。
2.4.3 最适温度
图8展现了在其他条件不变,温度改变时,24 h后GC菌细胞的生长数量。从该图中可以看出,该菌在温度10~42℃都能够生长。在10℃时,菌株细胞数量增长缓慢;温度高于10℃时,菌株细胞生长数量明显增加;在30℃时达到最佳数量,超过30℃后菌体生长效率下降。从图9可以看出,在30℃时氨氮去除率最高,为76.3%,而42℃时,去除率只有7.0%。由此可知,不同温度条件下,氨氮去除率与菌株数量大致呈正相关。
2.4.4 最适C/N
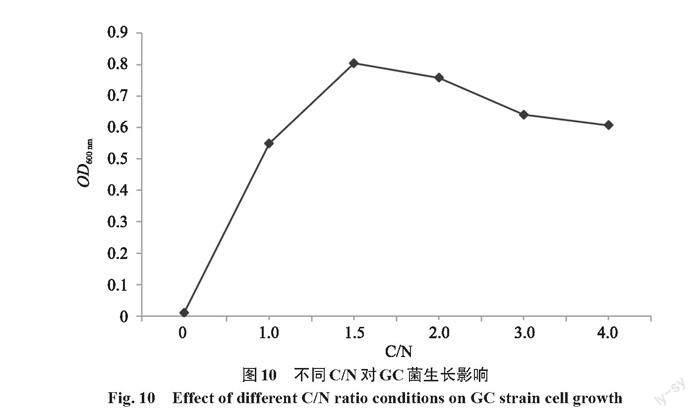
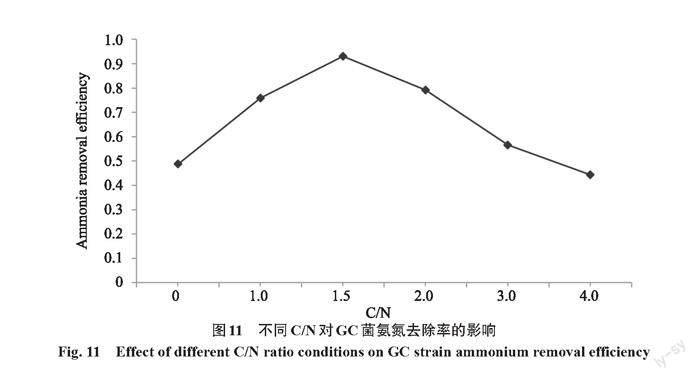
以原培养基作对照,在氨氮浓度不变,改变葡萄糖含量,即C/N低的条件下,GC菌24 h后细胞生长浊度如图10所示,不加碳源,菌株基本不生长。值得注意的是,此时氨氮去除率达到48.7%(图11),这可能是因为加入的菌体在培养基中产生了氨氧化酶,同时说明了GC菌是异养氨氧化类型菌株。在C/N为1~4时,菌株均能生长。其中,在C/N为1.5时菌株细胞数量最多,且氨氮去除率为93.1%。随着碳源的增加,GC菌去除氨氮的效率逐渐降低(图11)。
3 讨论
Galactomyces是Geotrichum其中的一种类型,两者DNA具有同源性。自2004年以来,分类修订的结论是旧的Galactomyces geotrichum/G. candidum complex包含4个独立的种,其中Galactomyces candidus sp.、Galactomyces candidus sp. nov./G. candiduni、Galactomyces candidum與Geotrichum candidum功能相似。张晓知等[21]、于振林等[22]也将Galactomyces candidum应用于发酵工业,本文参考了其相关报道。
工业用水会产生高氨氮低C/N比废水,传统生物脱氮技术常由于废水中碳源不足而导致脱氮效果不佳,需额外投加碳源[23],这一问题不仅加大了费用支出,而且有CO2产生,污染环境。针对这种情况,通过改进现有工艺来利用废水中的现有碳源,但是各种环境因素会影响脱氮处理效果[24]。除了同步硝化反硝化、厌氧氨氧化等工艺 [25-28] ,新理论、新工艺的提出减少了生物脱氮对碳源的需求。但目前氨氮废水处理技术中,利用菌株直接降氨氮法最为经济有效。本文筛选到的GC菌(在20~37℃中性偏碱环境中生长速率快)培养基C/N比为1.5时,24 h后氨氮去除率为93.1%。其培养过程简单,无需增加过多碳源,为污水氨氮处理提供了理论依据。
白地霉在废水处理中有良好的脱色去污的效果[29-30],也能一定程度上净化马铃薯、豆腐、玉米淀粉等食品工业废水[31-33]。但白地霉在废水氨氮去除方面尚无报道,而本文筛选到的GC菌在24 h内去除氨氮有显著效果。白地霉在食品工艺中应用广泛,利用废水发酵白地霉也有相关报道。本文筛选到的GC菌在高氨氮低碳源条件下能快速降解氨氮,如应用于污水处理中,可减少设备投入,降低处理成本,同时在短时间内完成氨氮去除。该文发现了白地霉在污水处理中具有显著氨氮去除的功能,这是白地霉在污水处理中的一个新的功能。我们的研究表明了,白地霉在低C/N废水生化处理工艺中具有广泛的应用前景。
本文主要聚焦白地霉对培养基氨氮去除率的试验,该GC菌株在污水处理中,对其他污染因子(比如:COD、总氮、总磷)的处理是否有效或者其有效的处理条件,将是我们今后研究的任务。本文的试验基于实验室条件,研究发现该株GC菌即使在低碳氮比条件下也具有较强的降氨氮作用,但是在实际污水处理工程中的效果及安全性有待进一步工艺应用验证。氨氮去除包含硝化与反硝化2个过程,该菌株的氨氮去除机理,氨氮是在硝化过程还是在反硝化过程中被转化有待下一步的研究。
参考文献
[1] YOU J, DAS A, DOLAN E M, et al. Ammonia-oxidizing archaea involved in nitrogen removal[J]. Water Research, 2009, 43(7): 1801-1809.
[2] LIANG Y, ZENG H, YANG Z, et al. Microbial characteristics and nitrogen removal of simultaneous partial nitrification, anammox and denitrification (SNAD) process treating low C/N ratio sewage[J]. Bioresource Technology, 2014, 169(5): 103-109.
[3] 贾小宁. 固定化微生物组合床型对低碳氮比污水的脱氮性能研究[D]. 兰州: 兰州大学, 2014.
JIA Xiaoning. Study on low carbon-to-nitrogen sewage denitrification by combination bed based on immobilized microorganism[D]. Lanzhou: Lanzhou University, 2014.
[4] 赵宗升, 刘鸿亮, 李炳伟, 等. 高浓度氨氮废水的高效生物脱氮途径[J]. 中国给水排水, 2001, 17(5): 24-28.
ZHAO Zongsheng, LIU Hongliang, LI Bingwei, et al. High-efficiency biological denitrification of ammonia nitrogen wastewater[J]. China Water & Waste Water, 2001, 17(5): 24-28.
[5] LI G, SUN M H, LIU X Z, et al. Effects of carbon concentration and carbon to nitrogen ratio on the growth and sporulation of several biocontrol fungi[J]. Mycological Research, 2007, 111(1): 87-92.
[6] 邓玮玮, 王晓昌. 低碳氮比废水脱氮研究进展[J]. 工业水处理, 2015, 35(2): 15-19.
DENG Weiwei, WANG Xiaochang. Research progress in the denitrification of sewage at low C/N ratio[J]. Industrial Water Treatment, 2015, 35(2): 15-19.
[7] LI Y T, WANG Y R, FU L, et al. Aerobic-heterotrophic nitrogen removal through nitrate reduction and ammonium assimilation by marine bacterium Vibrio sp. Y1-5[J]. Bioresource Technology, 2017, 230(1): 103-111.
[8] YANG M, LU D W, QIN B D, et al. Highly efficient nitrogen removal of a coldness-resistant and low nutrient needed bacterium, Janthinobacterium sp M-11[J]. Bioresource Technology Biomass Bioenergy Biowastes Conversion Technologies Biotransformations Production Technologies, 2018, 256: 366-373.
[9] NOELIA S A, LETICIA G A, JOS? M A, et al. Technological characterization of Geotrichum candidum strains isolated from a traditional Spanish goatsmilk cheese[J]. Food Microbiology, 2012, 30(1): 260-266.
[10] 孫丙升. 产香白地霉发酵无醇类啤饮料的研究[D]. 山东: 山东轻工业学院, 2009.
SUN Bingsheng. Study on fermentation of non-alcoholic beverage beverage similar to beer with aroma-producing strains of Geotrichum candidum[D]. Shandong: Shandong Institute of Light Industry, 2009.
[11] CAVALITTO S F, MIGNONE C F. Application of factorial and Doehlert designs for optimization of protopectinase production by a Geotrichum klebahnii strain[J]. Process Biochemistry, 2007, 42(2): 175-179.
[12] KHORAMNIA A, EBRAHIMPOUR A, GHANBARI R, et al. Improvement of medium chain fatty acid content and antimicrobial activity of coconut oil via solid-state fermentation using a malaysian Geotrichum candidum[J]. BioMed Research International, 2013(1): 954542.
[13] 贺小荣, 呼世斌, 郑志伟. 白地霉处理玉米酒精醪液积累菌体蛋白的研究[J]. 环境污染与防治, 2007, 29(10): 721-724, 730.
HE Xiaorong, HU Shibin, ZHENG Zhiwei. Geotrichum candidum for treatment of corn alcohol wastewater and production of single cell protein[J]. Environmental Pollution & Prevention, 2007, 29(10): 721-724, 730.
[14] 谌斌, 刘明登. 浓缩糖蜜酒精废水发酵生产白地霉[J]. 生物技术, 2002, 12(3): 38-39.
CHEN Bin, LIU Mingdeng. Concentrated molasses alcohol wastewater fermentation production of Geotrichum[J]. Biotechnology, 2002(3): 38-39.
[15] 熊征, 刘友勋, 颜克亮, 等. 高浓度肌苷废水中白地霉发酵生产研究[J]. 食品科技, 2008, 33(3): 41-44.
XIONG Zheng, LIU Youxun, YAN Keliang, et al. Study on fermentation of Geotrichum candidum in high-concentration inosine wastewater[J]. Food Science and Technology, 2008, 33(3): 41-44.
[16] DAUM M, ZIMMER W, PAPEN H, et al. Physiological and molecular biological characterization of ammonia oxidation of the heterotrophic nitrifier Pseudomonas putida[J]. Current Microbiology, 1998, 37(4): 281-288.
[17] 中華人民共和国生态环境部. 水质 氨氮的测定 纳氏试剂分光光度法: HJ 535-2009[S]. 北京: 中国环境出版集团, 2009.
Ministry of Ecology and Environment of the Peoples Republic of China. Water quality. Determination of ammonia nitrogen. Nesslers reagent spectrophotometry[S]. Beijing: China Environmental Science Press, 2009.
[18] KONDO K, YOSHIMATSU K, FUJIWARA T. Expression, and molecular and enzymatic characterization of cu-containing nitrite reductase from a marine ammonia-oxidizing Gammaproteobacterium, Nitrosococcus oceani[J]. Microbes & Environments, 2012, 27(4): 407-412.
[19] SMITH M T, POOT G A, AWAMD C. Re-examination of some species of the genus Geotrichum Link: Fr[J]. Antonie Van Leeuwenhoek, 2000, 77(1): 71-78.
[20] AHRAZEM O, PRIETO A, LEAL J A, et al. Fungal cell-wall galactomannans isolated from Geotrichum spp. and their teleomorphs, Dipodascus and Galactomyces[J]. Carbohydrate Research, 2002, 337(21/23): 2347-2351.
[21] 张知晓, 师建全, 李勇, 等. 一株产香酵母的鉴定及其发酵烟叶碎片的挥发性成分分析[J]. 云南大学学报 (自然科学版), 2013, 35(S2): 414-419.
ZHANG Zhixiao, SHI Jianquan, LI Yong, et al. Identification of a strain of vanillis cerevisiae and analysis of volatile components of fermented tobacco leaf fragments[J]. Journal of Yunnan University (Natural Science Edition), 2013, 35(S2): 414-419.
[22] 于振林, 贾会勇, 王颉, 等. 响应面法优化白地霉 (Galactomyces candidum)发酵产果胶酶[J]. 酿酒科技, 2017(4): 26-32, 35.
YU Zhenlin, JIA Huiyong, WANG Jie, et al. Optimization of Galactomyces candidum fermentation pectinase by response surface method[J]. Wine Science and Technology, 2017(4): 26-32, 35.
[23] 朱亮, 黄勇, 李祥, 等. 高氨氮低C/N比废水新型生物处理技术研究进展[C]//中国环境科学学会学术年会, 2015.
ZHU Liang, HUANG Yong, LI Xiang, et al. Research progress on new biological treatment technology for high ammonia nitrogen and low C/N ratio wastewater[C]//Annual Meeting of Chinese Society of Environmental Sciences, 2015.
[24] 张少辉, 康淑琴. 低C/N值下短程硝化反应器的启动及影响因素[J]. 中国给水排水, 2010, 26(11): 96-99.
ZHANG Shaohui, KANG Shuqin. Start-up and influence factors of short cut nitrification reactor at low C/N ratio[J]. Chinawater&Wastewater, 26(11): 96-99.
[25] 申彦冰. 基于低C/N比条件下的污水深度脱氮技术研究[D]. 北京: 北京交通大学, 2013.
SHEN Yanbing. Study on the sewage advanced denitrification treatment with the low carbon-to-nitrogen ratio[D]. Beijing: Beijing Jiaotong University, 2013.
[26] 朱婷婷. 微生物电解池对低C/N废水的强化处理研究[D]. 大连: 大连理工大学, 2016.
ZHU Tingting. Enhancement of low C/N wastewater treatment in a microbial electrolysis cell[D]. Dalian: Dalian University of Technology, 2016.
[27] PENG P, HUANG H, REN H. Effect of adding low-concentration of rhamnolipid on reactor performances and microbial community evolution in MBBRs for low C/N ratio and antibiotic wastewater treatment[J]. Bioresource Technology, 2018, 256(1): 557-561.
[28] 周琳, 梁溢, 赵长菘, 等. 细菌协同植物治理重金属污染作用机制的研究进展[J]. 激光生物学报, 2022, 31(3): 202-207.
ZHOU Lin, LIANG Yi, ZHAO Changsong, et al. Research progress on the mechanism of bacterial synergy in plant treatment of heavy metal pollution[J]. Chinese Journal of Laser Biology, 2022, 31(3): 202-207.
[29] AOUIDI F, KHELIFI E, ASSES N, et al. Use of cheese whey to enhance Geotrichum candidum biomass production in olive mill wastewater[J]. Journal of Industrial Microbiology & Biotechnology, 2010, 37(8): 877-882.
[30] 尹亮. 混合菌群共培养对偶氮染料的协同脱色及降解的研究[D]. 广州: 华南理工大学, 2009.
YIN Liang. Study of synergetic degradation and decolorization of azo dye by mixed consortium[D]. Guangzhou: South China University of Technology, 2009.
[31] 任燕, 梅勻, 曾艳, 等. 臭氧处理马铃薯淀粉加工废水的白地霉净化[J]. 食品研究与开发, 2010, 31(7): 35-38.
REN Yan, MEI Yun, ZENG Yan, et al. Purification of albicans in ozone-treated potato starch processing wastewater[J]. Food Research and Development, 2010, 31(7): 35-38.
[32] 曲静然, 刘玉, 宋俊梅. 豆腐废水发酵生产白地霉的研究[J]. 食品研究与开发, 2005(3): 99-102.
QU Jingran, LIU Yu, SONG Junmei. Study on fermentation of Geotrichum candidum with wastewater[J]. Food Research and Development, 2005(3): 99-102.
[33] 李玉, 李其久, 尹依婷, 等. 白地霉净化和资源化玉米淀粉工业废水的试验条件研究[J]. 辽宁大学学报 (自然科学版), 2008(1): 81-84.
LI Yu, LI Qijiu, YIN Yiting, et al. Experimental conditions of industrial wastewater purification and resource utilization of maize starch by Geotrichum candidum [J]. Journal of Liaoning University (Natural Science Edition), 2008(1): 81-84.
收稿日期:2022-10-31;修回日期:2023-01-06。
基金项目:湖南省自然科学基金-科教联合项目(2019JJ70017);湖南省自然科学基金立项课题项目(2021JJ60090);湖南省哲学社会科学规划基金项目(21ZWC06)。
作者简介:#为并列第一作者。刘辉,教授,主要从事环境微生物的研究;李晓超,教授,主要从事淡水鱼类发育生物学的研究;毛晓茜,工程师,主要从事污染防治、环境标准评估等方面的研究。
* 通信作者:杨利平,教授,主要从事环境微生物的研究。E-mail: 53537035@qq.com。
