迷迭香酸对宫颈癌PI3K/A/mTOR信号通路靶分子作用的研究
2024-01-26覃秋莲滕淑静胡爽刘阳春王志文
覃秋莲 滕淑静 胡爽 刘阳春 王志文

摘 要:迷迭香酸作为一种天然酚酸类化合物目前已被广泛应用于多种癌症的治疗。为探讨迷迭香酸对人宫颈癌的治疗效果,本研究通过细胞增殖、迁移和自噬等试验进行功能验证,并应用蛋白质免疫印迹技术验证了其可能发挥作用的信号通路。研究结果发现:经迷迭香酸处理后,人宫颈癌Hela细胞的增殖能力显著性下降;细胞的迁移能力同样受到抑制,自噬相关蛋白(ATGs)ATG5和Beclin1(酵母ATG6同源物)表达上调,磷脂酰肌醇-3-激酶(PI3K)、丝氨酸苏氨酸蛋白激酶(AKT)和雷帕霉素靶蛋白(mTOR)表达下降。这提示,迷迭香酸可能通过抑制PI3K/AKT/mTOR信号通路来促进细胞的自噬,并抑制宫颈癌细胞的增殖、迁移。该研究结果进一步说明了迷迭香酸作为抗癌药物的潜在价值,为抗癌药物的研发提供了一个新的理论。
关键词:迷迭香酸;宫颈癌;细胞自噬;细胞增殖
中图分类号:Q279;R737.33 文献标志码:A DOI:10.3969/j.issn.1007-7146.2023.01.009
Effects of Rosmarinic Acid on Target Molecules of PI3K/Akt/mTOR Signaling Pathway in Cervical Cancer
QIN Qiulian1, TENG Shujing1, HU Shuang2, LIU Yangchun2, WANG Zhiwen1,3*
(1. Key Laboratory of Chronic Noncommunicable Diseases, Yueyang Vocational Technical College, Yueyang 414006, China;
2. Nursing Department of Yueyang peoples Hospital, Yueyang 414000, China; 3. College of Life and Health Sciences, Wuhan University of Science and Technology, Wuhan 430081, China)
Abstract: Rosmarinic acid, as a natural acid-secreting compound, has been widely used in the treatment of various cancers. In order to explore the therapeutic effects of rosmarinic acid on human cervical cancer. The experiments of cell proliferation, migration and autophagy were carried out in this study for functional verification, and Western blotting was used to verify the possible signaling pathways. The results showed that the proliferation ability of human cervical cancer significantly decreased after rosmarinic acid treatment; the cell migration ability was also inhibited, the expressions of autophagy-related proteins ATG5 and Beclin1 were up-regulated, and the expressions of PI3K, AKT and mTOR proteins decreased. This suggests that rosmarinic acid may promote cell autophagy and inhibit the proliferation and migration of cervical cancer cells by inhibiting the PI3K/AKT/mTOR signaling pathway, thereby achieving the effects of inhibiting or treating human cervical cancer. This further indicates the potential value of rosmarinic acid as an anticancer drug. It provides a new theory for the research and development of anticancer drugs.
Key words: rosmarinic acid; cervical cancer; autophagy; cell proliferation
(Acta Laser Biology Sinica, 2023, 32(1): 062-068)
宫颈癌是女性主要的恶性肿瘤之一,其致死率在妇科恶性肿瘤中仅次于乳腺癌[1]。2020年,全球新增宫颈癌病例约60万例,死亡34万例[2]。目前,晚期转移性宫颈癌的首选治疗策略主要包括手術、放疗和化疗。尽管现代医疗技术在宫颈癌诊断和治疗中不断发展与提高,但在过去的5年中,确诊为宫颈癌患者的总生存率并无实质性提高,因此,对宫颈癌有效的诊断、治疗和预防药物的开发成为一种迫切的需求[3-4]。目前,一些常规治疗容易出现耐药性,导致癌症复发和转移。近年来,一些植物来源的天然产物被评估为潜在的抗癌药物,可以优先杀死肿瘤细胞而不会产生严重的不良反应[5]。目前,约有60%的抗癌药物是来自于植物或动物的天然产物[6]。近年来,从天然产物中提取有效成分来预防癌症和治疗癌症已经成为癌症研究的重点之一。已有研究表明,天然短叶红豆杉树皮中提取分离得到的紫杉醇具有独特的治疗癌症的作用机制,对于多种癌症具有治疗效果,且对乳腺癌和卵巢癌治疗效果明显,被公认为是目前世界上有效治疗癌症的药物之一[7]。另外,姜黄素也是一种从天然植物中提取的多酚类天然产物。大量研究表明,姜黄素可以调控多种癌症中的分子靶点,对于基质金属蛋白酶(matrix metalloproteinases,MMPs)、AKT、肿瘤坏死因子(tumor necrosis factor,TNF)等信号蛋白具有显著性的抑制作用,可作为一种选择性药物治疗癌症[8]。秋水仙碱是一种从百合科秋水仙中提取的卓酚酮类生物碱,其结构中的C环与微管蛋白结合,阻止其聚合成纺锤丝,使细胞分裂停止于中期。目前,研究发现秋水仙碱对于食管癌、胃癌、肺癌等具有明显的抑制作用[9]。综上所述,大量的研究表明,天然产物具有多途径、毒副作用小、多效应等优势,从天然产物中寻找抗癌药物也成为一种可靠的方式,为未来寻找化疗药物,维护人类健康提供另外的保障。
迷迭香酸(rosmarinic acid,C18H16O8)是一种水溶性的具有多个多酚羟基的化合物,在唇形科、紫草科和伞形科等多种植物中广泛分布[10-11]。研究发现迷迭香酸具有抗菌、抗氧化、抗炎及神经保护作用[12],并且具有抗肿瘤作用,可有效地抑制直肠癌细胞的转移、侵袭[13]和胰腺癌细胞增殖、侵袭和迁移[14],还能够抑制炎症与血管生成[15],能通过促分裂素原活化蛋白激酶 (mitogen-activated protein kinases,MAPK)信号通路对胶质细胞凋亡进行调控[16],因此,对迷迭香酸的研究具有重要意义。然而,目前关于迷迭香酸对宫颈癌细胞的影响,仍然没有详细的研究报道。本试验选用迷迭香酸作为研究对象,通过探讨迷迭香酸对人宫颈癌Hela细胞系增殖以及迁移能力的影响,来进一步探讨其影响人宫颈癌细胞的具体机制,以期为宫颈癌的临床治疗提供参考。
1 材料与方法
1.1 材料
迷迭香酸(上海源叶生物科技有限公司,中国);RPMI-1640基础培养基(Gibco公司,美国);Transwell小室(BD公司,美国);人宫颈癌细胞Hela细胞系(科学院上海生命科学研究院细胞资源中心,中国);胎牛血清、青霉素-链霉素、0.25%胰酶(Gibco公司,美国);奥林巴斯激光共聚焦(奥林巴斯公司,日本);磷酸缓冲盐溶液(phosphate buffer saline,PBS)(Hyclone 公司,美国);增强型化学发光液(enhanced chemiluminescence,ECL)、发光液、细胞增殖及毒性检测试剂盒(CCK-8)、抗anti-ACTB、E-cadherin、PI3K、AKT、ATG5等抗体(ABclonal公司,中国);辣根过氧化物酶标记兔/鼠二抗(爱博泰克公司,中国);BCA(bicinchoninic acid assay)蛋白质浓度测定试剂盒、RIPA(radio immunoprecipitation assay)裂解液(强)、脱脂奶粉(碧云天生物技术有限公司,中国);自噬流标记试剂盒(艾美捷生物科技有限公司,中国)。
1.2 细胞培养与细胞处理
将细胞冻存管从液氮罐中取出,37℃水浴解冻,随后将冻存管中的细胞冻存液混合物取出放进装有5 mL完全培养基的15 mL离心管中。4℃ 300 g离心5 min,去上清,用1 mL完全培养基重悬细胞。将细胞悬液转移到10 cm细胞培养皿中,其中液体成分为含10%胎牛血清、1%青霉素-链霉素的RPMI-1640培养基。最后,将细胞培养皿转移到37℃、5% CO2培养箱中进行培养。细胞每2~3 d传代1次,当细胞汇合度达到70%~80%时进行传代处理。首先,去除培养皿中的上清,PBS清洗1次,加入1 mL 0.25%胰酶37℃消化3 min,加入完全培养基终止消化反应。吹打培养基,将细胞悬液制备成单细胞悬液,并进行细胞计数。随后,4℃ 300 g离心5 min,加入培养基制备成每毫升含有5×106个细胞的单细胞悬液,按2 mL每孔的用量接种到到6孔板中。将细胞置于37℃、5% CO2培养箱中过夜,随后加入二甲亚砜溶解的迷迭香酸,孵育培养48 h后进行其他试验。
1.3 CCK-8细胞活性试验检测
经过上述处理后,将细胞以每孔1×105个细胞的用量接种到96孔板中,每个试验组设置5个独立的重复孔。分别在接种后的0、24、48和72 h,按说明书加入所需体积的CCK-8试剂,37℃孵育1 h后在多功能酶标仪中观察试验孔中450 nm处的吸收值,记錄并绘制成曲线。
1.4 克隆形成试验
取对数生长期的细胞消化后,以每孔1 000个细胞的用量接种到6孔板中,每个试验组设立3个独立的重复孔。随后将其置于37℃、5% CO2培养箱中过夜,并向试验组中加入二甲亚砜溶解的迷迭香酸(20 ?mol/L)。培养15 d后,去除培养基,PBS清洗3次,加入4%多聚甲醛固定液室温固定20 min,PBS清洗3次,加入0.1%结晶紫染色液,室温染色15 min,PBS清洗3次,晾干后计数克隆数并将其绘制成柱状图。
1.5 Trnaswell迁移试验
经过上述处理48 h后的细胞,在对数生长期时用胰酶进行消化,将细胞装在15 mL离心管中,4℃ 300 g离心5 min收集细胞,无血清基础培养基清洗细胞2次。将上述细胞数量调整为每毫升含有5×105个细胞的细胞悬液,备用。向24孔板中添加含有20%胎牛血清的完全培养基800 ?L,向Transwell小室中添加200 ?L细胞悬液并于37℃、5% CO2培养箱中培养18 h。随后取出Transwell小室,PBS清洗2次,4%多聚甲醛固定,结晶紫染色,PBS清洗2次。最后,在显微镜下观察细胞迁移结果,在10倍镜下随机选取5个视野,拍照并计数。
1.6 细胞免疫荧光
将1×105个细胞接种于装有细胞爬片的24孔板中,每个试验设置有独立的3个重复孔。接种细胞,并将其置于37℃、5% CO2培养箱中过夜,加入二甲亚砜溶解的迷迭香酸培养48 h。去除培养基,PBS清洗3次,4%多聚甲醛固定细胞,0.5% Triton X-100通透细胞膜;用5% BSA室温封闭1 h,加入5% BSA配置的Anti-E-cadherin抗体,置于湿盒中4℃孵育过夜,PBS洗3次;根据说明书加入体积比为1∶200比例稀释的Cy3标记抗兔二抗,置于湿盒中室温孵育1 h,PBS洗3次;用4′,6 -二脒基-2-苯基吲哚二盐酸盐[2-(4-Amidinophenyl)-6-indolecarbamidine dihydrochloride,DAPI ]室温对细胞核进行染色,PBS洗3次。
1.7 细胞自噬流标记
首先,按说明书配置好清洗缓冲液和染色工作液,其他步骤简略如下:去除含有迷迭香酸的培养基,用清洗缓冲液清洗3次;在每孔中加入染色缓冲液100 ?L,室温避光孵育30 min,清洗缓冲液清洗3次;4%多聚甲醛室温固定20 min,PBS清洗3次;DAPI染色,避光15 min,PBS清洗3次;激光共聚焦显微镜100倍镜下观察并拍照。
1.8 Western blot免疫印迹分析
应用一步法蛋白电泳凝胶试剂盒配制10%凝胶,每孔加入20 ?g蛋白样品,150 V恒压电泳1.5 h;200 mA转膜,根据目的蛋白千道尔顿(kilodalton,kD)数,以每kD/min的标准调整转膜时间;转膜完成后将聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜浸泡在5%含有0.05%吐温的三乙醇胺缓冲盐溶液的脱脂牛奶 TBST中室温1 h;将PVDF膜孵育在相应抗体工作液中,4℃孵育过夜;将膜取出室温在TBST中清洗3次,每次10 min;加入二抗,室温孵育1 h。TBST清洗3次,每次10 min;ECL化学发光液显色PVDF膜,化学成像系统拍照。
1.9 统计学分析
试验数据采用Graphpad Prism 9软件进行分析,用配对t检验分析两组数据之间的统计学差异,P<0.05时认为两组数据之间具有统计学差异(*P<0.05;**P<0.01)。
2 结果与分析
2.1 迷迭香酸对Hela细胞增殖能力的影响
首先,我们观测迷迭香酸处理人宫颈癌细胞后对其细胞活性的改变。向96孔板中接种细胞后,再向孔中加入迷迭香酸使其终浓度为20 μmol/L,在特定时间点采集每孔中450 nm处吸收峰数值。经分析后发现,人宫颈癌Hela细胞在经迷迭香酸处理后24 h,细胞活力无明显变化,处理48 h后细胞活力显著性下降(图1a)。随后,我们应用克隆形成试验,去检验迷迭香酸对人宫頸癌Hela细胞体外增殖能力的影响。试验结果分析显示(图1b),迷迭香酸同样能显著性降低人宫颈癌Hela细胞的体外增殖能力。
2.2 迷迭香酸对Hela细胞迁移能力的影响
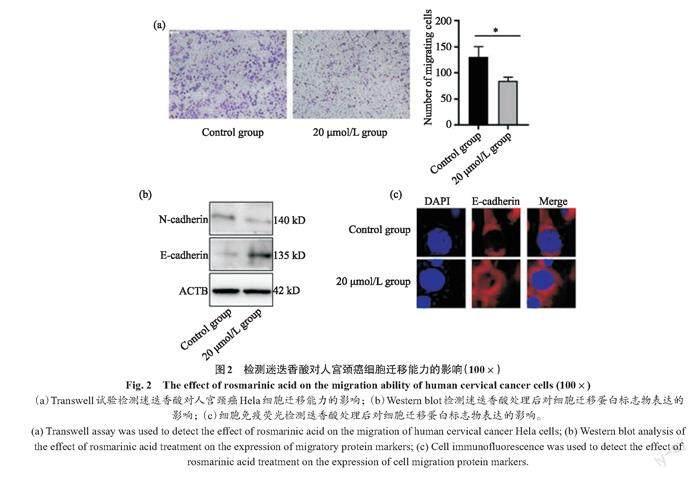
利用试验观测迷迭香酸对人宫颈癌Hela细胞迁移能力以及细胞迁移蛋白标志物表达的影响。Transwell细胞迁移试验结果显示(图2a),经迷迭香酸处理后的人宫颈癌Hela细胞的迁移能力下降明显。提取迷迭香酸处理48 h后的宫颈癌细胞蛋白,后经Western blot和细胞免疫荧光分析显示(图2b、2c),迁移蛋白标志物N-cadherin和E-cadherin经处理后有显著性的表达变化,并与Transwell的结果相符。
2.3 迷迭香酸对Hela细胞自噬的影响及其发挥作用信号通路的研究
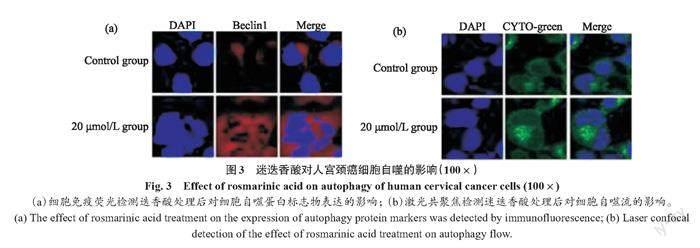
为探究迷迭香酸通过何种方式发挥抑制细胞增殖和迁移的作用,我们依据文献对迷迭香酸处理后的细胞进行自噬流标记以及自噬相关蛋白免疫荧光标记和Western blot分析。分析结果显示,迷迭香酸处理后的细胞自噬明显上升,自噬相关蛋白同样表达上调(图3、图4a)。
最后,为探究迷迭香酸通过何种细胞信号通路调控自噬的变化,我们应用Western blot检测了PI3K/AKT/mTOR信号通路相关蛋白的表达。如图4b和4c所示,经过迷迭香酸处理后的细胞中PI3K、AKT和mTOR蛋白的表达明显下调,且p-PI3K、p-AKT和p-mTOR的含量也均显著性下降。上述结果显示,当迷迭香酸处理宫颈癌Hela细胞时,宫颈癌细胞中自噬关键调控蛋白Beclin1表达上升,但PI3K/AKT/mTOR信号通路的相关蛋白及相关蛋白的磷酸化含量均显著性下降。这些结果表明,迷迭香酸是通过影响PI3K/AKT/mTOR信号通路进而影响人宫颈癌Hela细胞的自噬,从而导致细胞迁移和增殖能力的改变。
3 讨论
宫颈癌是全球第四大常见女性癌症,且在低收入和中等收入国家中发病人数占主导地位[17]。我国是宫颈癌发病率较高的国家,并且每年的发病率及致死率仍在上升[18]。如何预防与治疗宫颈癌是全球研究人员共同关注的课题,因此,寻找新的抗癌药物是所有医疗人员面临的巨大挑战。由于迷迭香酸具有抗氧化、抗炎、抑制增殖和促进凋亡等特殊药理活性,其在癌症的预防与治疗中得到了广泛的应用[19]。
目前研究表明,迷迭香酸对多种癌症具有显著的抑制作用[20]。在本试验中,我们先通过CCK-8试验和克隆形成试验检测迷迭香酸对人宫颈癌Hela细胞增殖的影响,结果表明,迷迭香酸能显著性降低人宫颈癌Hela细胞体外增殖能力。另外,Transwell细胞迁移试验表明,经迷迭香酸处理后的人宫颈癌Hela细胞的迁移能力下降明显,并且其中迁移蛋白标志物N-cadherin经处理后有显著性降低,E-cadherin显著性升高。自噬是一种广泛存在于真核生物体内的生物学现象,是一种高度保守的分解代谢过程,也是长寿命蛋白质和细胞质细胞器降解的主要细胞途径[21]。自噬是一种不可或缺的生物学功能,有助于维持正常的组织稳态和代谢适应性,当自噬调节异常时,也会对正常的细胞功能造成严重后果[22]。PI3K/AKT/mTOR通路是肿瘤发生发展中的一条常见的自噬通路,在癌症发生发展中起着重要的作用[23-25]。已有研究证明,迷迭香酸可以通过PI3K/AKT/mTOR信号通路影响结肠癌细胞自噬的发生,并且可以通过细胞自噬影响鼻咽癌细胞的凋亡[26],然而,关于迷迭香酸通过何种作用机制影响结肠癌的发生发展尚未可知。为了进一步探究迷迭香酸调控人宫颈癌Hela细胞增殖和迁移的具体作用机制,我们检测了自噬相关蛋白和PI3K/AKT/mTOR信号通路相关蛋白的表达,发现经过迷迭香酸处理后的细胞中的自噬相关蛋白的表达上调,PI3K、AKT及mTOR信号通路相关蛋白表达下调。综上所述,我们发现迷迭香酸能够通过调控PI3K/AKT/mTOR信号通路来调控自噬的发生,从而对人宫颈癌Hela细胞增殖和迁移产生影响。
随着对迷迭香酸功能研究的不断深入,越来越多的研究表明,迷迭香酸可能通过不同的途径或者信号通路来影响癌症的发生发展[16]。本研究初步证实了迷迭香酸对宫颈癌的抑制作用及可能的作用机制,揭示了迷迭香酸作为抗癌药物的潜在价值,为迷迭香酸的临床药物开发应用奠定了重要的基础。
参考文献(References):
[1] SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2022[J]. CA: A Cancer Journal for Clinicians, 2022, 72(1): 7-33.
[2] SUNG H, FERLAY J, SIEGEL R L, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2021, 71(3): 209-249.
[3] 段正秀. 宮颈癌组织中micro RNA-124表达量和癌细胞生长及侵袭的相关性分析[J]. 中国全科医学, 2020, 23(S1): 165-167 .
DUAN Zhengxiu. Correlation analysis of micro RNA-124 expression level and cancer cell growth and invasion in cervical cancer tissues[J]. Chinese General Practice, 2020, 23(S1): 165-167.
[4] MAYADEV J S, KE G, MAHANTSHETTY U, et al. Global challenges of radiotherapy for the treatment of locally advanced cervical cancer [J]. International Journal of Gynecological Cancer, 2022, 32(3): 436-445.
[5] 张嘉曦, 王芸芸, 张萌, 等. 化学治疗在宫颈癌治疗中的应用现状[J]. 中国计划生育和妇产科, 2022, 14(6): 46-48.
ZHANG Jiaxi, WANG Yunyun, ZHANG Meng, et al. Current status of chemotherapy in the treatment of cervical cancer [J]. China Family Planning and Obstetrics & Gynecology, 2022, 14(6): 46-48.
[6] OUYANG L, LUO Y, TIAN M, et al. Plant natural products: from traditional compounds to new emerging drugs in cancer therapy [J]. Cell Prolif, 2014, 47(6): 506-515.
[7] 李雨澎, 林睿, 母润红. 紫杉醇及其联合用药抗肿瘤的研究进展[J]. 吉林医药学院学报, 2021, 42(6): 440-442.
LI Yupeng, LIN Rui, MU Runhong. Research progress of paclitaxel and its combination against tumor [J]. Journal of Jilin Medical University, 2021, 42(6): 440-442.
[8] 王彬辉, 高晓宇, 章文红, 等. 姜黄素抗肿瘤作用新剂型及其衍生物研究新进展[J]. 中国中医药科技, 2015, 22(2): 232-235.
WANG Binhui, GAO Xiaoyu, ZHANG Wenhong, et al. Research progress on new formulations and derivatives of curcumin for anti-tumor effect[J]. China Science and Technology of Traditional Chinese Medicine, 2015, 22(2): 232-235.
[9] CIFUENTES M, SCHILLING B, RAVINDRA R, et al. Synthesis and biological evaluation of B-ring modified colchicine and isocolchicine analogs[J]. Bioorganic & Medicinal Chemistry Letters, 2006, 16(10): 2761-2765.
[10] 赵玉霞, 陈莺倩. 迷迭香酸通过AMPK/mTOR通路减轻新生大鼠缺血缺氧性脑损伤研究 [J]. 中草药, 2021, 52(22): 6897-6903.
ZHAO Yuxia, CHEN Yingqian. Rosmarinic acid attenuates ischemic hypoxic brain injury in neonatal rats through AMPK/mTOR pathway[J]. Chinese Herbal Medicine, 2021, 52(22): 6897-6903.
[11] GUAN H, LUO W, BAO B, et al. A comprehensive review of rosmarinic acid: from phytochemistry to pharmacology and its new insight [J]. Molecules, 2022, 27(10): 03292-03320.
[12] TAKANO H, OSAKABE N, SANBONGI C, et al. Extract of Perilla frutescens enriched for rosmarinic acid, a polyphenolic phytochemical, inhibits seasonal allergic rhinoconjunctivitis in humans [J]. Experimental Biology and Medicine (Maywood), 2004, 229(3): 247-254.
[13] XU Y, XU G, LIU L, et al. Anti-invasion effect of rosmarinic acid via the extracellular signal-regulated kinase and oxidation-reduction pathway in Ls174-T cells[J]. Journal of Cellular Biochemistry, 2010, 111(2): 370-379.
[14] HAN Y, MA L, ZHAO L, et al. Rosmarinic inhibits cell proliferation, invasion and migration via up-regulating miR-506 and suppressing MMP2/16 expression in pancreatic cancer[J]. Biomed Pharmacother, 2019, 115: 1078-1088.
[15] MAHMOUD M A, OKDA T M, OMRAN G A, et al. Rosmarinic acid suppresses inflammation, angiogenesis, and improves paclitaxel induced apoptosis in a breast cancer model via NF3 kappaB-p53-caspase-3 pathways modulation[J]. Journal of Applied Biomedicine, 2021, 19(4): 202-207.
[16] LIU Y, XU X, TANG H, et al. Rosmarinic acid inhibits cell proliferation, migration, and invasion and induces apoptosis in human glioma cells[J]. International Journal of Molecular Medicine, 2021, 47(5): 47-67.
[17] SHARMA S, DEEP A, SHARMA A K. Current treatment for cervical cancer: an update[J]. Anti-cancer Agents in Medicinal Chemistry, 2020, 20(15): 1768-1779.
[18] 于洗河, 張景茹, 降海蕊, 等. 中国女性1990—2019年宫颈癌和乳腺癌疾病负担分析[J]. 中国公共卫生, 2022, 38(5): 534-538.
YU Xihe, ZHANG Jingru, JIANG Hairui, et al. Disease burden analysis of cervical cancer and breast cancer in Chinese women from 1990 to 2019[J]. Chinese Journal of Public Health, 2022, 38(5): 534-538.
[19] NOOR S, MOHAMMAD T, RUB M A, et al. Biomedical features and therapeutic potential of rosmarinic acid[J]. Archives of Pharmacal Research, 2022, 45(4): 205-208.
[20] 牟宜双, 邓文龙, 周黎明. 迷迭香酸抗肿瘤作用研究进展 [J]. 中药药理与临床, 2015, 31(1): 266-269.
MOU Yishuang, DENG Wenlong, ZHOU Liming. Research progress on antitumor effect of rosmarinic acid [J]. Pharmacology and Clinic of Chinese Materia Medica, 2015, 31(1): 266-269.
[21] DEVIS-JAUREGUI L, ERITJA N, DAVIS M L, et al. Autophagy in the physiological endometrium and cancer[J]. Autophagy, 2021, 17(5): 1077-1095.
[22] 呼宁宁, 安瑞华. 自噬调节在膀胱癌发展和治疗中的作用[J]. 医学综述, 2020, 26(24): 4857-4861.
HU Ningning, AN Ruihua. Role of autophagy regulation in the development and treatment of bladder cancer [J]. Medical Review, 2020, 26(24): 4857-4861.
[23] 徐聪聪, 陈浩. PI3K/Akt/mTOR信号通路在皮肤鳞状细胞癌中的研究进展[J]. 中华皮肤科杂志, 2022, 55(3): 264-267.
XU Congcong, CHEN Hao. Research progress of PI3K/Akt/mTOR signaling pathway in cutaneous squamous cell carcinoma[J]. Chinese Journal of Dermatology, 2022, 55(3): 264-267.
[24] 张娟, 李雪, 蒋浩, 等. 竹节香附素A通过PI3K/Akt/mTOR信号通路对人宫颈癌HeLa细胞增殖和凋亡的影响[J]. 新医学, 2022, 53(4): 266-272.
ZHANG Juan, LI Xue, JIANG Hao, et al. Effects of Rhizophorin A on proliferation and apoptosis of human cervical cancer HeLa cells via PI3K/Akt/mTOR signaling pathway [J]. New Medicine, 2022, 53(4): 266-272.
[25] 秦文欣, 王永晨. 细胞自噬与PI3K/Akt/mTOR信号通路在黑色素瘤耐药性中的研究进展[J]. 醫学综述, 2022, 28(7): 1327-1331.
QIN Wenxin, WANG Yongchen. Research progress of autophagy and PI3K/Akt/mTOR signaling pathway in drug resistance of melanoma [J]. Medical Review, 2022, 28(7): 1327-1331.
[26] 巩楠, 赵琳, 常会敏. 细胞自噬在迷迭香酸促进鼻咽癌细胞凋亡中的作用研究[J]. 成都医学院学报, 2021, 16(4): 431-436.
GONG Nan, ZHAO Lin, CHANG Huimin. Role of autophagy in rosmarinic acid promoting apoptosis of nasopharyngeal carcinoma cells[J]. Journal of Chengdu Medical College, 2021, 16(4): 431-436.
收稿日期:2022-10-09;修回日期:2022-11-09。
基金项目:湖南省自然科学基金科教联合项目(2020JJ7071);湖南省教育厅自然科学项目(18C1770)。
作者简介:覃秋莲,讲师,主要从事肿瘤分子机制的研究。
* 通信作者:王志文,讲师,主治医师,主要从事肿瘤分子流行病学的研究。E-mail: wzw189189@163.com。
