皮肤黑色素瘤中的表达及其与临床预后的相关性分析
2024-01-26聂刚亓俊华
聂刚 亓俊华
摘 要:探討皮肤黑色素瘤(SKCM)中上皮膜蛋白3(EMP3)基因的表达及其与临床预后的相关性。通过GEPIA数据库分析EMP3在SKCM组织与正常组织中的表达水平。通过UALCAN、TIMER和GEPIA数据库分析EMP3表达水平与SKCM患者预后的关系。通过TIMER数据库分析SKCM中EMP3表达与免疫浸润细胞水平、免疫浸润细胞标记物的相关性。结果显示,EMP3在SKCM组织中的表达水平明显高于正常组织。EMP3的表达水平与原发性SKCM患者的总生存率无明显相关性,但是EMP3高表达与转移性SKCM患者较低的总生存率显著相关。B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞的免疫浸润水平与原发性SKCM患者的预后无明显相关性,但是B细胞、CD8+T细胞、中性粒细胞和树突状细胞的低免疫浸润水平与转移性SKCM患者较低的总生存率显著相关。转移性SKCM中EMP3高表达与CD8+T细胞、巨噬细胞和中性粒细胞的低免疫浸润水平及CD8+T细胞、巨噬细胞大部分标记物的低表达显著相关。本研究表明,转移性SKCM中EMP3的表达与免疫细胞浸润及临床预后相关,为转移性SKCM的诊治及预后评估提供了一定的理论基础。
关键词:皮肤黑色素瘤;上皮膜蛋白3;免疫浸润;临床预后
中图分类号:R318 文献标志码:A DOI:10.3969/j.issn.1007-7146.2023.01.010
The Expression of EMP3 in Skin Cutaneous Melanoma and Its Correlation with Clinical Prognosis
NIE Ganga, QI Junhuab*
(The Seventh Affiliated Hospital, Sun Yat-sen University a. Department of Dermatology; b. Department of Clinical Medical Laboratory, Shenzhen 518107, China)
Abstract: The purpose of this study is to investigate the expression of epithelial membrane protein-3 (EMP3) in skin cutaneous melanoma (SKCM) and its correlation with clinical prognosis. The expression of EMP3 in SKCM and normal tissues was analyzed using GEPIA database. UALCAN database, TIMER database and GEPIA database were used to analyze the relationship between the expression of EMP3 and the prognosis of SKCM patients. The correlations between the expression of EMP3 and immune infiltration cells level and related markers of immune infiltration cells in SKCM were analyzed using TIMER database. The results showed that the expression of EMP3 in SKCM was significantly higher than that in normal tissues. The expression of EMP3 was not related to the overall survival rate of primary SKCM patients, whereas the high expression of EMP3 was significantly related to the lower overall survival rate of metastatic SKCM patients. The infiltration levels of B cells, CD4+T cells, CD8+T cells, neutrophils, macrophages, and dendritic cells were not associated with the prognosis of patients with primary SKCM, whereas the low infiltration levels of B cells, CD8+T cells, neutrophils, and dendritic cells were significantly associated with lower overall survival rate of patients with metastatic SKCM. The high expression of EMP3 in metastatic SKCM was significantly correlated with the lower infiltration levels of CD8+T cells, macrophages and neutrophils, and the lower expression of most markers of CD8+T cells and macrophages. This study suggests that the expression of EMP3 in metastatic SKCM is related to immune infiltration and clinical prognosis, which provides a theoretical basis for the diagnosis, treatment and prognosis evaluation of metastatic SKCM.
Key words: SKCM; EMP3; immune infiltration; clinical prognosis
(Acta Laser Biology Sinica, 2023, 32(1): 069-075)
皮肤黑色素瘤(skin cutaneous melanoma,SKCM)是一种进展迅速、预后差的恶性肿瘤,已成为世界范围内主要的公共卫生问题之一。SKCM容易发生远处转移,是导致患者预后不良的一个重要因素[1]。据报道,转移性SKCM的中位生存期小于6个月,5年生存率小于5%[2]。因此,寻找早期预后标记物以实现对SKCM的早期预防和治疗对于SKCM患者的预后尤为重要。
上皮膜蛋白3(epithelial membrane protein-3,EMP3)属于外周髓鞘蛋白22(peripheral myelin protein22,PMP22)家族。人类EMP3基因位于染色体19q13.3上,其编码的EMP3蛋白是一种163个氨基酸的四跨膜蛋白(~18 kD)[3-5]。EMP3蛋白的主要功能与调节细胞增殖、分化、激活caspase凋亡通路以及细胞间的相互作用相关[6]。EMP3作为抑癌基因在一些恶性肿瘤的研究中有报道,包括食管癌、胆囊癌、神经母细胞瘤等[7-9]。然而,在乳腺癌和肝细胞癌中EMP3也被证明发挥致癌基因的作用[6, 10]。EMP3在SKCM中的作用尚未有报道,其对肿瘤免疫微环境影响的研究也较少。本研究旨在通过多个生物信息学数据库分析EMP3的表达与SKCM患者预后的关系及其对SKCM免疫微环境的影响,为SKCM的发病机制、治疗及预后评价提供新思路。
1 材料与方法
1.1 GEPIA数据库分析
GEPIA(Gene Expression Profiling Interactive Analysis)是一个网络服务器(http://gepia.cancer-pku.cn/index.html),包含来自癌症基因组图谱(The Cancer Genome Atlas,TCGA)和基因型-组织表达(Genotype-Tissue Expression,GTEx)项目的9 736个肿瘤和8 587个正常样本的RNA测序表达数据,可用于差异分析、患者生存分析和相关性分析[11]。本研究通过GEPIA数据库分析EMP3在SKCM组织和正常组织中的表达差异以及EMP3表达水平与SKCM患者累计生存率的相关性。
1.2 UALCAN数据库分析
UALCAN(The University of ALabama at Birmingham Cancer Data Analysis Portal)数据库(http://ualcan.path.uab.edu/)是一个提供基因表达量和生存分析的数据库,用于癌症转录组数据的分析[12]。本研究利用UALCAN数据库分析进一步验证EMP3表达水平与SKCM患者累计生存率的相关性。
1.3 TIMER数据库分析
TIMER(Tumor Immune Estimation Resource)数据库(https://cistrome.shinyapps.io/timer/)是一个专为系统分析不同癌症类型中免疫细胞浸润而设计的数据库。该数据库包括来自TCGA的32种癌症类型的10 897个样本,以评估6种免疫细胞(B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞)浸润的丰度[13]。本研究通过TIMER数据库首先验证EMP3表达水平与SKCM患者累计生存率的相关性,然后分析不同免疫细胞浸润水平与SKCM患者累计生存率的相关性,最后分析SKCM组织中EMP3表达水平与不同免疫细胞浸润水平及免疫浸润细胞标记物的相关性。
1.4 统计学方法
所有数据来自各在线数据库,应用系统默认的统计学方法分析,以P<0.05为差异有统计学意义。采用Spermans相关性检验进行EMP3表达与免疫浸润细胞表面标记物之间的相关性分析。
2 结果与分析
2.1 SKCM组织中EMP3的表达分析
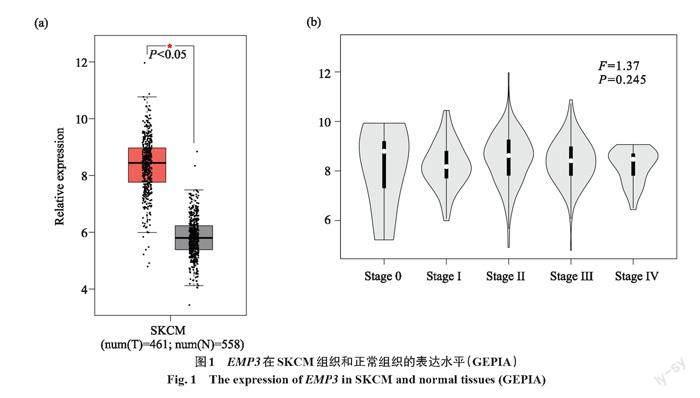
通过GEPIA数据库分析SKCM组织(461个样本)和正常组织(558个样本)中EMP3的表达差异(图1a),结果显示,EMP3在SKCM组织中的表达水平显著高于正常组织(P<0.05)。进一步比较不同临床分期的SKCM患者EMP3的表达水平(图1b),结果显示,EMP3表达水平与SKCM患者的临床分期无明显相關性(P=0.245)。
2.2 EMP3表达与SKCM患者总生存率的相关性分析
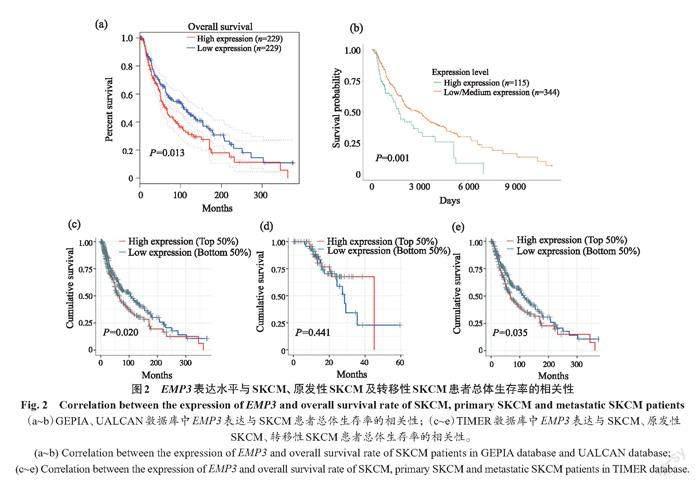
通过GEPIA数据库分析EMP3的表达水平与SKCM患者总生存率的相关性(图2a)。结果显示,EMP3高表达与SKCM患者较低的总生存率显著相关(P=0.013)。这种相关性在UALCAN数据库(图2b)及TIMER数据库(图2c)中得到验证(相应P值分别为0.001、0.020)。进一步将SKCM分为原发性SKCM和转移性SKCM两个亚组,通过TIMER数据库进行亚组分析(图2d、2e)。结果显示,EMP3表达水平与原发性SKCM患者的总生存率无显著相关性(P=0.441),但是EMP3高表达与转移性SKCM患者较低的总生存率显著相关(P=0.035)。
2.3 SKCM中免疫浸润细胞水平与患者总体
生存率的相关性分析
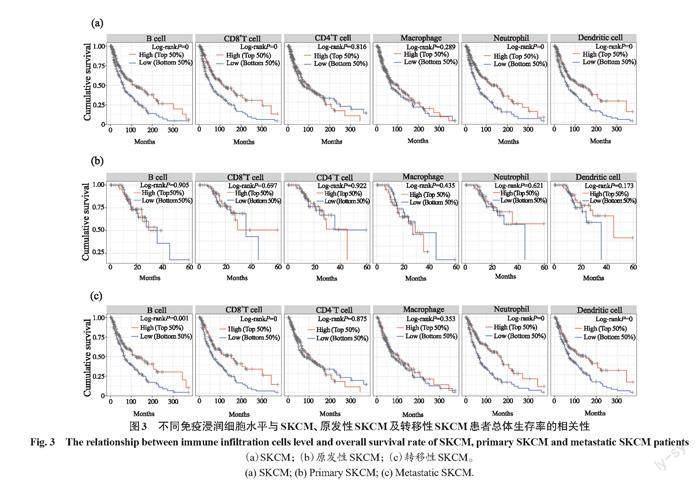
通过TIMER数据库分析SKCM中B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞的免疫浸润水平与患者预后的相关性,结果显示,B细胞、CD8+T细胞、中性粒细胞和树突状细胞的低免疫浸润水平与SKCM患者的较低的总生存率显著相关(P<0.001)(图3a)。亚组分析显示,B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞的免疫浸润水平与原发性SKCM患者的预后无明显相关性(相应P值分别为0.905、0.697、0.922、0.435、0.621、0.173)(图3b),但是B细胞、CD8+T细胞、中性粒细胞和树突状细胞的低免疫浸润水平与转移性SKCM患者较低的总生存率显著相关(相应P值分别为0.001、<0.001、<0.001、<0.001)(图3c)。
2.4 转移性SKCM中EMP3与免疫浸润细胞水平的相关性分析
由于前面的分析结果提示,原发性SKCM中EMP3表达水平及免疫浸润细胞水平与患者预后无显著相关性,因此,接下来只对转移性SKCM中EMP3与免疫浸润细胞水平的相关性进行分析(图4)。结果显示,转移性SKCM中EMP3的高表达与CD8+T细胞、巨噬细胞和中性粒细胞的低免疫浸润水平显著相关(相应P值分别为6.53e-04,1.63e-03,6.98e-05),與B细胞、CD4+T细胞和树突状细胞免疫浸润水平无明显相关性(相应P值分别为5.92e-02,8.62e-01,2.88e-01)。此外,进一步分析了EMP3表达水平与CD8+T细胞、巨噬细胞和中性粒细胞表面标记物之间的相关性,并通过肿瘤纯度进行了校正(表1)。结果显示,在转移性SKCM中EMP3高表达与CD8+T细胞标记物(CD8A、CD8B)、M1型巨噬细胞标记物(PTGS2)及M2型巨噬细胞标记物(CD163、VSIG4、MS4A4A)的低表达显著相关(相应P值分别为0.013、<0.001、0.001、<0.001、0.001、0.017),但是与中性粒细胞标记物(CD66b、CD11b、CCR7)无明显相关性(相应P值分别为0.062、0.071、0.110)。
3 讨论
EMP3作为抑癌基因在多种恶性肿瘤的研究中被报道。有研究表明,EMP3在神经母细胞瘤中通过转录抑制发挥肿瘤抑制的作用,并通过EMP3的过表达和敲除试验得到了证实[8]。Ma等[7]报道,EMP3通过干扰MAPK/ERK通路抑制胆囊癌的进展,其低表达与胆囊癌预后不良密切相关。Fumoto等[9]报道,过表达EMP3可抑制食管癌细胞系克隆形成,抑制食管癌细胞系增殖,促进食管癌细胞系凋亡,并且低表达EMP3的食管癌患者术后复发率更高。然而,EMP3在其他几种恶性肿瘤中也被证明发挥致癌基因的作用,特别是乳腺癌和肝细胞癌[6, 10, 14]。关于EMP3在SKCM中的作用尚未有报道。本研究首次探讨SKCM中EMP3的表达及其与临床预后和免疫浸润的相关性。
通过GEPIA数据库我们发现,EMP3在SKCM组织中的表达显著高于正常组织,但是EMP3的表达水平与SKCM患者临床分期无明显相关性。此外,UALCAN、TIMER和GEPIA三个数据库的分析结果一致显示,EMP3高表达与SKCM患者的较低的总生存率显著相关。通过TIMER数据库进一步进行亚组分析,结果显示,EMP3表达水平与原发性SKCM患者的总生存率无显著相关性,但是EMP3高表达与转移性SKCM患者的较低的总生存率显著相关。这提示,EMP3在SKCM中可能发挥致癌基因的作用。EMP3的表达水平对转移性SKCM患者预后评估具有一定的临床价值。
肿瘤免疫微环境在肿瘤发生、进展中具有重要作用。既往研究表明,免疫浸润参与了黑色素瘤的进展[15]。本研究探讨了B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞的免疫浸润水平与SKCM患者总生存率的相关性。结果显示,B细胞、CD8+T细胞、中性粒细胞和树突状细胞的低免疫浸润水平与SKCM患者的较低的总生存率显著相关。亚组分析显示,B细胞、 CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞免疫浸润水平与原发性SKCM患者的总生存率无明显相关性,但是B细胞、CD8+T细胞、中性粒细胞和树突状细胞的低免疫浸润水平与转移性SKCM患者较低的总生存率显著相关。
本研究显示,转移性SKCM中EMP3与CD8+T细胞、巨噬细胞和中性粒细胞的免疫浸润水平显著相关,并且与CD8+T细胞表面标记物及巨噬细胞大部分标记物的表达显著相关,但是与中性粒细胞标记物无明显相关性。这提示,转移性SKCM中EMP3主要影响CD8+T细胞和巨噬细胞的免疫浸润水平。CD8+T细胞在肿瘤微环境或肿瘤周围组织中均表现出抗黑色素瘤的能力[16],在清除肿瘤细胞中起着重要作用。CD8+T细胞可以通过释放颗粒酶和穿孔素攻击黑色素瘤细胞,从而导致细胞凋亡和新抗原在肿瘤床上的扩散[17-18]。本研究结果显示,在转移性SKCM中EMP3的高表达与CD8+T细胞的低免疫浸润水平显著相关,并且与CD8+T细胞表面标记物(CD8A、CD8B)的低表达显著相关。这说明转移性SKCM中EMP3可能通过下调 CD8+T细胞的免疫浸润水平导致患者不良的预后。巨噬细胞可极化为多种亚群。经典激活的促炎型巨噬细胞(M1型)和替代激活的抑炎型巨噬细胞(M2型)是巨噬细胞的两个主要亚群[19],前者具有增强免疫和抗肿瘤的作用,后者主要发挥促进肿瘤生长、侵袭和转移的作用[20-21]。我们发现,在转移性SKCM中,EMP3表达水平与巨噬细胞的免疫浸润水平显著负相关。进一步探索EMP3表达与肿瘤纯度调整后的免疫浸润细胞基因标记物的相关性分析发现,EMP3表达与M1型巨噬细胞标记物(PTGS2)及M2型巨噬细胞标记物(CD163、VSIG4、MS4A4A)呈负相关。这说明在转移性SKCM中EMP3可能分别通过下调M1型巨噬细胞和M2型巨噬细胞的免疫浸润水平发挥抑癌和致癌的双重作用。
综上所述,本研究初步表明转移性SKCM中EMP3的高表达与患者不良的临床预后相关,可能与其降低SKCM免疫微环境中免疫浸润细胞水平相关,特别是CD8+T细胞的免疫浸润水平。值得注意的是,本研究基于公共数据库进行挖掘,存在一定的局限性,如样本量较小、未在基因表达的蛋白水平进行验证等。因此,本研究结果仍有待于进一步的研究证实。
参考文献(References):
[1] SCHADENDORF D, VAN AKKOOI A C J, BERKING C, et al. Melanoma [J]. Lancet, 2018, 392(10151): 971-984.
[2] FECHER L A, CUMMINGS S D, KEEFE M J, et al. Toward a molecular classification of melanoma [J]. Journal of Clinical Oncology, 2007, 25(12): 1606-1620.
[3] BEN-PORATH I, KOZAK C A, BENVENISTY N. Chromosomal mapping of Tmp (Emp1), Xmp (Emp2), and Ymp (Emp3), genes encoding membrane proteins related to Pmp22 [J]. Genomics, 1998, 49(3): 443-447.
[4] WANG Y W, CHENG H L, DING Y R, et al. EMP1, EMP2, and EMP3 as novel therapeutic targets in human cancer [J]. Biochimica et Biophysica Acta-reviews on Cancer, 2017, 1868(1): 199-211.
[5] CHRISTIANS A, POISEL E, HARTMANN C, et al. Characterization of the epithelial membrane protein 3 interaction network reveals a potential functional link to mitogenic signal transduction regulation [J]. International Journal of Cancer, 2019, 145(2): 461-473.
[6] HSIEH Y H, HSIEH S C, LEE C H, et al. Targeting EMP3 suppresses proliferation and invasion of hepatocellular carcinoma cells through inactivation of PI3K/Akt pathway [J]. Oncotarget, 2015, 6(33): 34859-34874.
[7] MA Q, ZHANG Y, LIANG H, et al. EMP3, which is regulated by miR-663a, suppresses gallbladder cancer progression via interference with the MAPK/ERK pathway [J]. Cancer Letters, 2018, 430(1): 97-108.
[8] ALAMINOS M, DAVALOS V, ROPERO S, et al. EMP3, a myelin-related gene located in the critical 19q13.3 region, is epigenetically silenced and exhibits features of a candidate tumor suppressor in glioma and neuroblastoma [J]. Cancer Research, 2005, 65(7): 2565-2571.
[9] FUMOTO S, HIYAMA K, TANIMOTO K, et al. EMP3 as a tumor suppressor gene for esophageal squamous cell carcinoma [J]. Cancer Letters, 2009, 274(1): 25-32.
[10] HONG X C, FEN Y J, YAN G C, et al. Epithelial membrane protein 3 functions as an oncogene and is regulated by microRNA-765 in primary breast carcinoma [J]. Molecular Medicine Reports, 2015, 12(5): 6445-6450.
[11] TANG Z, LI C, KANG B, et al. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses [J]. Nucleic Acids Research, 2017, 45(W1): W98-W102.
[12] CHANDRASHEKAR D S, BASHEL B, BALASUBRAMANYA S A H, et al. UALCAN: a portal for facilitating tumor subgroup gene expression and survival analyses [J]. Neoplasia, 2017, 19(8): 649-658.
[13] LI T, FU J, ZENG Z, et al. TIMER2.0 for analysis of tumor-infiltrating immune cells [J]. Nucleic Acids Research, 2020, 48(W1): W509-W514.
[14] JUN F, HONG J, LIU Q, et al. Epithelial membrane protein 3 regulates TGF-beta signaling activation in CD44-high glioblastoma [J]. Oncotarget, 2017, 8(9): 14343-14358.
[15] WANG X, XIONG H, LIANG D, et al. The role of SRGN in the survival and immune infiltrates of skin cutaneous melanoma (SKCM) and SKCM-metastasis patients [J]. BMC Cancer, 2020, 20(1): 378-378.
[16] DUNN G P, BRUCE A T, IKEDA H, et al. Cancer immunoediting: from immunosurveillance to tumor escape [J]. Nature Reviews Immunology, 2002, 3(11): 991-998.
[17] GARRIDO F, CABRERA T, APTSIAURI N. “Hard” and “soft” lesions underlying the HLA class I alterations in cancer cells: implications for immunotherapy [J]. International Journal of Cancer, 2010, 127(2): 249-256.
[18] FRUCI D, BENEVOLO M, CIFALDI L, et al. Major histocompatibility complex class i and tumour immuno-evasion: how to fool T cells and natural killer cells at one time [J]. Current Oncology Reports, 2012, 19(1): 39-41.
[19] BENOIT M, DESNUES B, MEGE J L. Macrophage polarization in bacterial infections [J]. Journal of Immunology, 2008, 181(6): 3733-3739.
[20] SCHMIEDER A, MICHEL J, SCHONHAAR K, et al. Differentiation and gene expression profile of tumor-associated macrophages [J]. Seminars in Cancer Biology, 2012, 22(4): 289-297.
[21] WATKINS S K, EGILMEZ N K, SUTTLES J, et al. IL-12 rapidly alters the functional profile of tumor-associated and tumor-infiltrating macrophages in vitro and in vivo [J]. Journal of Immunology, 2007, 178(3): 1357-1362.
收稿日期:2022-10-24; 修回日期:2022-11-28。
作者簡介:聂刚,主治医师,主要从事皮肤肿瘤的基础与临床研究。
* 通信作者:亓俊华,主管技师,主要从事皮肤肿瘤的基础与临床研究。E-mail: qijh3@mail.sysu.edu.cn。
