黄颡鱼雌雄性的生理生化和mTOR信号通路基因表达分析
2024-01-26陈佳艳唐易戴柳叶王雪景黄镇彭方媛唐玲微刘文彬
陈佳艳 唐易 戴柳叶 王雪景 黄镇 彭方媛 唐玲微 刘文彬

摘 要:同齡的黄颡鱼(Pelteobagrus fulvidraco)呈现明显的两性生长差异,即雄性个体的体长、体重皆大于雌性个体。而mTOR信号通路在细胞生长、发育以及蛋白合成过程中起重要作用。为了了解黄颡鱼两性差异的营养生长机制与mTOR信号通路之间的关联性,本试验首先在生理生化特性方面对雌、雄黄颡鱼的肌肉营养成分进行了比较分析。结果表明,在雌、雄黄颡鱼的比较分析中,除了两者的水分、粗蛋白、粗脂肪含量差别不大以外,在矿物元素、氨基酸组成、蛋白的氨基酸组成和脂肪酸组成等方面,雌性黄颡鱼肌肉的营养品质相对雄性更优。针对mTOR信号通路主要基因开展实时荧光定量PCR分析,结果显示,除性腺组织外,AKT1、AKT2、AKT3、mTOR、S6KA、S6KB、4E-BP1基因在雄性黄颡鱼的肌肉、肝、肾和心脏组织中的表达均显著高于雌性,这可能与雌雄黄颡鱼生长差异有关。本研究为进一步探索黄颡鱼两性生长差异的分子机制奠定了试验基础。
关键词:黄颡鱼;营养成分;生长差异;基因表达分析;mTOR信号通路
中图分类号:S965 文献标志码:A DOI:10.3969/j.issn.1007-7146.2023.01.005
Physiological and Biochemical Indicators and mTOR Signaling Pathway Gene Expression Analysis in Female and Male Yellow Catfish (Pelteobagrus fulvidraco)
CHEN Jiayan#, TANG Yi#, DAI Liuye, WANG Xuejing, HUANG Zhen, PENG Fangyuan,
TANG Lingwei, LIU Wenbin*
(State Key Laboratory of Developmental Biology of Freshwater Fish, College of Life Science, Hunan Normal University, Changsha 410081, China)
Abstract: There is a significant sex difference in the growth of yellow catfish (Pelteobagrus fulvidraco) at the same age which shows that males are longer in length and heavier in weight than females. mTOR (mechanistic target of rapamycin kinase) signaling pathway plays an important role in cell growth, development and protein synthesis. In order to understand the correlation between the nutritional growth mechanism of yellow catfish and the mTOR signaling pathway, this study firstly analyzed the muscle nutrient composition of female and male yellow catfish in the aspects of physiology and biochemistry. The results showed that the nutritional quality of female yellow catfish muscle was better than that of the wild female yellow catfish in terms of mineral elements, amino acid composition, protein evaluation and fatty acid quality, while there was little difference in water, crude protein and crude fat content between them. Quantitative real-time PCR (qRT-PCR) analysis was conducted for the major genes of mTOR signaling pathway. The results showed that the expressions of AKT serine/threonine kinase 1 (AKT1), AKT serine/threonine kinase 2 (AKT2), AKT serine/threonine kinase 3 (AKT3), mTOR, ribosomal protein S6 kinase B1 (S6KA), ribosomal protein S6 kinase B2 (S6KB), eukaryotic translation initiation factor 4E binding protein 1 (4E-BP1) in muscle, liver, kidney and heart tissues of male yellow catfish were significantly higher than those of female. This may be related to the growth differences of female and male yellow catfish. These results provide an experimental basis for further exploring the molecular mechanism of sexual growth difference of yellow catfish.
Key words: Pelteobagrus fulvidraco; nutritional composition; growth difference; gene expression analysis; mTOR signaling pathway
(Acta Laser Biology Sinica, 2023, 32(1): 026-035)
黃颡鱼(Pelteobagrus fulvidraco),英文名为yellow catfish,别名黄姑鱼、黄鸭叫等,其肉质细嫩、味道鲜美,营养价值高,经济价值大,极受消费者喜爱。目前,关于黄颡鱼的研究多有报道,对于肌肉营养成分方面也有研究[1-8]。姜巨峰等[6]对雌雄黄颡鱼可食部分进行了基本营养成分比较分析,发现黄颡鱼肌肉的营养价值雌雄无差异。梁琍等[7]比较分析了锦江河野生黄颡鱼与养殖黄颡鱼营养品质,野生黄颡鱼肌肉部分的蛋白质品质优于养殖黄颡鱼。韩庆等[8]测定了洞庭湖黄颡鱼肌肉营养成分,发现洞庭湖黄颡鱼具有含肉率较高、肌肉粗脂肪含量适宜、肉质鲜嫩细腻、肌肉系水力较好、硬度大及弹性好的特性。但是,对于洞庭湖流域的野生雌、雄黄颡鱼肌肉品质及生理生化指标的比较鲜有报道。而且,黄颡鱼存在明显的两性生长差异,即在相同的养殖环境下,同龄的黄颡鱼雄鱼个体大,生长快,雌鱼个体小,生长慢[9],因此,黄颡鱼是进行两性生长差异研究的好材料。为了分析黄颡鱼的两性生长差异机理,本研究将对野生雌、雄黄颡鱼的肌肉营养成分及生理生化指标进行比较分析。
鱼类的生长除了与这些营养指标有关外,还与机体蛋白质的合成密切关联,旺盛的蛋白质合成是个体大、生长快的重要保障。研究表明,三倍体湘云鲫快速生长与蛋白质合成有明显的正相关,且与蛋白质代谢密切关联的氨肽酶N、多肽转运载体和谷氨酸脱氢酶在三倍体湘云鲫中的表达和活性显著高于其父母本[10]。因此,寻找与鱼类生长营养密切关联的蛋白质合成调控信号通路,势必有助于进一步揭示鱼类两性生长差异的遗传机制。
mTOR(mechanistic target of rapamycin kinase)信号通路是哺乳动物合成蛋白质的重要途径。mTOR基因是mTOR信号通路中的主导基因,可通过对下游核糖体蛋白S6激酶(ribosomal protein S6 kinase,S6K)和翻译抑制蛋白4E-BP1(eukaryotic translation initiation factor 4E binding protein 1)的调节以控制蛋白质合成[11-16]。S6K被mTOR激活后,通过对核糖体蛋白S6多个位点进行磷酸化来促进翻译起始复合体的形成,从而促进蛋白质的合成。同时mTOR也能对4E-BP1的多个位点进行磷酸化,使它与被抑制的翻译起始因子eIF4E(eukaryotic translation initiation factor 4E)脱离,促进翻译复合体的形成[17]。mTOR的活性受调节亚基proline-rich Akt substrate 40 kD(PRAS40)的负性调节,而PRAS40则受上游AKT(Akt kinase)的调节。AKT是一个促进生物体成活的重要蛋白激酶。AKT又名PKB,其家族包括三个成员,即AKT1(AKT serine/threonine kinase 1)、AKT2(AKT serine/threonine kinase 2)和AKT3(AKT serine/threonine kinase 3)。除了直接调节PRAS40以外,AKT还直接调节mTOR下游的S6K蛋白激酶[18-21]。
有研究报道,饲料喂食虹鳟鱼能诱导mTOR通路中的一系列蛋白激酶,包括mTOR、S6K、PKB和4E-BP1的磷酸化与活性,并提出哺乳动物中的mTOR通路在鱼类中完全保留[22]。四川农业大学研究小组从鲤鱼中克隆了mTOR cDNA,并推断鲤鱼mTOR由2 515个氨基酸组成,包含哺乳动物mTOR具备的FAT、FRB、PI3Kc和FATc等重要结构域[23]。这些初步的研究表明,mTOR信号通路在鱼类中也是一条重要的营养代谢通路,但是,mTOR信号通路是否与鱼类的两性生长差异有关还没有报道。
因此,本试验将以洞庭湖流域野生雌、雄黄颡鱼为材料,首先,对其肌肉的营养成分进行分析与评价,然后,应用荧光定量PCR技术检测mTOR信号通路相关基因在野生雌、雄黄颡鱼中的表达,以期为进一步探索鱼类两性生长差异的生理生化和分子机制提供试验依据。
1 材料与方法
1.1 试验材料
黄颡鱼(Pelteobagrus fulvidraco,雌/雄鱼)取自洞庭湖流域岳阳县公田镇,雌性黄颡鱼体质量20~48 g,体长9.3~15.3 cm,雄性黄颡鱼体质量22~54 g,体长9.8~17.5 cm;雌、雄黄颡鱼各16尾,均体格健壮,无伤病。样本经测量体长和体重后,参照黄峰等[24]的方法,取供试个体头后至尾柄前的全部肌肉,剪碎、混匀后低温保存供营养检测分析。另取1龄的雌、雄黄颡鱼的肌肉、肝、肾、脑、心、肠和性腺7大组织,用于提取总RNA,以上述7种组织的RNA反转录后的cDNA为模板进行实时定量聚合酶链式反应(quantitative real-time PCR,qRT-PCR)分析。在-20℃冰箱中将cDNA产物保存。具体方法参考文献[25]。
1.2 方法
1.2.1 黄颡鱼肌肉中常规营养成分的测定与分析
雌雄黄颡鱼肌肉中的水分测定方法选用的是第一法即直接干燥法,参考GB 5009.3―2016[26],步骤为:1)准备干净的称量瓶,在里面加入约适量的海砂,附带一根小的玻棒,放在101~105℃的干燥箱里1 h,取出后放到干燥器中0.5 h,重复多次至恒重;2)准确称5~10 g的样品(注意要精确到0.000 1 g)到新的称量瓶中,用干净的小玻棒搅拌均匀后放置在沸水浴上面进行蒸干,期间需不断搅拌,把瓶子底部的水滴擦干净,然后把其放在101~105℃的干燥箱里,4 h后取出,然后放置到干燥器里面0.5 h;3)再把其放入101~105℃的干燥箱里1 h,最后放入干燥器里0.5 h,重复上面的操作直到两次的重量之差≤2 g,即可视为恒重;4)对结果进行处理并表述。
参考GB 5009.5―2016[27]用凯氏定氮法测定雌雄黄颡鱼肌肉中的粗蛋白含量。测定步骤为:1)样品的处理;2)样品的测定与蒸馏;3)样品的吸收与滴定;4)数据的记录。
参考GB 5009.6―2016[28]中的第二法酸水解法来测定雌雄黄颡鱼肌肉中的粗脂肪含量,测定流程为:1)把样品按照肉类酸水解标准进行处理;2)进行抽提;3)对样品进行称量;4)对结果进行表述。
参照GB 5009.4―2016[29]的第一法来测定雌雄黄颡鱼肌肉中的粗灰分含量,测定步骤为:1)坩埚炉预处理;2)样品的处理;3)样品的测定;4)样品结果的计算及表述。
1.2.2 黄颡鱼肌肉中矿物元素的测定与分析
本试验参照GB 5009.268—2016[30]中的第一法,即电感耦合等离子体质谱法对Zn、Mg、Fe、K、Cu这5中矿物元素在雌雄黄颡鱼肌肉中的含量进行了测定,具体方法步骤为:1)对样品进行匀浆处理;2)用压力罐消解法对样品进行消解;3)校正测定的仪器;4)制作标准曲线;5)对样品进行测定;6)对样品的测定结果进行处理分析并表述。
1.2.3 黄颡鱼肌肉中氨基酸组成及含量的测定
与分析
本试验对雌雄黄颡鱼肌肉中氨基酸的测定参照GB 5009.124—2016[31],测定步骤为:1)样品的制备;2)称取≤2 g的样品;3)根据样品蛋白含量的高低加入HCl等进行水解;4)用氨基酸分析仪进行测定;5)对样品的结果进行分析并表述。
1.2.4 黄颡鱼肌肉中脂肪酸组成及含量的测定
与分析
参照GB 5009.168—2016[32]选用内标法来测定雌雄黄颡鱼肌肉中脂肪酸含量(以湿重计)。步骤为:1)样品的制备,固体样品或半固体样品磨成粉末,而液体样品则匀成匀浆;2)对样品进行预处理,包括称取适量样品、对样品进行水解、提取样品中的脂肪、对脂肪进行皂化处理及对脂肪酸进行甲酯化处理;3)色谱测定;4)对分析结果进行计算并表述。
1.2.5 qRT-PCR
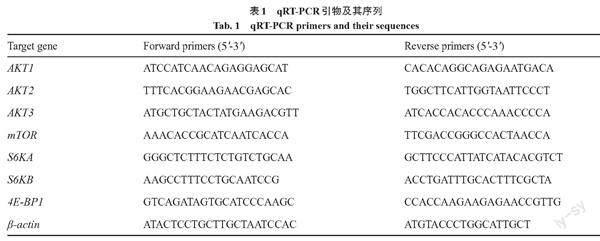
运用ABI公司的7500 Real-time PCR仪对同一时期的雌雄黄颡鱼肌肉、肝、肾、脑、心、肠和性腺组织中的AKT1、AKT2、AKT3、mTOR、S6KA、S6KB、4E-BP1基因进行qRT-PCR检测。所用qRT-PCR引物如表1所示,选取β-actin用作内参,通过2-△△Ct方法求出表达差异,结合Prism软件分析是否具有显著差异,P<0.05则说明有显著差異。具体方法见参考文献[33]。
1.3 数据处理与分析
试验数据用 Excel 2010 软件进行统计,并参考本研究小组发表的论文进行分析[34]。本试验用每克氮氨基酸评分(amino acid score,AAS)标准模式[35]结合全鸡蛋蛋白的化学评分(chemical score,CS)模式[36]来评定黄颡鱼肌肉蛋白质中氨基酸的品质。本试验即用此标准对黄颡鱼和肌肉蛋白中的氨基酸品质作较全面评定。本试验中涉及的标准模式中的AAS、CS、必需氨基酸指数(essential amino acid index,EAAI)和氨基酸含量以及支链氨基酸与芳香族氨基酸含量的比值F值(F value)的计算公式分别如(1~5)所示:
SAAS=(1)
SCS=(2)
IEAAI=n ×××…(3)
氨基酸含量(mg/gN)=×6.25×1 000(4)
F值=(5)
上述公式中,n为评价中进行比较的氨基酸个数;A为需评价样品的蛋白质氨基酸含量(按mg/gN);AE为全鸡蛋蛋白质模式的氨基酸含量(按mg/gN)。
2 结果与分析
2.1 黄颡鱼肌肉中的常规营养成分
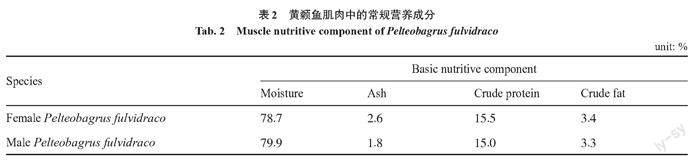
通过对肌肉中的常规营养成分测定,发现雌、雄黄颡鱼肌肉中水分含量分别为78.7%、79.9%;在粗灰分含量上,雌性黄颡鱼的含量(2.6%)是雄性黄颡鱼含量(1.8%)的1.44倍,雌性黄颡鱼粗蛋白和粗脂肪含量均较高于雄性黄颡鱼(表2)。
2.2 黄颡鱼肌肉中的矿物元素含量
本试验测定了锌、镁、铁、钾、铜5种矿物元素的含量,发现雌、雄性黄颡鱼肌肉的常量元素中钾的含量均较高,分别为3 046、3 007 mg/kg;而微量元素中锌的含量为最高,分别为14.1、10.6 mg/kg,铁、镁和铜三种元素的含量在雌性黄颡鱼中较高(表3)。
2.3 黄颡鱼肌肉中的氨基酸组成及含量
在雌、雄黄颡鱼的肌肉中均检测出16种氨基酸,包括7种必需氨基酸(essential amino acid,EAA)、2种半必需氨基酸(half-essential amino acid,HEAA)和7种非必需氨基酸(non-essential amino acid,NEAA)。其中,雌性黄颡鱼的总氨基酸含量(157.5 mg/g)是雄性黄颡鱼总氨基酸含量(128.1 mg/g)的1.23倍。在必需氨基酸(EAA)含量方面,雌性黄颡鱼总必需氨基酸含量(62.6 mg/g)是雄性黄颡鱼总必需氨基酸含量(52.9 mg/g)的1.18倍。在鲜味氨基酸(delicious amino acid,DAA)总含量方面,雌性黄颡鱼的总鲜味氨基酸含量(76.8 mg/g)是雄性黄颡鱼总鲜味氨基酸含量(61.6 mg/g)的1.25倍(表4)。
2.4 黄颡鱼肌肉中的蛋白必需氨基酸组成评价
雌、雄黄颡鱼肌肉中的总必需氨基酸含量分别为2 749、2 400 mg/gN,低于全鸡蛋蛋白标准的2 960 mg/gN,但高于FAO/WHO标准的2 190 mg/gN,即符合FAO/WHO的要求。根据AAS和CS结果,雌、雄黄颡鱼的第一限制性氨基酸均为蛋氨酸+半胱氨酸。而肌肉中EAAI值为88.59(雌性)>77.42(雄性)。两者的F值为2.22~2.25,差别不大(表5)。
2.5 黄颡鱼肌肉中的脂肪酸组成
在雌性黄颡鱼中检测出8种脂肪酸(fatty acid,FA),包括3种饱和脂肪酸(saturated fatty acid,SFA)和5种不饱和脂肪酸(unsaturated fatty acid,UFA);雄性黄颡鱼中检测出3种脂肪酸,包括1种SFA和2种UFA。不论是脂肪酸的种类还是含量,雌性黄颡鱼均要比雄性黄颡鱼丰富,雌性黄颡鱼中二十二碳六烯酸(docosahexaenoic acid,DHA)含量为0.048 6 mg/g,而在雄性黄颡鱼中未检测到(表6)。
2.6 qRT-PCR结果
利用实时荧光定量PCR技术对上述7个基因在肌肉、肝、肾、脑、心脏、肠和性腺组织进行了表达分析,结果表明:在肌肉、肝、肾、脑和心脏组织中,雄性黄颡鱼AKT1的表达量相对于雌性黄颡鱼显著上调;在性腺组织中,雄性黄颡鱼的AKT1表达量相对于雌性黄颡鱼显著下调;在肠组织中,两者没有显著差异。在肌肉、肝、肾、心脏和肠组织中,雄性黄颡鱼AKT2、AKT3 和S6KB的表达量相对于雌性黄颡鱼显著上调;在性腺组织中,雄性黄颡鱼AKT2、AKT3 和S6KB的表达量相对于雌性黄颡鱼显著下调;在脑组织中,两者没有显著性差异。在肌肉、肝、肾、脑、心脏和肠组织中,雄性黄颡鱼mTOR 和4E-BP1的表达量相对于雌性黄颡鱼显著上调;在性腺组织中,雄性黄颡鱼mTOR 和4E-BP1的表达量相对于雌性黄颡鱼显著下调。在肌肉、肝、肾组织中,雄性黄颡鱼S6KA的表达量相對于雌性黄颡鱼显著上调;在性腺和心脏组织中,雄性黄颡鱼S6KA的表达量相对于雌性黄颡鱼显著下调;在脑和肠组织中,两者没有显著差异(图1)。
3 讨论
一般来说,鱼类肌肉的水分含量平均值为80%左右,变化范围在70%~85%[37]。从表2中可以看出,黄颡鱼肌肉中的水分含量均处于一个正常范围内。蛋白质是生命的物质基础,当其含量≥15%时[38],该肉类可被称为高蛋白肉质。黄颡鱼的粗蛋白含量均高于或等于15%,因此,黄颡鱼是很好的蛋白质摄入来源。肌肉脂肪含量达到鲜样的3.5%~4.5%会有良好的适口性,且在一定范围内肉品的风味随肌肉脂肪含量的增加而持续改变[39],黄颡鱼肌肉的粗脂肪含量接近这一水平。鱼类根据脂肪的含量可以分为4类:<2%为瘦鱼,2%~4%为低脂肪鱼,4%~8%为中脂肪鱼,>8%为高脂肪鱼[40]。雌性和雄性黄颡鱼中脂肪含量分别为3.4%和3.3%,均属于低脂肪鱼。
矿物元素对人体的各项生理机能的正常运行至关重要,只能从食物中获取。本试验中所检测的Zn、Mg、Fe、K、Cu元素的含量,雌性黄颡鱼均要高于雄性黄颡鱼。从补充矿物质方面来看,雌性黄颡鱼是更好的食物来源。
氨基酸对人体的健康至关重要,其种类又是不同食物肉质风味的重要呈味物质。从表4中我们可以看出,在雌、雄黄颡鱼肌肉中均检测出16种氨基酸,其中包括7种必需氨基酸、2种半必需氨基酸和7种非必需氨基酸,这证明它们的肉质中都富含较全面的氨基酸。
根据 FAO/WHO的理想模式,质量较好的蛋白质∑EAA /∑AA为40%左右,∑EAA /∑NEAA需在 60%以上[41]。本试验中,雌、雄黄颡肌肉中的∑EAA /∑AA分别达39.75%、41.30%,∑EAA /∑NEAA分别为76.25%、81.64%,说明雌雄黄颡鱼的肌肉氨基酸比例平衡,营养价值好。而且,雌雄黄颡鱼赖氨酸的AAS和CS评分均很高,约为FAO/WHO标准的2倍,这说明黄颡鱼是一种很好的赖氨酸来源。根据 EAAI 能看出不同黄颡鱼蛋白和标准蛋白相近的程度,雌、雄黄颡鱼的EAAI值分别为88.59、77.42,表明雌性黄颡鱼的必需氨基酸组成相对更合理。
脂肪在食物加热后能产生浓烈香气,高含量的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)能显著地增加香味。亚油酸(linoleic acid,C18:2n-6c)是人体的必需脂肪酸,不仅能散发香味,而且能降低血液中胆固醇含量,预防动脉粥样硬化[42]。本试验中,C18:2n-6c在雌性黄颡鱼肌肉中的含量为0.051 1 mg/g,而在雄性黄颡鱼中基本没有检测到。此外,亚麻酸(linolenic acid,C18:3n-3)具有降低血脂、防止血栓的功能。雌性黄颡鱼的C18:3n-3含量为0.040 7 mg/g,其在雄性黄颡鱼中并未检测到。二十碳五烯酸(eicosapentaenoic acid,EPA)和DHA有舒张血管和抗血栓、防治心脑血管疾病等功能[43]。EPA和DHA 主要存在于水生生物的脂肪中,鱼类是优质的EPA和DHA来源[42]。本试验中,无论是雌性黄颡鱼还是雄性黄颡鱼均未检测到EPA,但是在雌性黄颡鱼中检测了DHA,其含量为0.048 6 mg/g。综上说明,脂肪酸组成上雌性黄颡鱼的品质更优。
通过qRT-PCR检测发现,在性腺组织中mTOR信号通路相关的几个基因 (AKT1、AKT2、AKT3、mTOR、S6KA、S6KB、4E-BP1)在雄性黄颡鱼中的表达量与雌性黄颡鱼相比表现为显著下调(P<0.01),而雌性在生长前期用于性腺生长的能量显著高于雄性,在一定程度上降低了雌性个体用于体长、体重生长的能量[44],这一点与上述结果不谋而合。肌肉、肝、肾和心脏组织中该通路相关基因AKT1、AKT2、AKT3、mTOR、S6KA、S6KB、4E-BP1在雄性黄颡鱼中的表达量与雌性黄颡鱼相比表现为显著上调,而黄颡鱼个体生长与性别有关[45],这点与上述结果互为佐证。因此,本试验的研究初步表明,mTOR信号通路相关基因可能参与了黄颡鱼两性生长差异的分子调控机制,其具体的分子机制还需要进一步深入研究。
总之,本试验对黄颡鱼营养学评价及其健康养殖具有良好的指导意义,同时为阐明mTOR信号通路调控黄颡鱼及其他鱼类的营养与生长提供了科学试验依据。
参考文献(References):
[1] 邵韦涵, 樊启学, 张诚明, 等. 黄颡鱼、瓦氏黄颡鱼及“黄优1号”肌肉营养成分比较[J]. 华中农业大学学报, 2018, 37(2): 76-82.
SHAO Weihan, FAN Qixue, ZHANG Chengming, et al. Comparative analysis of nutritive composition in muscle of “Huangyou No. 1”, yellow catfish and darkbarbed catfish[J]. Journal of Huazhong Agricultural University, 2018, 37(2): 76-82.
[2] 高四合. 不同大小黄颡鱼品质差异性的研究[D]. 天津: 天津农学院, 2017: 5-45.
GAO Sihe. Quality differences of Pelteobagrus fulcidracoin different sizes[D]. Tianjin: Tianjin Agricultural University, 2017: 5-45.
[3] 吕敏, 甘晖, 陈田聪, 等. 瓦氏黄颡鱼在稻田和池塘养殖中的生长性能和肌肉品质比较[J]. 水产学杂志, 2022, 35(1): 75-81.
LYU Min, GAN Hui, CHEN Tiancong, et al. Comparison of growth performance and muscle quality of yellow catfish (Pseudobagrus vachelli) cultured in rice fields and ponds[J]. Chinese Journal of Fisheries, 2022, 35(1): 75-81.
[4] 江瑞, 樂贻荣, 付梅, 等. 野生与船养瓦氏黄颡鱼肌肉营养组成与评价[J]. 安徽农业科学, 2017, 45(7): 96-99.
JIANG Rui, LE Yirong, FU Mei, et al. Nutritional composition analysis and evaluation on the muscles in wild and boat cage-cultured Pelteobagrus vachelli[J]. Journal of Anhui Agricultural Science, 2017, 45(7): 96-99.
[5] 马旭洲, 温旭, 王武. 野生与人工养殖瓦氏黄颡鱼肌肉营养成分及品质评价[J]. 安徽农业学学报, 2016, 43(1): 26-31.
MA Xuzhou, WEN Xu, WANG Wu. Comparisom of muscle nutritional components and nutritive quality of between wild and farmed Pelteoebagrus vachelli[J]. Journal of Anhui Agricultural University, 2016, 43(1): 26-31.
[6] 姜巨峰, 傅志茹, 张韦, 等. 雌雄黄颡鱼可食部分主要营养成分的比较分析[J]. 毕节学院学报, 2013, 31(4): 96-103.
JIANG Jufeng, FU Zhiru, ZHANG Wei, et al. Comparative analyses of the main nutritional components in edible tissues of male and female Pelteobagrus fulvidraco richardson[J]. Journal of Bijie University, 2013, 31(4): 96-103.
[7] 梁琍, 冉辉, 桂庆平, 等. 锦江河野生黄颡鱼与养殖黄颡鱼营养品质分析及比较[J]. 湖北农业科学, 2015, 54(18): 4544-4547.
LIANG Li, RAN Hui, GUI Qingping, et al. Analysis and comparison of nutritional quality between wild and cultured Pelteobagrus fulvidraco in Jinjiang river[J]. Hubei Agricultural Sciences, 2015, 54(18): 4544-4547.
[8] 韩庆, 马欣欣, 黄春红. 洞庭湖黄颡鱼肌肉营养成分及品质特性分析[J]. 食品安全质量检测学报, 2021, 12(23): 9102-9108.
HAN Qing, MA Xinxin, HUANG Chunhong. Analysis on the nutritional components and quality characteristics of Pelteobagrus fulvidraco muscle in Dongting lake[J]. Journal of Food Safety and Quality, 2021, 12(23): 9102-9108.
[9] 刘汉勤, 崔书勤, 侯昌春, 等. 从XY雌鱼雌核发育产生YY超雄黄颡鱼[J]. 水生生物学报, 2007, 31(5): 718-725.
LIU Hanqin, CUI Shuqin, HOU Changchun, et al. YY supermale generated gynogenetically from XY female in Pelteobagrus fulvidraco [J]. Acta Hydrobiologica Sinica, 2007, 31(5): 718-725.
[10] LIU Z, ZHOU Y, LIU S J, et al. Characterization and dietary regulation of glutamate dehydrogenase in different ploidy fishes [J]. Amino Acids, 2012, 43(6): 2339-2348.
[11] DO-HYUNG K, DOS D S, SIRAJ M A, et al. mTOR interacts with raptor to form a nutrient-sensitive complex that signals to the cell growth machinery[J]. Cell, 2002, 110(2): 163-175.
[12] DO-HYUNG K, DOS D S, SIRAJ M A, et al. Gbetal, a positive regulator of the rapamycin-sensitive pathway required for the nutrient-sensitive interaction between raptor and mTOR[J]. Molecular Cell, 2003, 11(4): 895-904.
[13] FANG Y, VILELLA-BACH M, BACHMANN R, et al. Phosphatidic acid-mediated mitogenic activation of mTOR signaling[J]. Science, 2001, 294(5548): 1942-1945.
[14] HU X Y, LIU Z G, LU Y T, et al. Glucose metabolism enhancement by 10-hydroxy-2-decenoic acid via the PI3K/AKT signaling pathway in high-fat-diet/streptozotocin induced type 2 diabetic mice[J]. Food and Function, 2022, 13(19): 9931-9946.
[15] MORALESJIMENEZ C, BALANTAMELO J, ARIASCALDERON M, et al. Mechanical disturbance of osteoclasts induces atp release that leads to protein synthesis in skeletal muscle through an Akt-mTOR signaling pathway[J]. International Journal of Molecular Sciences, 2022, 23(16): 9444.
[16] GROVE J R, BANERJEE P, BALASUBRAMANYAM A, et al. Cloning and expression of two human p70 S6 kinase polypeptides differing only at their amino termini[J]. Molecular and Cellular Biology, 1991, 11(11): 5541-5550.
[17] HOLZ M K, BALLIF B A, GYGI S P, et al. mTOR and S6K1 mediate assembly of the translation preinitiation complex through dynamic protein interchange and ordered phosphorylation events[J]. Cell, 2005, 123(4): 569-580.
[18] JIANG J, FENG L, LIU Y, et al. Mechanistic target of rapamycin in common carp: cDNA cloning, characterization, and tissue expression [J]. Gene, 2013, 512(2): 566-572.
[19] SHAO Z, BHATTACHARYA K, HSICH E, et al. c-Jun N-terminal kinases mediate reactivation of Akt and cardiomyocyte survival after hypoxic injury in vitro and in vivo [J]. Circulation Research, 2006, 98(1): 111-118.
[20] ALESSI D R, ANDJELKOVIC M, CAUDWELL B, et al. Mechanism of activation of protein kinase B by insulin and IGF-1 [J]. EMBO Journal, 1996, 15(23): 6541-6551.
[21] STEPHENS L, ANDERSON K, STOKOE D, et al. Protein kinase B kinases that mediate phosphatidylinositol 3,4,5-trisphosphate-dependent activation of protein kinase B [J]. Science, 1998, 279(5351): 710-714.
[22] SEILIEZ I, GABILLARD J C, SKIBA-CASSY S, et al. An in vivo and in vitro assessment of TOR signaling cascade in rainbow trout (Oncorhynchus mykiss) [J]. American Journal of Physiology Regulatory Integrative Comparative Physiology, 2008, 295(1): R329-R335.
[23] JUN J, LIN F, YANG L, et al. Mechanistic target of rapamycin in common carp: cDNA cloning, characterization, and tissue expression[J]. Gene, 2013, 512(2): 566-572.
[24] 黄峰, 严安生, 熊传喜, 等. 黄颡鱼的含肉率及鱼肉营养评价[J]. 淡水渔业, 1999,29(10): 3-6.
HUANG Feng , YAN Ansheng, XIONG Chuanxi, et al. Evaluation of the nutrition and the rate of flesh in the whole body of Pelteobagrus fulvidraco Rich[J]. Freshwater Fisheries, 1999, 29(10): 3-6.
[25] LIU W B, WANG M M, DAI L Y, et al. Enhanced immune response improves resistance to cadmium stress in triploid crucian carp [J]. Frontiers in Physiology, 2021, 12: 1-11.
[26] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品中水分的测定: GB 5009.3—2016 [S]. 北京: 中国标准出版社, 2017.
National Health and Family Planning Commission of the Peoples Republic of China. National food safety standard determination of water in food: GB 5009.3—2016 [S]. Beijing: Standards Press of China, 2017.
[27] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中蛋白质的测定: GB 5009.5—2016[S]. 北京: 中国标准出版社, 2017.
National Health and Family Planning Commission, State Food and Drug Administration. National food safety standard determination of protein in foods: GB 5009.5—2016 [S]. Beijing: Standards Press of China, 2017.
[28] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中脂肪的测定: GB 5009.6—2016 [S]. 北京: 中国标准出版社, 2017.
National Health and Family Planning Commission, State Food and Drug Administration. National food safety standard determination of fat in foods: GB 5009.6—2016 [S]. Beijing: Standards Press of China, 2017.
[29] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品中灰分的测定: GB 5009.4—2016 [S]. 北京: 中国标准出版社, 2017.
National Health and Family Planning Commission of the Peoples Republic of China. National food safety standard determination of ash in foods: GB 5009.4—2016 [S]. Beijing: Standards Press of China, 2017.
[30] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中多元素的测定: GB 5009.268—2016 [S]. 北京: 中国标准出版社, 2017.
National Health and Family Planning Commission, State Food and Drug Administration. National food safety standard determination of multi-elements in foods: GB 5009.268—2016 [S]. Beijing: Standards Press of China, 2017.
[31] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中氨基酸的測定: GB 5009.124—2016 [S]. 北京: 中国标准出版社, 2017.
National Health and Family Planning Commission of the Peoples Republic of China, State Food and Drug Administration. National food safety standard determination of amino acids in foods: GB 5009.124—2016 [S]. Beijing: Standards Press of China, 2017.
[32] 國家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中脂肪酸的测定: GB 5009.168—2016 [S]. 北京: 中国标准出版社, 2017.
National Health and Family Planning Commission, State Food and Drug Administration. National food safety standard determination of fatty acid in foods: GB 5009.168—2016 [S]. Beijing: Standards Press of China, 2017.
[33] LIU W B, YUAN X D, YUAN S L, et al. Optimal reference genes for gene expression analysis in polyploid of Cyprinuscarpio and Carassiusauratus[J]. BMC Genetics, 2020, 21(1): 107.
[34] CHEN Z N, DONG S H, DAI L Y, et al. Effect of food domestication on the growth of Elopichthys bambusa[J]. Reproduction and Breeding, 2021, 1(3): 157-166.
[35] FAO/WHO. Energy and protein requirements: report of a joint FAO/WHO ad hoc expert committee[R]. Rome, FAO Nutriton Meeting Reports Series, 1973: 40-73.
[36] 王光亚. 食物成分表:全国代表值[M]. 北京: 人民卫生出版社, 1991.
WANG Guangya. Food ingredient list: national representative values[M]. Beijing: Peoples Medical Publishing House, 1991.
[37] BOGARD J R, THILSTED S H, MARKS G C, et al. Nutrient composition of important fish species in Bangladesh and potential contribution to recommended nutrient intakes[J]. Journal of Food Composition and Analysis, 2015, 42: 120-133.
[38] ENGOR G F ?, ALAKAVNK D ?, TOSNN Y. Effect of cooking methods on proximate composition, fatty acid composition, and cholesterol content of Atlantic Salmon (Salmo salar)[J]. Journal of Aquatic Food Product Technology, 2013, 22(2): 160-167.
[39] 梁志强, 李传武, 欧燎原, 等. 湘华鲮肌肉营养成分分析与评价[J]. 营养学报, 2009, 31(4): 411-413.
LIANG Zhiqiang, LI Chuanwu, OU Liaoyuan, et al. Analysis and evaluation of the nutrients compositions of the muscle of sinilabeo decorus tungting (Nichols)[J]. ACTA Nutrimenta SINICA, 2009, 31(4): 411-413.
[40] OZYILMAZ A, DEMIRCI A, KOUNSKAN D B, et al. Macro minerals, micro minerals, heavy metal, fat, and fatty acid profiles of European hake (Merluccius merluccius Linnaeus, 1758) caught by gillnet[J]. Journal of Entomology and Zoology Studies, 2017, 5(6): 272-275.
[41] FAO/WHO. Joint FAO/WHO food standards programme codex committee additives and contaminants[R]. Geneva: FAO/WHO, 1971.
[42] SWANSON D, BLOCK R, MOUSA S A. Omega-3 fatty acids EPA and DHA: health benefits throughout life[J]. Advances in Nutrition, 2012, 3(1): 1-7.
[43] MULLEN A, LOSCHER C E, ROCHE H M. Anti-inflammatory effects of EPA and DHA are dependent upon time and dose-response elements associated with LPS stimulation in THP-1-derived macrophages[J]. The Journal of Nutritional Biochemistry, 2010, 21(5): 444-450.
[44] 賈永义. 翘嘴鲌 (Culter alburnus) 全雌育种体系建立与评价[D]. 上海: 华东师范大学, 2019: 1-8.
JIA Yongyi. Topmouth culter (Culter alburnus) all-female breeding system establishment and evaluation[D]. Shanghai: East China Normal University, 2019: 1-8.
[45] 游鑫. 温度对黄颡鱼性腺分化,性激素及早期生长的影响[D]. 湖北: 华中农业大学, 2015: 1-12.
YOU Xin. The effect of temperature on sex differentiation, sex steroid hormones and growth in yellow catfish, Pseudobagrus fulvidraco (Richardson)[D]. Hubei: Huazhong Agricultural University, 2015: 1-12.
收稿日期:2022-11-21;修回日期:2023-01-04。
基金项目:湖南省自然科学基金面上项目(2021JJ30447);湖南省教育厅重点项目(19A319);国家自然科学基金面上项目(31772902)。
作者简介:#为并列第一作者。陈佳艳,硕士研究生;唐易,硕士研究生。
* 通信作者:刘文彬,教授,主要从事细胞生物学、发育生物学及水产生物学研究。E-mail: wenbinliu@hunnu.edu.cn。
