2021年流感病毒裂解疫苗血凝素及卵清蛋白含量趋势分析
2024-01-26李晓玉李岚舒秦海洋刘书珍邓玉莹李蕴衡黄维金赵晨燕
李晓玉,李岚舒,秦海洋,刘书珍,邓玉莹,李蕴衡,黄维金,赵晨燕
中国食品药品检定研究院生物制品检定所艾滋病性病病毒疫苗室,北京 102629
流行性感冒(简称流感)是由流感病毒引起的一种急性呼吸道传染病。流感病毒属于正黏病毒科,是单股、负链分节段RNA 病毒,根据病毒核蛋白和基质蛋白的抗原性,分为甲、乙、丙、丁4 型,引起人类季节性流感流行的主要为甲型和乙型[1-2]。接种流感疫苗是目前预防流感病毒感染及流感严重并发症的最有效手段,显著降低了接种者感染流感和严重并发症的风险[3-4]。目前国内上市的流感疫苗主要为灭活疫苗(裂解疫苗和亚单位疫苗)和鼻喷减毒活疫苗,其中裂解疫苗的签发量最大。2021 年裂解疫苗共签发423 批次,合计约6 887 万人份,其中四价疫苗(包含H1N1、H3N2、Bv 和By 4 个型别)签发266批次,约占70%。
《中国药典》三部(2020版)对流感病毒裂解疫苗成品的各项检测指标进行了严格规定,涵盖血凝素(hemagglutinin,HA)含量等14 个检测项目[5]。为加强对流感疫苗的质量控制,保障人用疫苗安全,中国食品药品检定研究院(National Institutes for Food and Drug Control,NIFDC)根据批签发要求,对上市流感疫苗的无菌检查和异常毒性检查进行100%检测,对HA 含量、鉴别试验和卵清蛋白含量的检验频率应不低于30%,对细菌内毒素含量的检验频率应不低于10%。其中,HA 是流感病毒颗粒表面最主要的免疫蛋白和有效组分,药典标准为“每1 mL 各型流感病毒株HA含量应不低于标示量的80%”。由于目前未对四价疫苗进行明确规定,部分企业参照《中国药典》三部(2015 版)的标准“每1 mL 各型流感病毒株HA 含量应为配制量的80% ~120%”制定企业放行标准[6]。卵清蛋白占尿囊液总蛋白含量的60%以上,作为主要杂质成分,也是值得关注的致敏原性物质,历史上曾禁止鸡蛋过敏人群注射流感疫苗[7-8]。药典中卵清蛋白的标准为“应不高于200 ng/mL”,企业放行标准高于药典标准或与药典标准一致。
WHO 指南中将关键参数的趋势分析作为批次放行审核的重要组成部分,要求进行制造商和监管机构的趋势分析和数据比对,以便发现趋势变化或显著差异[9]。我国《生物制品批签发管理办法》中要求在资料审核时关注产品关键质量指标趋势分析是否存在异常[10]。《药品生产质量管理规范》中要求企业及时发现不良趋势,对异常趋势进行调查分析,并采取纠正和预防措施[11]。本研究通过对2021 年国内2家企业四价流感病毒裂解疫苗的HA和卵清蛋白含量检测项目进行趋势分析和数据比对,对上市流感疫苗的稳定性和有效性进行回顾性研究及评价。
1 材料与方法
1.1 数据来源 2021 年A、B 企业分别送检四价流感病毒裂解疫苗94 和88 批次,NIFDC 检验38 和32 批次,抽检率为40.4%和36.4%,符合抽检率要求。通过对疫苗送检资料的审查和实验项目的检定,收集全部批次的企业自检报告及NIFDC 检测报告中HA和卵清蛋白含量的数据。
1.2 主要试剂及仪器 参考品均购自NIBSC;琼脂糖购自美国Sigma 公司;PBS 缓冲液购自浙江吉诺生物医药技术有限公司;卵清蛋白检测试剂盒购自德国Seramun 公司;流感HA 含量扫描分析系统购自法国Microvision公司;酶联免疫检测仪购自美国Molecular Devices公司。
1.3 关键项目检测
1.3.1 HA含量 根据《中国药典》三部(2020版)规定,采用单向免疫扩散(single radial immune diffusion,SRID)法检测HA含量。取不同稀释度HA抗原参考品及待测样品加至含有标准抗血清的1.5%琼脂糖凝胶板上,于20 ~25 ℃放置18 ~24 h;用PBS缓冲液浸泡1 h后,干燥、染色、脱色。用流感HA含量扫描分析系统测量标准抗原和待测样品形成的沉淀环的直径,对其相应抗原浓度进行直线回归,获得直线回归方程,代入待测样品的沉淀环直径,即为HA含量。
1.3.2 卵清蛋白含量 采用酶联免疫吸附法。将工作浓度的酶标抗体加至酶标板中,分别加入标准卵清蛋白溶液(0.312 5 ~20 ng/mL)、质控品(7.5 ng/mL)和待测样品,37 ℃孵育1 h;洗板,加入底物液,室温避光孵育10 min;终止后,用酶联免疫检测仪检测450和630 nm 双波长的吸光度,标准曲线用四参数拟合曲线分析,代入待测样品的A值计算卵清蛋白含量。
1.4 趋势分析 将企业所有批次的数据录入GraphPad Prism 8.0 表格,纵坐标为检测结果,横坐标为批次序号,根据企业前40 连续批次的数据计算平均值和标准差(SD),以平均值±2SD为警戒限,平均值±3SD为行动限,绘制趋势分析图。超趋势(out of trend,OOT)情况判定标准:存在1 批超出行动限;连续3 批超出警戒限;连续8 批结果在平均值的一侧且接近警戒限。
1.5 数据比对 整理NIFDC 抽检样品的HA 和卵清蛋白含量数据,收集对应批次的企业自检结果进行统计分析。首先根据数据是否符合参数检验条件,进行相对应批次的配对t检验或Wilcoxon符号秩和检验,以P<0.05为差异有统计学意义。使用Bland-Altman法[12-13]考察双方数据的一致性,首先确认数据的差值无偏倚、方差齐同和正态性分布为数据行为良好,若数据行为不良,可采用数据的比值代替差值计算。使用MedCalc 20.0软件进行绘图。
2 结果
2.1 HA含量趋势分析 2家企业四价流感病毒裂解疫苗的质量标准均为配制量的80%~120%,所有批次HA 含量均符合质量标准。A 企业H1N1 HA 含量的平均值为104%,警戒线为98%和109%,行动限为96%和112%;H3N2 HA 含量的平均值为103%,警戒线为97%和108%,行动限为94%和111%;Bv HA 含量的平均值为106%,警戒线为100%和111%,行动限为97%和114%;By HA 含量的平均值为105%,警戒线为99%和112%,行动限为95%和115%。见表1。在批签发后期的72 ~79 批次,H1N1 HA 含量存在连续8 个批次在平均值上侧,且接近警戒上限的情况,属于OOT。H3N2 和Bv 分别存在连续7 个批次在平均值一侧,且接近警戒上限和下限,虽不属于OOT,但需提醒企业关注。By 含量在范围内稳定波动,批间稳定性较好。见图1。

表1 A、B企业HA含量趋势分析限值(%)Tab.1 Trend analysis limit of HA content(%)in enterprises A and B
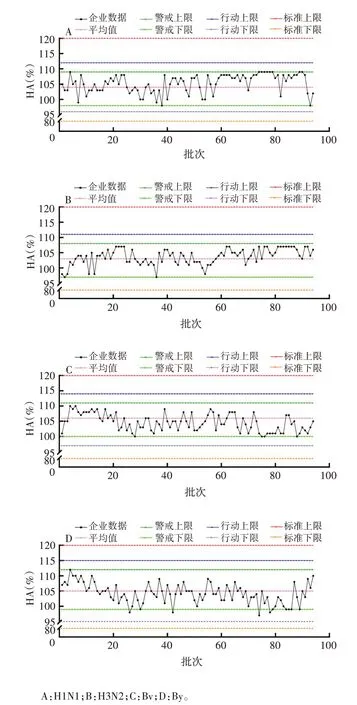
图1 A企业HA含量趋势分析图Fig.1 Trend analysis chart of HA content in enterprise A
B 企业H1N1 HA 含量的平均值为96%,警戒线为87%和104%,行动限为83%和109%;H3N2 HA含量的平均值为103%,警戒线为92%和114%,行动限为87%和120%;Bv 含量的平均值为100%,警戒线为92%和109%,行动限为88%和113%;By HA 含量的平均值为101%,警戒线为92%和110%,行动限为87%和115%。见表1。H1N1 HA 含量中存在6 个批次超出行动上限,Bv 含量的47 ~49 批次存在连续3 个批次高出警戒上限且接近行动上限,属于OOT。H3N2和By情况较好,在允许范围内稳定波动。见图2。
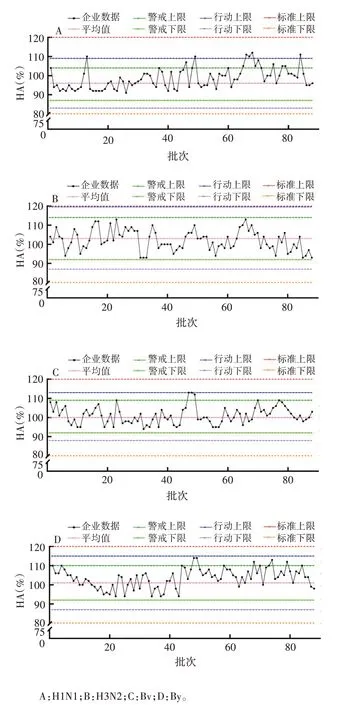
图2 B企业HA含量趋势分析图Fig.2 Trend analysis chart of HA content in enterprise B
2.2 卵清蛋白趋势分析 卵清蛋白作为残留量,仅规定其标准上限,A 企业标准为120 ng/mL,B 企业的标准为60 ng/mL,趋势分析仅计算警戒上限和行动上限。A企业卵清蛋白平均值为4.7 ng/mL,警戒上限为7.7 ng/mL,行动上限为9.2 ng/mL;B企业卵清蛋白平均值为8 ng/mL,警戒上限为15 ng/mL,行动上限为18 ng/mL。2 家企业全部批次符合质量标准要求,A 企业存在2 个批次超过行动上限,B 企业存在1个批次超过警戒上限,均属于OOT。见图3。
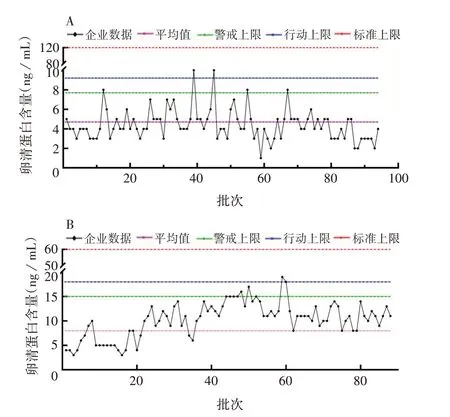
图3 A(A)、B(B)企业卵清蛋白含量趋势分析图Fig.3 Trend analysis chart of ovalbumin content in enterprises A(A)and B(B)
2.3 企业与NIFDC数据比对
2.3.1 配对统计学结果 配对t检验或Wilcoxon符号秩和检验结果显示,A企业H1N1(t=3.862,P<0.05)、H3N2(t=8.225,P<0.05)及By HA含量(t=5.616,P<0.05)差异有统计学意义,企业结果均偏高于NIFDC 结果;Bv HA 含量(t= 1.094,P>0.05)及卵清蛋白含量(w=-64,P>0.05)差异无统计学意义。B 企业H1N1(w= 232,P<0.05)、H3N2(t= 3.473,P<0.05)和By(t=4.934,P<0.05)HA 含量差异有统计学意义,企业结果均偏高于NIFDC 结果;Bv HA含量(t= 0.742,P >0.05)及卵清蛋白含量(w= 36,P>0.05)差异无统计学意义。即2家企业Bv系HA含量及卵清蛋白含量检测结果无差异,而H1N1、H3N2亚型及By系HA含量检测结果存在差异。
2.3.2Bland-Altman一致性检验结果 配对t检验得出的结论是是否有差异,难以说明一致性情况,因此采用Bland-Altman法对2家企业HA含量数据进行一致性检验。因数据行为不良,横轴表示2 个检验方检测每个样本结果的平均值,纵轴表示2 个检验方检测结果的比值,设置比值为1 线,比值平均值r线,比值的95%一致性界限(limits of agreement,LoA)的上下限(比值平均值±1.96 比值SD),比值平均值的95%CI,LoA 的95%CI,以及临床可接受的LoA 的上下限(0.8 和1.2)。若LoA 的95%CI的上下限均在临床可接受的LoA内,则可认为2组数据具有较高的一致性。根据表2、图4、图5 可知,A 企业HA LoA 的95%CI的上下限均在临床LoA内;B企业HA的H1N1亚型和Bv 系的LoA 95%CI上下限在临床LoA 范围内,H3N2 亚型的LoA 95%CI上下限和By 系的LoA 95%CI下限均超出临床LoA,且By 系有1 个比值点超出临床一致性下限。Bland-Altman一致性检验结果显示,A 企业与NIFDC 的HA 数据整体的一致性相对较好,B 企业仅有H1N1 亚型和Bv 系HA 的数据一致性较好。
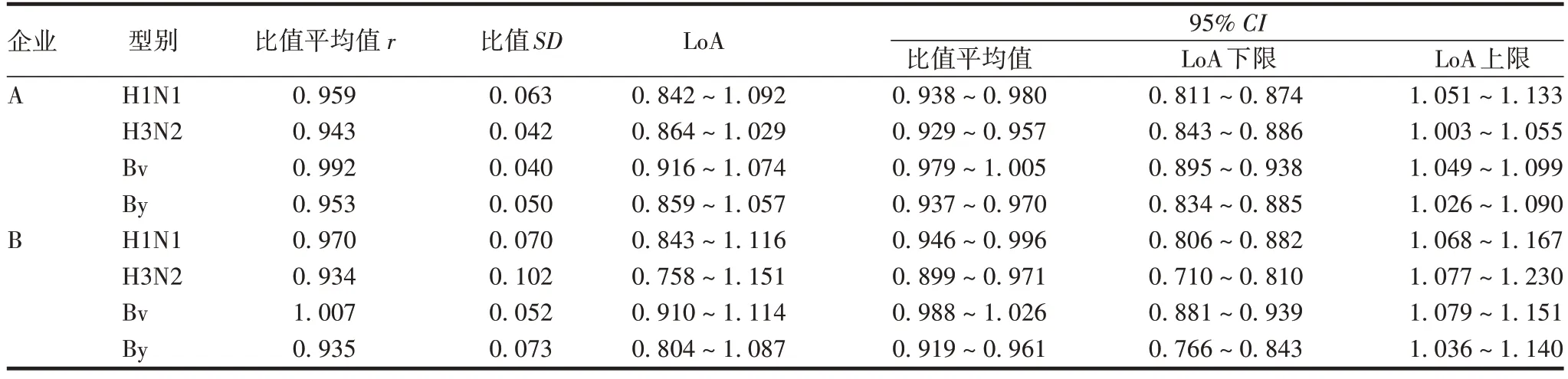
表2 A、B企业与NIFDC检测结果的Bland-Altman分析结果Tab.2 Bland-Altman analysis results of A,B enterprise and NIFDC test results

图4 A企业HA含量Bland-Altman图Fig.4 Bland-Altman diagram of HA content of enterprise A

图5 B企业HA含量Bland-Altman图Fig.5 Bland-Altman diagram of HA content of enterprise B
3 讨论
3.1 趋势分析与数据比对结果分析 选择2021年国内主要的2 家流感疫苗生产企业生产的四价流感病毒裂解疫苗,约占四价疫苗批签发总量的66%,经分析发现,HA 和卵清蛋白含量指标总体的趋势稳定,同时也暴露出一些问题。
A、B 企业回顾OOT 涉及批次的生产过程,所有工艺参数控制和产品质量均无异常,无偏差发生。A企业H1N1 亚型HA 含量存在接近警戒上限的情况,分析原因可能为配制半成品时出现H1N1 型原液添加量偏多的误差及成品HA 实验室检测误差。卵清蛋白OOT 的主要原因可能为参与配制上述2 批成品的原液中,部分原液卵清蛋白含量和配制使用量高于其他批次。B 企业H1N1 亚型和Bv 系HA 含量存在OOT,除SRID 法本身的缺陷,稀释带来的误差可能也是造成OOT 的原因,据调查,生产中H1N1 和Bv单价原液的HA含量远高于放行标准,从而增加了后续半成品配制过程中稀释的误差,此情况也发生在卵清蛋白含量的OOT 批次,涉及批次的原液普遍高于全年平均值。卵清蛋白作为残留量,由于远低于质量标准,建议企业关注趋势变化,结合自身实际情况创建适合自己的质量评价指标[14]。
结合OOT 情况和与NIFDC 的数据比对结果,发现除Bv 系HA 含量外,其他型别企业结果均偏高于NIFDC 结果,除企业与NIFDC 的检测结果可能存在系统误差外,造成HA检测结果存在差异的原因可能由于流感裂解疫苗中HA 容易降解[15],而NIFDC 的检测时间通常比企业滞后,导致NIFDC 检测结果偏低。此外,Bland-Altman法综合考虑了系统误差和随机误差,简单直观,是衡量一致性的优选方法[12-13,16-17]。采用该方法分析HA 含量的数据一致性情况,发现A企业的一致性优于B企业。
因此,企业应该重点关注原液配制半成品、半成品配制成品过程中的原料、人员、设备、方法和环境等是否发生变化,关注生产工艺和质量控制的各个环节,实时监测数据,排查分析原因,保证检测数据的科学稳定。
3.2 流感疫苗的特殊性 与其他疫苗相比,流感疫苗制备过程具有独特性和复杂性。一方面由于流感病毒的高变异性,需频繁更换疫苗毒株;另一方面疫苗生产的时效性较强,企业为满足市场需求,排产紧密,因此需额外关注生产过程和质控结果,进行更加密切的监测和制定应对措施。WHO 全球流感监测和应对系统(Global Influenza Surveillance and Response System,GISRS)负责对全球流感病毒的流行情况进行监测、预警、评价和制定应对措施,并在每年2 月份重新预测北半球流感流行株,英国NIBSC 和澳大利亚TGA 等流感参考和研究合作中心(World Health Organization Collaborating Centres,WHO CCs)负责研制新的标准抗原和标准血清以供应全世界的疫苗企业。
正是由于流感疫苗的毒株经常会发生变化,SRID法采用的标准品也需更换,标准抗血清的浓度范围也需重新调试确认,加上HA含量在有效期内呈下降趋势,均会增加实验室检测结果的不一致性。为保证实验的批间稳定性和检测的可比性,可采用内控品确保实验数据的稳定可控。此外,生物学检测方法存在较多影响因素,人员、试剂、仪器和环境等均会影响实验的稳定性,操作人员应接受统一、标准化的专业培训和定期考查,尤其在批签发期间不得随意更换,试剂耗材尽量选择同一厂家同一批号,在稳定独立的实验环境下,严格按照标准操作规程实施,做好实验操作记录,以保证原始数据的可溯源性。
3.3 趋势分析的指导建议 2021 年流感疫苗签发量为6 903万人份,2022年签发量为8 334人份,由此可见流感疫苗每年的签发量呈递增趋势。为监测流感疫苗生产及质量一致性,企业及批签发机构均应进行实时和定期的趋势分析。企业根据产量不同,可根据制品检测的实际情况分析制定限值,数据小于40 批次时,可在至少6 个连续批次的数据基础上计算平均值和SD,每增加1个数据应重新计算,超过40批次即可确定当年的警戒限和行动限。如发生疫苗株变更,虽然企业的工艺流程和生产场地未发生变更,但根据历史数据制定的警戒线和行动限有可能不适用于新的疫苗株,需要科学合理的综合判定。
批签发机构应尽量抽检多批次原液配制的成品,使抽样更具代表性,并在每年批签发工作结束后,对全年企业数据和NIFDC 数据进行趋势分析和数据比较,统计分析和整理汇总流感疫苗的效力指标及杂质成分,发现异常情况及时向企业反馈问题,建立有效的沟通机制,寻找偏差原因,提出整改建议,保证上市疫苗的工艺可控及质量稳定。
3.4 小结 针对国内流感疫苗签发量逐年增长的新形势,对流感疫苗批签发关键检测项目的趋势分析工作十分必要,也应是动态、科学的[18]。本研究首次对流感疫苗的HA 和卵清蛋白含量2 个关键质量指标进行了趋势分析和评估,相比百白破疫苗[19]、脑膜炎球菌多糖疫苗[20-21]、口服轮状病毒活疫苗[22]等评价结果,四价流感病毒裂解疫苗的HA和卵清蛋白含量存在多个OOT 情况,但尚未发现严重影响疫苗质量的原因。评估发现,流感病毒裂解疫苗的有效成分和主要杂质的检测项目总体趋势稳定,OOT 情况的出现也提醒企业应实时和定期进行数据监控,及时发现疫苗生产的潜在问题,有效控制疫苗产品质量。由于各家疫苗企业对趋势分析的重视程度和落实情况不同,批签发机构应加快对趋势分析工作的指导及规范,督促企业严格把控产品质量,将趋势分析作为风险控制的有利工具,共同为流感疫苗的安全性和有效性保驾护航。
