动物细胞培养用片状载体特性分析
2024-01-26马春英赵蕾王子凡侯刚马花马忠仁王家敏
马春英,赵蕾,王子凡,侯刚,马花,马忠仁,王家敏,
1.西北民族大学生物医学研究中心甘肃省动物细胞技术创新中心,甘肃 兰州 730030;2.西北民族大学生命科学与工程学院,甘肃 兰州 730030;3.西北民族大学生物医学研究中心生物工程与技术国家民委重点实验室,甘肃 兰州 730030;4.甘肃省生物工程材料工程研究中心,甘肃 兰州 730010
片状载体又称纸片载体或大载体[1-2],主要是由医用级高分子化合物聚酯纤维聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)通过静电超声波纺丝技术热粘合加工成多孔结构的纤维无纺布基材,进一步经焊接、成型、清洗、等离子体或化学电荷处理等工艺制成的培养贴壁依赖型细胞和悬浮细胞的一种片状固体支持生长基质[3]。片状载体由于其高效、简单、易控制的培养优势,目前一直应用于动物细胞大规模培养[4-5]。近年来,细胞源病毒疫苗迅速发展,使得片状载体市场需求量增多[6-7],但其原材料受限,进口载体占市场使用量的一半,且价格昂贵,因此,对片状载体原材料的开发与应用一直是研究的重点[8-9]。
片状载体作为动物细胞规模化培养的基质材料,其与细胞的生物相容性主要表现在细胞的黏附与增殖,细胞黏附分子结合到基质中的能力,显著影响细胞在其上的附着力[10]。因此,载体材料的化学元素组成和亲疏水性是影响细胞生长的一个重要因素。本研究对3 种片状载体化学元素组成和亲疏水特性进行分析,并对Vero、MDCK、MRC-5 细胞培养效果进行比较,以期为片状载体后续研究及生产应用提供参考。
1 材料与方法
1.1 细胞及片状载体 贴壁培养型细胞Vero、MDCK、MRC-5从ATCC引进,由甘肃省动物细胞技术创新中心保存;PET 基质多层片状载体(菱形,A)由兰州百灵塑料制品有限公司生产;Fibra-Cel圆片载体(B)购自美国Eppendorf 公司;多层片状载体(菱形,C)购自上海楚鲲生物科技有限公司。
1.2 主要试剂及仪器 M199(批号:20220419,葡萄糖浓度为1.2 g/L)、MEM(批号:20220217,葡萄糖浓度为1.0 g/L)、MDCK 专用培养基(批号:20220209,葡萄糖浓度为4.5 g/L)、0.25%胰酶(批号:20220215)和PBS 溶液(批号:20220214)均购自兰州百灵生物技术有限公司;钙黄绿素-AM(Calcein-AM)荧光染料购自大连美伦生物技术有限公司;vario-EL cube元素分析仪购自德国Elementar 公司;EscaLabXi+ X 射线光电子能谱仪(X-ray photoelectron spectrometer,XPS)购自美国赛默飞世尔公司;生物传感器分析仪(型号:S-10)购自深圳市西尔曼科技有限公司。
1.3 载体的预处理 分别称取3种载体各0.5 g进行预处理:用纯化水浸泡5 min以上,再浸泡于0.1 mol/L NaOH 溶液中4 h以上后,用纯化水反复清洗至pH为中性,控干水分,装入各含50 mL PBS溶液的125 mL摇瓶中,121 ℃,40 min高压灭菌后,分别用不同的细胞培养液过夜预孵备用。
1.4 元素分析 使用vario-EL cube 元素分析仪测定载体的组成元素。在EscaLabXi+XPS 上测定X 射线光电子能谱,获得载体表面的元素组成。
1.5 接触角测定 通过实验室自行搭建的接触角仪测定载体表面接触角,以表征载体表面的亲疏水性质。测定过程中手动向载体表面滴加3µL 超纯水,并在1 s内拍照,再利用LabView编程程序计算接触角。
1.6 细胞贴附率检测 分别复苏Vero、MDCK和MRC-5
细胞,利用常规培养方法传代扩增至足够细胞数量时,Vero 和MDCK 细胞按50×104个/mL,MRC-5 细胞按100 × 104个/mL,接种体积为50 mL 分别接种3 种载体于125 mL 锥形瓶中,各接种3 组,置于37 ℃,120 r/min,5%CO2摇床培养,分别于培养30、60、90、120、150、180 min 时取样,计数细胞培养液中的细胞浓度,按下式计算不同细胞在不同载体上的贴附率。
贴附率(%)=(初始细胞接种密度-不同时间点培养液中细胞密度)/初始细胞接种密度×100%
1.7 细胞培养效果检测 待细胞贴附载体后,弃去细胞培养液,用PBS洗去未贴壁细胞,换至新的125 mL锥形瓶中,加入50 mL 新的细胞培养液,于37 ℃,5%CO2培养箱中继续静置培养[11]。由于二倍体细胞增殖周期较长,MRC-5 细胞培养周期为10 d ,Vero 和MDCK 细胞培养周期为7 d,期间每隔24 h 取样,利用生物传感器分析仪检测葡萄糖消耗量,根据糖耗换液。按下式计算葡萄糖消耗速率和消耗总量,通过整个培养周期葡萄消耗速率曲线和消耗总量评估各载体对不同细胞的培养效果。
葡萄糖消耗速率(g/d)=[上次葡萄糖测定值(g/L)-本次时间点葡萄糖测定值(g/L)]×培养体积(L)/本次与上次取样间隔时间(h)×24(h);
累计葡萄糖消耗总量(mg)=葡萄糖消耗速率×培养体积×1 000
分别于培养7 和10 d 时取出1 ~2 片载体,用PBS 溶液温和洗涤2 ~3 次,以除去培养基中的活性酯酶,再加入一定量的Calcein-AM 荧光染色工作液(没过载体),37 ℃孵育15 ~30 min后,在倒置荧光显微镜下观察、拍照。
1.8 统计学分析 应用GraphPad Prism 8.0.2 软件进行统计学分析,试验重复3 次,数据以平均值±标准差表示。组间比较采用单因素方差分析(ANOVA),以P<0.05为差异有统计学意义。
2 结果
2.1 元素分析
2.1.1 组成元素分析结果 通过元素分析,得出3种载体主要由C、H、O 3 种元素组成,且含有少量的N元素。载体A 和C 4 种元素含量基本一致,载体B 的C 和H 元素含量均高于载体A 和C,O 和N 元素含量略低于载体A和C。见表1。
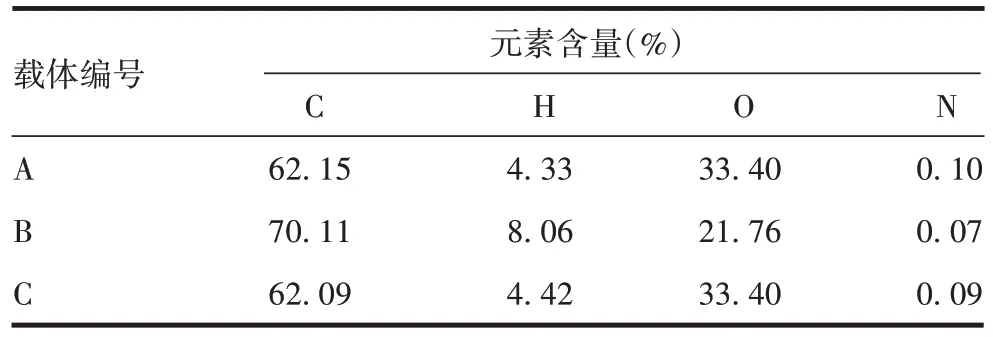
表1 元素分析结果Tab.1 Elemental analysis results
2.1.2 XPS 表面元素分析结果 3 种载体表面分别在285、533、399.9 和168.4 eV 电子结合能下均产生了C、O、N、S 4 种元素不同强度的电子波峰,其中,除载体A 无S 元素外,3 种载体均在不同电子结合能下产生了相应元素的电子波峰,载体B 的表面元素O与C 和N 与C 比值均高于载体A 和C,而载体B 与C的表面元素S基本一致。见表2。
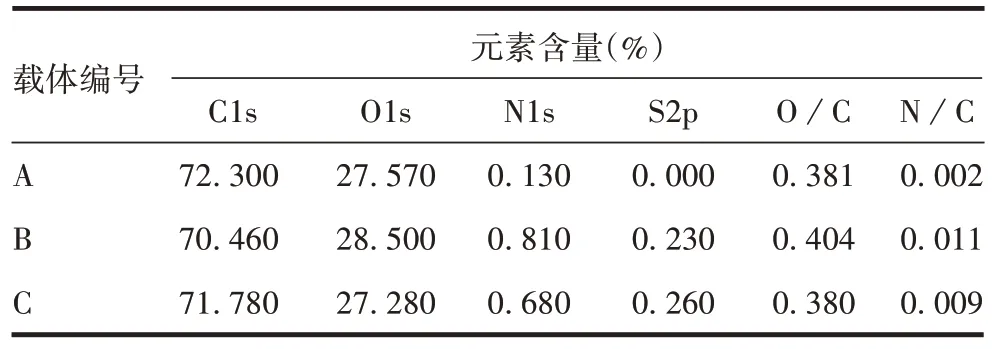
表2 XPS表面元素含量Tab.2 XPS surface element content
整体分析,除S 元素增加,3 种载体的XPS 分析与元素分析结果具有很好的相关性。
2.2 接触角 预处理前,载体B 在1 s 内迅速吸干水滴,接触角为0°,显著低于载体A 和C(F均为709.1,P均<0.000 1);而载体A 和C 水滴球未吸干,接触角分别为(109 ± 3.13)°和(121 ± 6.82)°,且载体A的接触角显著低于载体C(F=709.1,P=0.035 8)。经0.1 mol/L NaOH 溶液预处理后,3 种载体的接触角均为0°,差异无统计学意义(F=0.069 4,P>0.05)。见图1。

图1 3种载体预处理前后接触角固定图Fig.1 Contact angle images of three carriers before and after pretreatment
2.3 贴附率 Vero、MDCK 和MRC-5 细胞分别接种于3种载体后,3 h内的贴附率均在80%以上,差异均无统计学意义(Vero 细胞:载体A 与B 和C 比较,F均为0.074 2,P分别为0.997 8和0.952 7;载体B与C比较,F=0.074 2,P=0.931 7。MDCK 细胞:载体A 与B和C比较,F均为4.867,P分别为0.098 3和0.946 8;载体B与C比较,F=4.867,P=0.065 9。MRC-5细胞:载体A与B和C比较,F均为1.276,P分别为0.525 5和0.918 4;载体B与C比较,F=1.276,P=0.339 8)。见图2和图3。

图2 3种载体对不同细胞的贴附趋势Fig.2 Adhesion trend of three carriers to different cells

图3 3种载体对不同细胞的贴附率比较Fig.3 Comparison of adhesion efficiency of three carriers to different cells
2.4 不同细胞培养效果 3 种细胞在3 种载体上长势均均匀,葡萄糖消耗曲线均趋于“S”型。Vero 和MDCK 细胞均在培养120 h 时葡萄糖消耗达平台期,此时荧光强度增强,细胞在载体纤维上致密;MRC-5细胞在连续培养第9 天时荧光强度增强,细胞在载体纤维上致密,葡萄糖消耗达平台期。见图4 ~6。
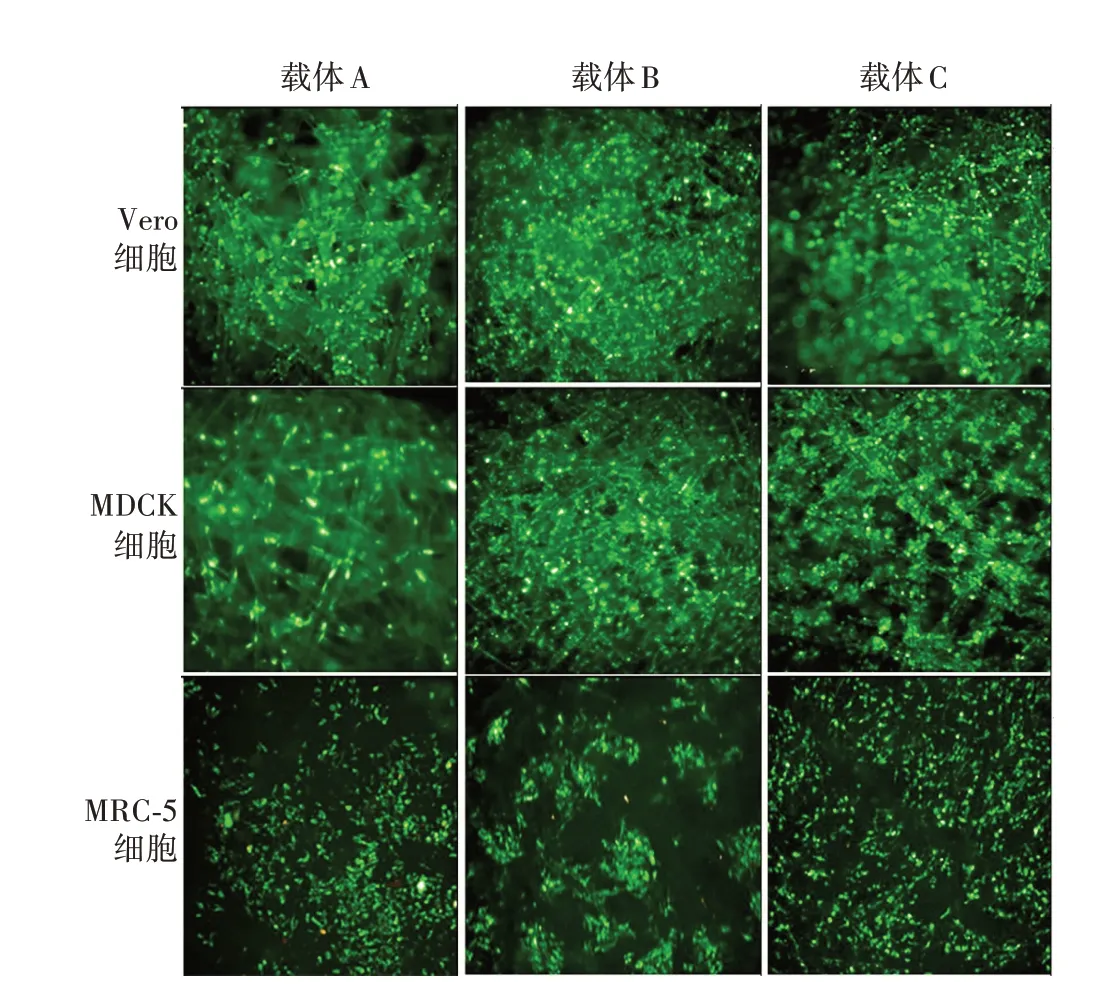
图5 培养5 d(MRC-5 细胞第9 天)细胞生长形态观察(×100)Fig.5 Observation of cell growth morphology on 5 d of culture(MRC-5 cells on 9 d)(×100)
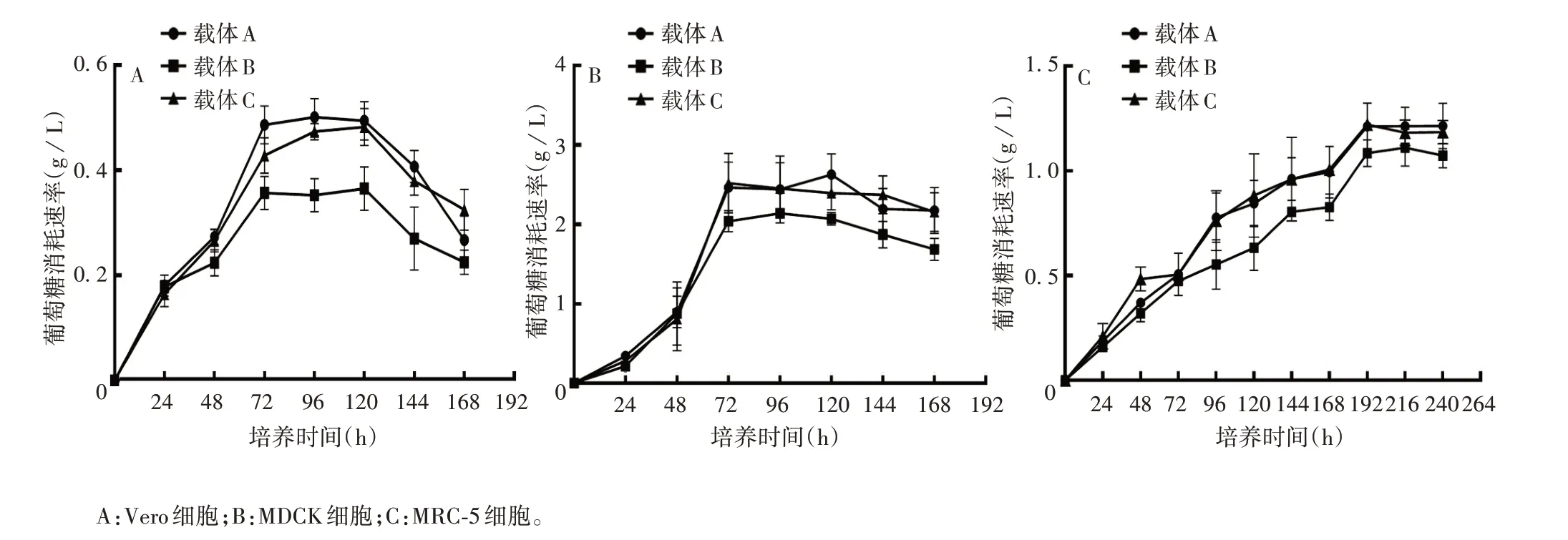
图6 3种载体培养不同细胞的葡萄糖消耗曲线Fig.6 Glucose consumption curves of different cells cultured with three carriers
Vero、MDCK 和MRC-5 细胞葡萄糖消耗总量载体A 与C 比较,差异无统计学意义(F分别为60.09、9.941和38.16,P分别为0.370 7、0.972 3和0.777 0);载体B显著低于载体A和C(Vero细胞:F均为60.09,P分别为0.000 1和0.000 3;MDCK细胞:F均为9.941,P分别为0.017 3 和0.022 4;MRC-5 细胞:F均为38.16,P分别为0.000 9 和0.000 5),这与载体本身的表面积有关,多层载体的表面积大于圆片载体。见图7。
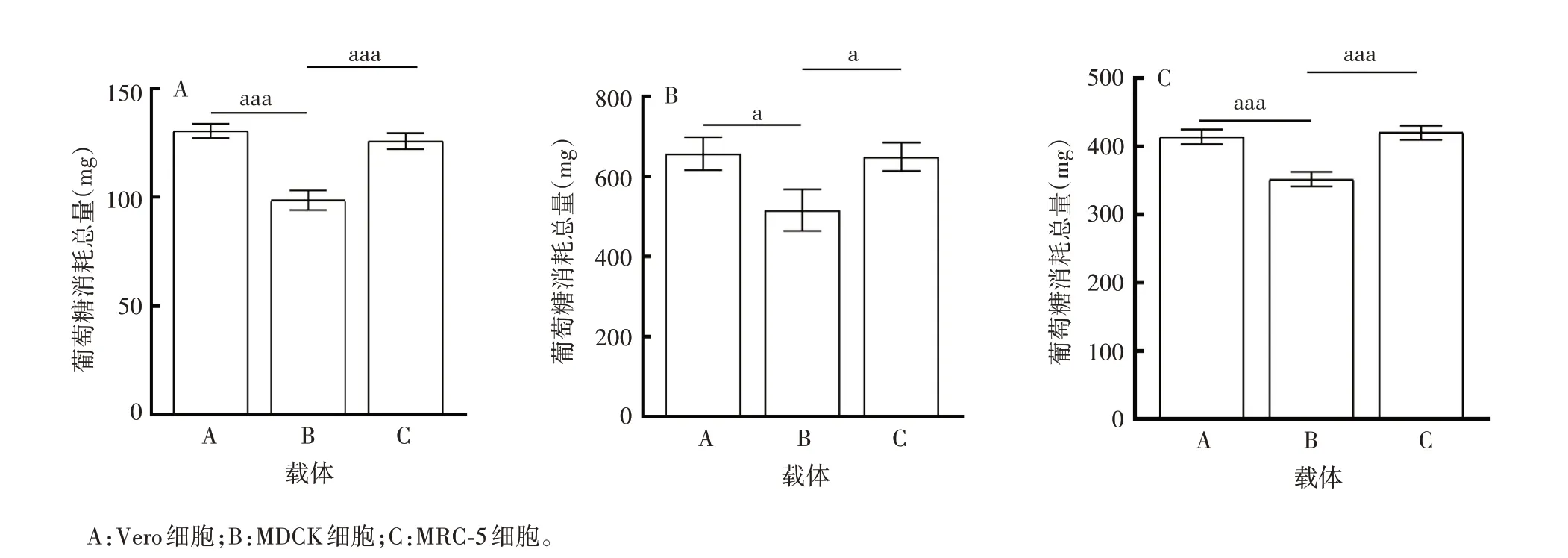
图7 3种载体培养不同细胞的葡萄糖消耗总量比较Fig.7 Comparison of total amount of glucose consumption of different cells cultured with three carriers
3 讨论
片状载体作为贴壁型动物细胞大规模培养的重要载体之一,在生物制药领域备受关注[12-13],其主要优势在于贴附面积大,吸附效率更高且损伤小,活细胞密度和产率高,培养基利用率高,接种密度较低,占地面积小,自动化程度高,更有利于灌流培养以及下游纯化,且更适用于无血清培养[14-15],可广泛应用于动物细胞的培养、抗体以及病毒疫苗的生产[16-17]。
片状载体作为目前培养贴壁依赖型细胞应用最多的载体之一,目前国内就其原材料本身的相关报道较少,尤其关于其化学元素组成与其亲疏水特性之间关系的报道更少。因此,本研究选取3 种片状载体,通过元素分析和XPS 表面元素分析以及水接触角检测技术对其元素组成和亲疏水性进行对比分析,并通过Vero、MDCK 和MRC-5 细胞对3 种载体的细胞贴附率及培养效果进行了评价,结果显示,3 种载体均主要由C、H、O 3 种元素组成,且含有少量的N 和S 元素。预处理前,载体B 的亲水性最强,A 和C亲水性较差;预处理后,A、B、C 3 种载体均亲水,且培养3 h 内对3 种细胞的贴附率均在80%以上,细胞连续培养效果良好。
3 种载体XPS 表面元素分析结果显示,载体B 表面的O 和N 元素均高于A 和C,且H 元素组成最高,其预处理前的水接触角为0°,显著低于载体A 和C(P均<0.000 1),亲水性最强。表明载体B 表面的-OH 和-COOH 亲水性基团含量较高;而载体A 和C的H 和O 元素基本一致,其水接触角分别为(109 ±3.13)°和(121±6.82)°,均亲水性较差,证明其表面缺少亲水性基团,经0.1 mol/L NaOH 溶液预处理后,载体A 和C 的水接触角均为0°,则是由于通过碱水解反应使得载体PET 表面的酯键部分断裂,产生亲水性-OH 和-COOH 基团,使得其亲水性增强[18-19]。而N 和S 元素的引入则是为了细胞能在其表面更好地黏附生长[20]。尤其是N 元素引入,不仅可使材料表面带一定数量的正电荷,促进细胞黏附,还可与细胞表面的蛋白质肽链产生分子水平官能团之间的相互作用,从各角度促进细胞的生长[21-22]。其中具体含量的影响,尚有待进一步研究。本研究还比较了3种细胞在3 种载体上的贴附率和培养效果,贴附率均在80%以上;连续培养7 ~10 d后,细胞均致密,长势均匀,葡萄糖消耗曲线均趋于“S”型,载体A 和C在3种细胞上的葡萄糖消耗总量基本一致,载体B葡萄糖消耗总量均低于载体A和C,这与载体本身的表面积有关,多层载体的表面积大于圆片载体。
综上所述,本研究对3种片状载体的化学元素组成和亲疏水特性关系进行了分析,并对Vero、MDCK和MRC-5 3 种细胞的贴附率及培养效果进行了评价,为片状载体的后续研究及生产应用提供了参考。
