环状RNA的体外构建及表达
2024-01-26唐琪刘宏博张哲罡张家友曹慧杨晓明
唐琪,刘宏博,张哲罡,张家友,曹慧,杨晓明
1.武汉生物制品研究所有限责任公司,湖北 武汉 430207;2.国家联合疫苗工程技术研究中心,湖北 武汉 430207;3.北京生物制品研究所有限责任公司质量保证部,北京 100029;4.中国生物技术股份有限公司,北京 100029
环状RNA(circular RNA,circRNA)最早被认为是一类调控微小RNA(micro RNA,miRNA),称为“miRNA海绵”的非编码RNA[1-3],目前仅部分内源性circRNA被证明可作为蛋白质翻译模板[4]。随着circRNA 的内部核糖体进入位点(internal ribosome entry site,IRES)与开放阅读框(open read frame,ORF)的发现[5],circRNA的编码表达潜力逐渐引起关注[6-7]。不同于线性构象的mRNA,circRNA 是单链共价闭环结构[8],无5'帽结构和3'聚腺苷酸化(polyA)尾巴,高度稳定,不易被核酸外切酶降解[9]。相比于mRNA体外制备过程,circRNA的体外合成省去了加帽、加尾工序,制备成本更低[10]。另有报道称,RNA环化可降低自身免疫原性,延长体内表达时间,进一步减少RNA修饰等加工步骤[11],有望成为继mRNA 疫苗下一代的新型核酸疫苗[12]。此外,circRNA在肿瘤治疗领域也展现出极大潜力[13-14]。
在WESSELHOEFT 等[6]的研究中,根据真核生物内含子外显子置换(permuted intron exon,PIE)策略,利用Ⅰ型催化内含子(groupⅠcatalytic intron)自剪接核酶的序列特点设计了RNA 体外环化(in vitrocyclization,IVC)所需的环化臂,选取柯萨奇病毒B3(Coxsackievirus B3,CVB3)株的内部核糖体进入位点(internal ribosome entry site,IRES)作为circRNA 翻译起始元件,表达了高西亚荧光素酶(Gaussia luciferase,GLuc)。同样,QU 等[15]在狂犬病疫苗的研究中,也采用该形式环化的circRNA 获得极佳的抗原表达及免疫效果。考虑到目的蛋白大小和类型对circRNA 表达的影响,本研究依次选取714 bp的增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)、1 653 bp的萤火虫荧光素酶(firefly luciferase,Fluc)及1 602 bp 的流感病毒血凝素(hemagglutinin,HA)IVR-180 基因序列构建模板质粒并IVC RNA,转染HEK-293T 细胞观察表达情况,探讨circRNA 在示踪表达及流感疫苗应用上的可能性。
1 材料与方法
1.1 细胞 HEK-293T 细胞由武汉生物制品研究所有限责任公司提供。
1.2 主要试剂及仪器 体外转录试剂盒(货号:R70-18M)、萤火虫荧光素酶检测试剂盒(货号:RG006)购自上海碧云天生物技术有限责任公司;核糖核酸酶R(RibonucleaseR,RNase R)(货号:R0301S)购自吉赛生物有限责任公司;LiCl(货号:AM9480)、细胞转染试剂lip3000(货号:L3000-015)、酶标仪购自美国Thermo公司;绵羊来源的HA IVR-180多抗(编号:17/106)购自中国食品药品检定研究院;偶联辣根过氧化物酶的驴抗绵羊抗体购自生工生物工程(上海)股份有限责任公司。
1.3 模板线性化及体外转录(in vitrotranscription,IVT) 环化模板序列主要由Ⅰ型催化内含子环化臂、CVB3-IRES 翻译起始元件及目的基因构成,分别包含目的基因EGFP、Fluc、HA(IVR-180)的环化模板扩增质粒pB-circRNA-EGFP、pB-circRNA-Fluc、pBcircRNA-HA[均由生工生物工程(上海)股份有限公司合成]。在转录序列两侧环化臂上设计上下游引物(F1:5'-ATTAAGTTGGGTAACGCC-3',R1:-CTAGATATGCTGTTATCCGTC-3'),引物由生工生物工程(上海)股份有限公司合成。采用PCR分别线性化EGFPcircRNA、Fluc-circRNA、HA-circRNA 的IVT 模板,经1%琼脂糖凝胶电泳及切胶回收纯化该线性模板;取0.5 µg DNA,20 µL 转录体系37 ℃孵育2 h;加入无RNA 酶水80 µL 及1 µL DNaseⅠ,进行DNA 模板消化,37 ℃5 min。
1.4 IVC、RNase R 消化及LiCl纯化 制备终浓度含250 mmol/L Tris-HCl、50 mmol/L MgCl2、5 mmol/L DTT、10 mmol/L GTP,pH 7.5的环化试剂。取1.3项80 µL IVT 产物与20 µL 环化试剂混匀,55 ℃孵育15 ~30 min完成IVC;用RNase R消化circRNA,37 ℃孵育10 min;用终浓度2.5 mol/L LiCl,-20 ℃沉降1 h;4 ℃,10 000 ×g离心10 min;弃上清,用无RNA酶水复溶沉降物。
1.5 HEK-293T细胞培养及circRNA转染 用含10%新生牛血清的DMEM培养基37 ℃,5%CO2培养HEK-293T 细胞,经3 次传代培养后生长至70% ~80%汇合度时,按1 × 106个/孔铺至6 孔板中,培养过夜;取circRNA 与lip3000 混合,室温孵育15 min;加至6孔板对应细胞孔中,每孔转染1 ~3 μg circRNA,于37 ℃,5%CO2培养箱中孵育适当时间。
1.6 EGFP 在HEK-293T 细胞中表达的检测分别将EGFP-circRNA 环化前后1µg 核酸与3µL lip3000 混合孵育后转染HEK-293T 细胞,分别于转染后24、48、96及144 h,收集细胞,荧光显微镜下观察绿色荧光,曝光时间为200 ms,拍照并记录。
1.7 Fluc在HEK-293T细胞中表达的检测 分别将1、2、3 µg Fluc-circRNA 与5 µL lip3000 混合孵育后转染HEK-293T 细胞,转染后24 h 收集细胞,裂解释放蛋白,与荧光底物混合,于酶标仪下检测荧光数值(relative light unit,RLU),对circRNA 的表达能力进行相对定量并分析。以未转染Fluc-circRNA 的细胞裂解液为空白对照。具体操作按照萤火虫荧光素酶检测试剂盒说明书进行。
1.8 HA在HEK-293T细胞中表达的检测 采用Western blot 法。将2µg HA-circRNA 与5µL lip3000 混合孵育后转染HEK-293T 细胞,转染后24 h 收集细胞,用RIPA 裂解液裂解细胞,提取蛋白,与还原性loading buffer 混匀后100 ℃煮沸10 min,制备SDS-PAGE 样品。将样品经12%SDS-PAGE 分离及转膜后,用5%脱脂牛奶封闭过夜;以绵羊来源的HA IVR-180 多抗为一抗,4 ℃孵育过夜;以偶联辣根过氧化物酶的驴抗绵羊抗体为二抗,室温孵育2 h;将自发光底物涂于孵育后膜表面,于成像仪下扫描拍照并记录。
1.9 统计学分析 实验数据采用GraphPad Prism 8.0软件进行非配对t检验分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 包含Ⅰ型催化内含子结构的RNA 环化模板鉴定 IVT 的模板扩增质粒pB-circRNA-EGFP、pBcircRNA-Fluc、pB-circRNA-HA的结构见图1,分别借由上、下游PCR获得线性化DNA模板,再经IVT获得线性RNA,在环化试剂作用下以包含Ⅰ型催化内含子的5'和3'环化臂配对进行自剪接反应,完成环化并因环化臂的脱落产生小片段。
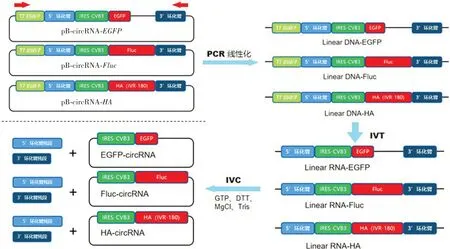
图1 模板扩增质粒结构及circRNA IVC示意图Fig.1 Schematic diagram of template amplification plasmid structure and circRNA IVC
2.2 IVC后RNA抵抗RNase R 消化 由IVT环化的RNA 因其环化过程脱落2 条大小不一的环化臂,其电泳条带变小,同时泳道中增加了2 个小条带,以EGFP-circRNA 环化为例,见图2A。用RNase R 分别消化环化前后RNA,未环化RNA 完全降解,而环化后RNA 可部分保留;此外,将环化时间由15 min 延长至30 min,发现环化泳道中RNA的弥散方式改变,且经RNase R 消化后保留的RNA 有所增加。鉴于RNase R 消化方式,可利用其对环化后RNA 进行纯化。见图2B。
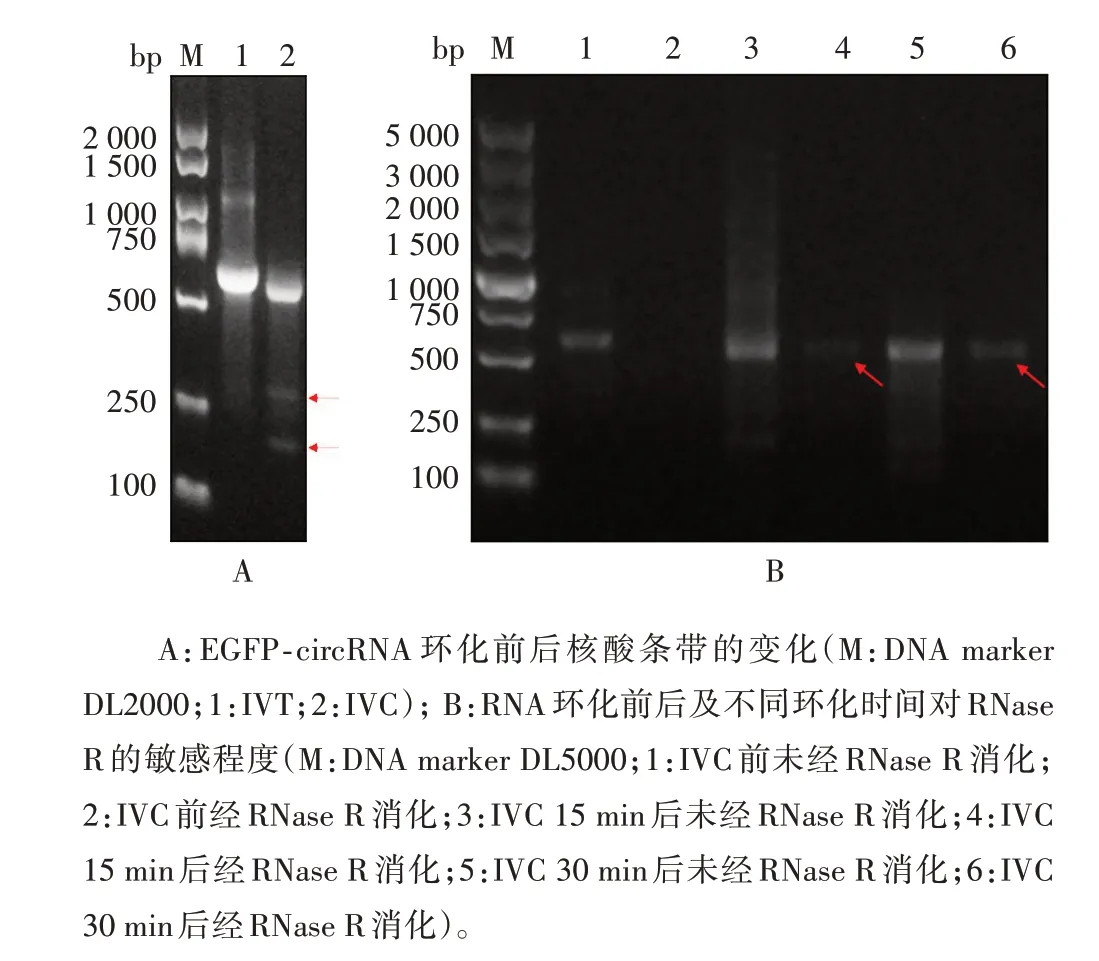
图2 EGFP-circRNA 环化及RNase R 消化处理的核酸电泳图Fig.2 NucleicacidelectrophoreticprofilesofEGFP-circRNA cyclization and RNase R digestion treatment
2.3 EGFP-circRNA在HEK-293T细胞中的表达 转染EGFP-circRNA 环化RNA 的HEK-293T 细胞在24、48、96、144 h,于荧光显微镜下均可见明显的绿色荧光;连续培养144 h 后,HEK-293T 细胞开始出现堆积、漂浮;而转染未环化RNA 的HEK-293T 细胞均未见荧光。见图3。表明含有IRES-CVB3 翻译起始元件的RNA,其环化对于蛋白的表达是必要的,且在转染后24 h即有较好表达。

图3 EGFP-circRNA 转染后HEK-293T 细胞的荧光显微镜观察(×20)Fig.3 Fluorescence microscope observation of HEK-293T cells transfected with EGFP-circRNA(×20)
2.4 Fluc-circRNA在HEK-293T细胞中的表达将表达的目的蛋白更换为相对分子质量较大的Fluc 蛋白,IVC前Fluc-circRNA转录表达的荧光值为87.50,约为空白对照组(16.67)的5 倍,而IVC 后Fluc-circ-RNA 的表达更显著,1、2 和3 µg 转染剂量组平均荧光值分别为2 116.67、3 250.00 和3 795.83,分别为空白对照组的127(t= 40.93,P<0.000 1)、195(t=17.27,P<0.000 1)、228倍(t=24.35,P<0.000 1)。见图4。
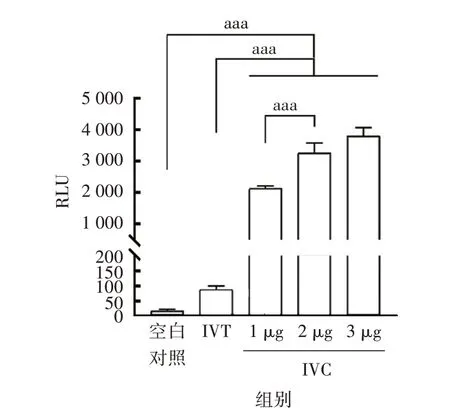
图4 Fluc蛋白表达检测的荧光数值Fig.4 RLU for Fluc expression detection
2.5 HA-circRNA在HEK-293T细胞中的表达 Western blot分析显示,circRNA上有HA蛋白表达,见图5。
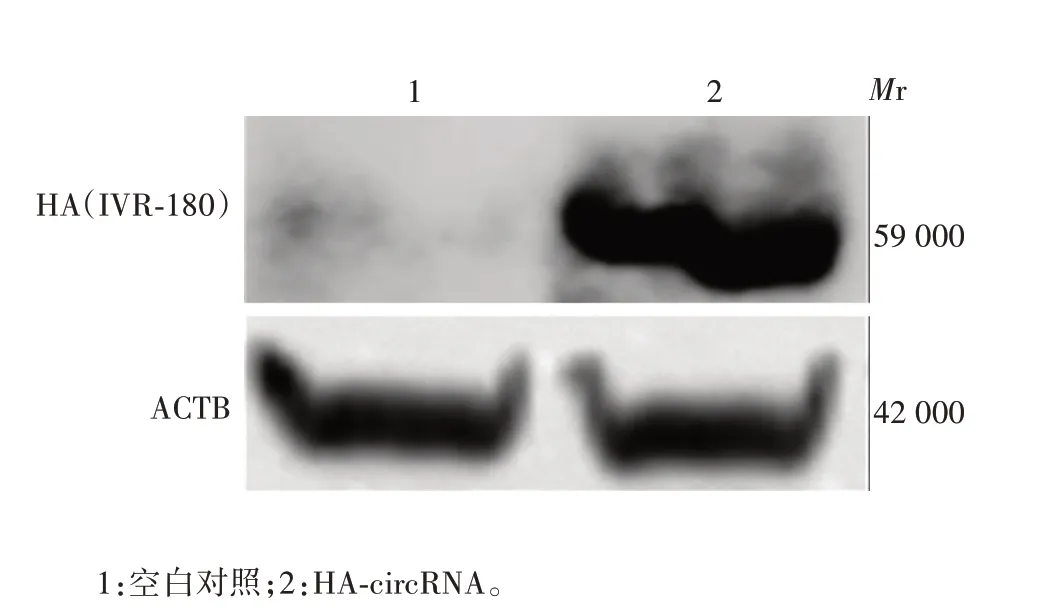
图5 HA 蛋白在HEK-293T 细胞上表达的Western blot分析Fig.5 Western blotting of HA protein expressed in HEK-293T cells
3 讨论
2019年,SARS-CoV-2的暴发推动了全球mRNA疫苗领域的飞速发展[16-17],但mRNA疫苗在体内递送和储存方面的问题增加了生产和运输成本[18]。相比之下,circRNA 的环形结构不易被RNA 酶降解,其稳定性更适于RNA水平生物信息的传递及处理[19-20],尤其是随着可编码circRNA的发现,使其成为继mRNA疫苗后最具潜力的新型核酸疫苗[4]。人工设计的circRNA已在COVID-19 及难以治疗的黑色素瘤恶性肿瘤中表现出预防及治疗效果[21-22]。
本研究参考WESSELHOEFT 等[6]方法,利用Ⅰ型催化内含子结构构建的5'和3'环化臂及IRES-CVB3翻译起始元件成功表达了报告基因EGFP、Fluc及具有应用价值的流感HA。该种RNA IVC 方式是利用PIE策略中双酯交换反应,因此在环化过程中产生两端同源臂脱落的小片段,可据此作为IVC 发生的标志。虽然文献[6]显示该方法环化率高达90%以上,但经RNase R 处理过的RNA 条带灰度不到50%,可能如QU 等[15]的研究结果,较长时间的RNase R 处理会对circRNA 产生一定降解作用。此外,本研究在circRNA 表达EGFP时,转染未环化的RNA未观察到绿色荧光,而在Fluc的表达中,IVT-RNA 组检测到的数值比空白组高5倍,提示该circRNA 上元件在环化前线性RNA 形态下也有一定的表达功能,或者能在未添加环化试剂时自发环化。最后,利用流感HA(IVR-180)抗原蛋白也验证了这种体外制备可编码circRNA骨架的普遍适用性,同时也为流感HA-circRNA疫苗的研究奠定了基础。
