一株产表面活性剂菌株的筛选、培养条件优化及产物性质
2024-01-25肖燕然周爽姿张思宇孟珈同付永平韩雪容
肖燕然,周爽姿,李 爽,张思宇,李 雪,孟珈同,付永平,韩雪容,
(1. 长春理工大学 生命科学技术学院,吉林 长春 130000;2. 吉林农业大学 植物保护学院 食药用菌教育部工程研究中心,吉林 长春 130000)
生物表面活性剂是微生物在代谢过程中产生的,具有亲水端和疏水端的一类次级代谢产物。根据亲水端的结构不同,可分为糖脂类、氨基酸类和磷脂类生物表面活性剂等[1-3]。其中,糖脂类表面活性剂由糖(亲水端)和脂肪酸(疏水端)构成。按糖的结构不同,又可分为4类:鼠李糖脂、槐糖脂、海藻糖脂和甘露糖赤藓糖醇酯[4]。Pseudomonasaeruginosa、Bacillussubtilis、Aspergillussp.MSF1和BacillussubtilisTU2等不同菌属的细菌都具有合成鼠李糖脂的能力[5-8]。其中,由Pseudomonasaeruginosa代谢产生的一种含有五碳糖基的鼠李糖脂可以作为化学合成表面活性剂的替代品,是近年来最有希望实现工业化量产的生物表面活性剂[9-10]。
生物表面活性剂在石油开采、环境、医药和农业等领域都发挥着重要作用[11]。鼠李糖脂不仅可作为助剂,提高石油的开采量;而且可以促进甲烷水合物的形成,提高能源利用效率[12]。鼠李糖脂和槐糖脂都具有广普的抗菌活性,可作为食品添加剂在食品工业中被广泛应用[13]。在医疗领域,双鼠李糖脂具有杀死肌成纤维细胞的能力;槐糖脂能减弱乳腺癌细胞的迁移;海藻糖则具有调节免疫的作用,可用于瘢痕的治疗、抗肿瘤药物的开发和免疫保健品的研制[14]。甘露糖赤藓糖醇酯可以促进微生物细胞在叶片表面的分散和固定,因而可以被应用于农业领域[15]。
随着生物表面活性剂在不同领域的广泛应用,其市场需求也在不断增加。然而,利用微生物发酵生产生物表面活性剂面临着生产菌株有限、菌株生产力低、合成成本高以及合成产物结构多样等问题[16]。本研究以污水厂底泥为筛选源,使用含糖培养基,筛选出一株具有生产生物表面活性剂的纯菌株。利用镜检、革兰氏染色,以确定菌株形态及阴阳性,并根据16S rDNA序列分析鉴定菌株的种属分类,进一步对菌株的培养条件进行优化。然后利用薄层层析(TLC)和含糖量测定,初步对菌株发酵产物进行鉴定。最后对菌株的发酵产物的乳化性能及表面张力等性质进行评价,以期为丰富生物表面活性剂生产菌,开发发酵生产流程及表面活性剂的应用提供基础数据。
1 材料和方法
1.1 材料
1.1.1 培养基
LB培养基:胰蛋白胨10.0 g/L、酵母提取物5.0 g/L、NaCl 10.0 g/L,纯水1 000 mL,pH 7.0。
LB固体培养基:每100 mL LB培养基中加入琼脂粉1.5 g。
1.1.1.1 无机盐基础培养基
母液(g/L):Na2HPO4·12H2O 9.0、KH2PO41.5、NH4Cl 0.5、MgSO4·7H2O 0.2。
1.1.1.2 微量元素(g/L)
FeCl39.7×10-3、CaCl27.8×10-3、CoCl2·6H2O 0.13×10-3、CuSO4·5H2O 0.16×10-3、NiCl3·6H2O 0.12×10-3、CrCl3·6H2O 0.11×10-3。
1.1.1.3 十六烷基三甲基溴化铵(CTAB)固体平板
基础无机盐培养基100 mL中加入琼脂粉1.5 g、亚甲基蓝0.005 g和CTAB 0.02 g。
1.1.2 仪器和试剂
1.1.2.1 主要仪器
SPX-250型摇床培养箱,上海市博讯实业有限公司医疗设备厂;5424R型高速冷冻离心机,德国eppendorf公司;P-1型层析缸,广州市三合化玻仪器部;RE-52A型旋转蒸发仪,上海市亚荣生化仪器厂;FD-1D-80型冻干机,北京市博医康实验仪器有限公司;JYW-200A型自动界面张力仪,承德市精密试验机有限公司。
1.1.2.2 主要试剂
葡萄糖、蔗糖、果糖、麦芽糖、辛酸钠、月桂酸钠、淀粉、石蜡和CTAB,上海市源叶生物科技有限公司;辛酸乙酯、氯仿、甲醇、乙酸乙酯、苯酚、HCl、H2SO4、NH4Cl、KNO3、NH4NO3、(NH4)2SO4和CH3COONH4,天津市光复精细化工;鼠李糖脂标品,西安市瑞捷生物科技有限公司。
1.2 实验方法
1.2.1 菌株的筛选
1.2.1.1 样品的采集
用50 mL灭菌管,取长春市西郊污水厂底泥6份,分别编号后保存于4 ℃冰箱。
1.2.1.2 富集培养
根据文献[17]的方法,在无菌条件下,将采集到的样品分别加入30 mL无菌水,180 r/min摇床振荡混合12 h,于30 ℃静置30 min后,取上清液5 mL接种到装有100 mL LB培养基的摇瓶中,放在摇床中以180 r/min、30 ℃振荡培养14 h,即得富集液。
1.2.1.3 菌株的初筛
根据文献[18]的方法,取富集液,用无菌水进行10-4、10-6和10-8倍的梯度稀释后,涂布于含有质量分数1%植物油的LB平板培养基上,于30 ℃培养36 h。挑取有较大排油圈的单菌落,在LB固体平板上得到初筛菌株。
1.2.1.4 菌株的复筛
根据文献[19]的方法,挑取经初筛纯化后的单菌落,以180 r/min、30 ℃,于LB培养基中培养3 d,在5 000 r/min、以4 ℃离心10 min,除去菌体,保留上清液。将上清液滴入装有液体石蜡膜和蒸馏水的平皿中,形成排油圈,选取排油圈直径最大的菌株,保存于-80℃冰箱。
1.2.1.5 菌株的种属鉴定
以筛选菌株基因组DNA为模版,利用通用引物27F/1492R,进行菌株的16S rRNA基因片段的PCR扩增,将提纯的DNA片段插入pQE-80L质粒后,转染E.coliJM109,以获得菌落。挑取单菌落培养后,提取质粒,进行测序,以获得分离菌株的16S rRNA基因的碱基序列。获得的基因碱基序列与NCBI中基因库的细菌进行同源性比对,利用MEGA (7.0.26)制作系统树,以确定种属并命名。
1.2.2 菌株培养条件的优化
1.2.2.1 温度与pH的优化
根据文献[20-21]的方法,取保存菌种50 μL,加入 5 mL LB液体培养基中,以27 ℃、180 r/min扩大培养14 h。以体积分数5%的接种量,接种5 mL于装有100 mL LB培养基的三角烧瓶中,于16、27、37和42 ℃摇床中培养,每隔1 h取1 mL菌液置于石英比色皿中,于595 nm测定吸光度,通过测定的数据绘制该菌的温度生长曲线。
每个温度分别进行3组平行实验,取平均值。用同样方法优化菌株的pH (6、7、8和9)。每个pH分别进行3组平行实验,取平均值。
1.2.2.2 碳源与氮源的优化
根据文献[22]的方法,将5 mL活化后的菌株发酵液以体积分数5%的接种量,分别加入含有质量分数为1%碳源的100 mL无机盐培养基中(含葡萄糖、蔗糖、果糖、麦芽糖、辛酸钠、月桂酸钠、淀粉和食用油),在27 ℃、pH 7.0下培养3 d后,于5 000 r/min条件下离心10 min后,弃去上清,收集菌体后冻干至恒质量。
每组碳源优化分别进行3组平行实验,取平均值。同样方法将质量分数为1%的氮源(含NH4Cl、KNO3、NH4NO3、(NH4)2SO4和乙酸铵)加入质量分数为1%葡萄糖的100 mL无机盐培养基,优化菌株的氮源。每组氮源优化分别进行3组平行实验,取平均值。
根据文献[23]的方法,利用酸沉淀-溶剂萃取法,分别提取发酵液中的表面活性剂,真空冷冻干燥至恒质量,测定表面活性剂的产量。
1.2.3 菌株发酵液中产物的提取(酸沉淀-溶剂萃取法)
根据文献[24]的方法,将20 mL活化菌株接种于以体积分数1%葡萄糖为碳源的1 L无机盐培养基中,在27 ℃、pH 7.0和180 r/min条件下培养3 d。发酵液在5 000 r/min、4 ℃条件下离心20 min,除去菌体,收集发酵液。将发酵液调pH至2.0,于4 ℃静置过夜。将过夜后的发酵液以10 000 r/min、4 ℃离心20 min后,收集絮状物沉淀。将絮状物沉淀的pH调至7.0,用乙酸乙酯萃取 3次,通过旋转蒸发仪去除有机溶剂后,得到黄色黏稠状物质,真空冷冻干燥至恒质量。
1.2.4 菌株发酵产物荷电性的检测 (CTAB培养法)
根据文献[25]的方法,将扩大培养后的菌株发酵液稀释10-2、10-4和10-6倍后,涂布于含有质量分数1%葡萄糖的CTAB固体平板上,于27 ℃恒温静置培养2 d,通过观察单菌落颜色来判断菌株发酵产物的电荷性(若产生蓝色的单菌落,则为阴离子表面活性剂)。
1.2.5 菌株发酵产物的薄层层析(TLC)检测
将提取的0.1mg发酵产物和0.1 mg鼠李糖脂标准品分别溶于5 mL氯仿中,展开剂为氯仿与甲醇的混合溶液,体积比为1∶1,显色剂为苯酚-H2SO4溶液。将展开剂倒入层析缸,静置20 min,将样品与鼠李糖脂标准品点样于硅胶板上,待完全干燥后,放入含有展开剂的层析缸中,至距离硅胶板上方1 cm处时停止。待硅胶板上展开剂挥发干净后,均匀喷洒显色剂,并于70 ℃烘箱中加热20 min,观察其颜色的变化。
1.2.6 菌株发酵产物糖含量的检测
分别取鼠李糖脂0.02、0.04、0.06、0.08和0.10 g/L各0.5 mL,加入0.5 mL体积分数为 6%的苯酚溶液,加2.5 mL浓H2SO4后,置于冰水浴中轻微振荡并混匀,室温静置20 min,于490 nm处测定不同质量浓度鼠李糖的吸光度。根据文献[26]的方法,以鼠李糖脂质量浓度为横坐标,吸光度为纵坐标,制作标准曲线。利用和鼠李糖脂标准品相同的调制方法,制备待测样品并测定其吸光度,利用标准曲线计算提取物中的鼠李糖脂质量浓度。
1.2.7 菌株发酵产物的分散作用(排油圈法)
根据文献[27]的方法,在培养皿中加入20 mL蒸馏水和3 mL液体石蜡,待液体石蜡覆盖蒸馏水表面后,加入质量浓度为0.04 g/mL菌株发酵产物水溶液100 μL与相同浓度、相同体积的鼠李糖脂标准品,于室温下测量排油圈的直径。
1.2.8 菌株发酵产物乳化性质的测定
室温下取2支试管,分别加入3 mL液体石蜡,再分别在2个试管中各加入3 mL质量浓度均为0.04 g/mL的菌株发酵产物水溶液与鼠李糖脂标准品水溶液,振荡2 min,静置24 h后,测量试管中乳化层高度 (h1)和液体总高度(h),计算乳化指数E,E=h1/h×100%。
1.2.9 菌株发酵产物表面张力的测定
用去离子水,将菌株发酵产物稀释成质量浓度为40、50、60、70、80、90、100和110 mg/L的水溶液,作为检测样品,进行表面张力的测定(表面张力发生明显转折点的浓度即为临界胶束浓度(CMC)),测试方法为吊环法,于25 ℃测定。
2 结果与分析
2.1 筛选菌株的鉴定与培养条件的优化结果
2.1.1 筛选菌株的形态特征结果
通过初筛与复筛,得到一株排液状石蜡直径较大的菌株,结果见图1。由图1可知:该菌株在LB平板培养基上菌落较小,呈圆球状,边缘规则。该菌株的革兰氏染色结果表明其为革兰氏阴性菌(图2)。

图1 Pseudomonas libanensi PbA单菌落形态Fig.1 Single colony morphology of Pseudomonas libanensi PbA

图2 Pseudomonas libanensis PbA革兰氏染色结果Fig.2 Gram staining results of Pseudomonas libanensis PbA
2.1.2 筛选菌株的种属鉴定结果
利用Genebank中BLAST对菌株的16S rRNA基因序列(1 397 bp,Genebank ID:MH930445)进行同源性比对,选择与该菌株相似性较高的菌株构建系统进化树,发现该菌株与Pseudomonaslibanensis(KT767978)的16S rRNA基因序列相似度达100%,因此,将其命名为PseudomonaslibanensisPbA (图3)。

图3 Pseudomonas libanensis PbA的系统进化树Fig.3 Phylogenetic tree of Pseudomonas libanensis PbA
2.1.3 菌株PseudomonaslibanensisPbA培养条件的优化结果
2.1.3.1 菌株PseudomonaslibanensisPbA温度和pH的优化结果
PseudomonaslibanensisPbA培养温度和pH生长曲线见图4和5。由图4可知:该菌株可生长的温度为16 ~37 ℃,温度升高至42 ℃后,菌株未见增殖。由图5可知:该菌株可生长的pH为6~9。因此,菌株的最适培养条件为温度27 ℃、pH 7。

图4 Pseudomonas libanensis PbA的温度生长曲线Fig.4 Temperature growth curve of Pseudomonas libanensis PbA
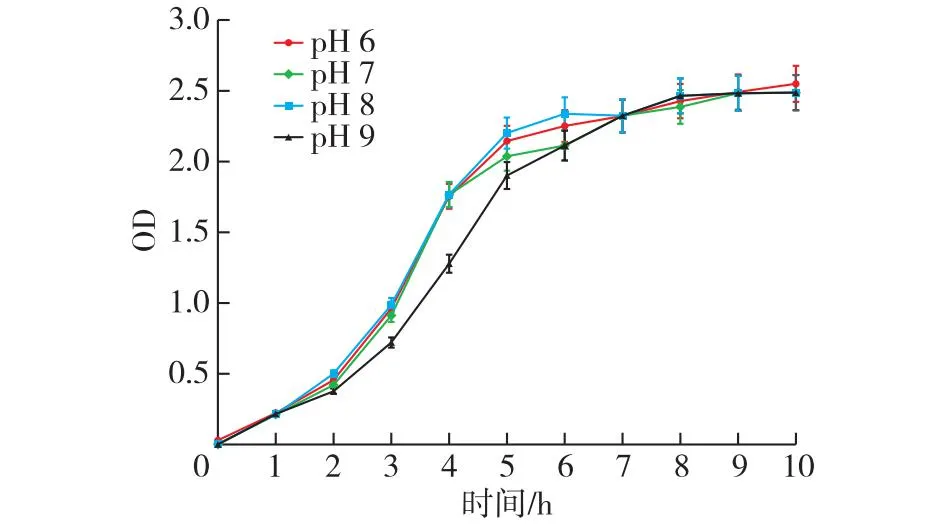
图5 菌株Pseudomonas libanensis PbA的pH生长曲线Fig.5 pH growth curve of strain Pseudomonas libanensis PbA
2.1.3.2 菌株Pseudomonaslibanensis PbA碳源和氮源的优化结果
菌株PseudomonaslibanensisPbA的碳源优化结果见图6。由图6可知:菌株在含有质量分数为1%的蔗糖、葡萄糖、辛酸、果糖、麦芽糖和食用油的无机盐培养基中均可生长,其中葡萄糖为最佳碳源。此时,菌体干质量为0.74 g/L。Soberon-chavez等[28]的研究结果表明:在菌株的生长过程中,不同氮源会影响菌株产表面活性剂的产量,因此,需优化选择该菌株的氮源。实验结果表明:在以葡萄糖为碳源时,菌株PseudomonaslibanensisPbA使用NH4Cl和KNO3生产生物表面活性剂的产量要高于对照组,使用质量分数为1%KNO3为氮源,鼠李糖脂产量可提高14.5% (图7)。

图6 Pseudomonas libanensis PbA的碳源优化Fig.6 Carbon source optimization of Pseudomonas libanensis PbA

图7 Pseudomonas libanensis PbA的氮源优化Fig.7 Nitrogen source optimization of Pseudomonas libanensis PbA
总结以上结果,筛选到一株与Pseudomonaslibanensis16S rRNA基因序列相似度达100%的菌株,将其命名为PseudomonaslibanensisPbA,在27 ℃、 pH 7且含有质量分数为1%葡萄糖和质量分数为1% KNO3的优化培养条件下,表面活性剂产量可达0.54 g/L,比未优化前提高了17%。笔者得到的菌株尽管属于Pseudomonassp.,但还没有生产生物表面活性剂的报道,因此对其提取物进行了进一步的分析。
2.2 菌株发酵产物的初步鉴定结果
2.2.1 菌株发酵产物荷电性能的检测结果
表面活性剂根据其解离能力的不同,可分为阴离子型、阳离子型和非离子型表面活性剂。表面活性剂的荷电性能直接影响其性质及应用领域,使用CTAB培养法鉴定该菌株发酵产物的荷电性能,结果见图8。由图8可知:在CTAB固体平板培养基上,菌落周围形成了深蓝色圈,证明该菌株发酵产物为阴离子型,可用于吸附或沉淀带正电的水污染溶液。

图8 Pseudomonas libanensis PbA的荷电结果Fig.8 Charging results of Pseudomonas libanensis PbA
2.2.2 菌株发酵产物的TLC结果
为了鉴定该菌株产物的分类,利用TLC初步检测了其与鼠李糖脂标准品的相似度,结果见图9。由图9可知:1为菌株发酵产物样品;2为鼠李糖脂标准品,二者均出现了一个明显的棕色斑点,且出现位置相同,证明该菌株发酵产物组分单一,因此,初步判定其为糖脂类物质。

图9 菌株发酵产物的TLC结果 Fig.9 TLC results of product
2.2.3 菌株发酵产物的糖含量测定结果
将菌株的发酵产物稀释50倍,鼠李糖脂标准品稀释100倍后,分别测得490 nm的吸光度为0.14、 0.101。根据鼠李糖脂标准曲线的线性回归方程Y=2.942 6X+0.000 3,计算得发酵产物及鼠李糖脂标准品中糖含量分别为2.34、3.37 g/L(图10)。糖含量的测定结果不同,可能因为该产物亲水端含有不同于标准品的鼠李糖脂结构。
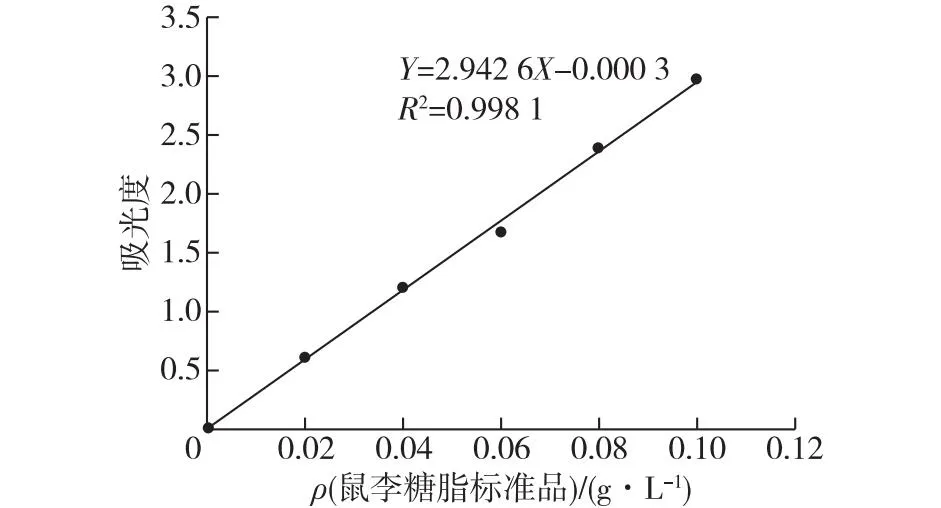
图10 鼠李糖脂的标准曲线Fig.10 Standard curve of rhamnose
基于以上分析,初步鉴定该菌株产物为糖脂类表面活性剂。糖脂类表面活性剂的亲水端和疏水端结构复杂,亲水端可能是单糖、双糖或多糖的混合物;疏水端可能是饱和或不饱和脂肪酸以及带羟基的脂肪酸等。因此,鉴定其亲水端和疏水端的化学结构需要借助进一步的仪器分析。
2.3 菌株发酵产物的性质测试结果
2.3.1 菌株发酵产物的分散性能测试结果
分散与乳化性能是衡量表面活性剂的重要指标。因此,利用排油圈法测定了菌株发酵产物的分散性能。以没有任何添加的水溶液作为阴性对照,结果见图11。由图11可知:菌株发酵产物和鼠李糖脂标准品的添加质量浓度为0.04 mg/mL时,排油圈直径分别为5.6和3.7 cm,表明提取物比鼠李糖脂标准品具有更好的分散性能。

图11 菌株发酵产物的排油圈结果Fig.11 Results of oil drain ring of extracting surfactant
2.3.2 菌株发酵产物的乳化性能结果
利用液体石蜡对表面活性剂的乳化性能结果见图12。由图12可知:当发酵产物质量浓度为0.04 mg/mL时,其乳化指数为60.3%,与同浓度鼠李糖脂标准品的乳化指数(62.1%)差别不大,该结果表明,筛选菌株提取的发酵产物的棕黄色膏状物具有良好的乳化性质。

注:a为鼠李糖脂标准品,b为菌株发酵产物图12 菌株发酵产物的乳化性质Fig.12 Emulsion property of extracting surfactant
2.3.3 菌株发酵产物表面张力和临界胶束浓度的测定结果
为了进一步分析菌株发酵产物作为表面活性剂的特性,测定了其表面张力,并计算了其临界胶束浓度(图13)。由图13可知:随着菌株发酵产物质量浓度从0.4 g/L增加至大于1.1 g/L,溶液的表面张力从65.3 mN/m降低到54.1 mN/m,之后逐渐变得平稳。曲线变化趋势的拐点代表表面活性剂的CMC,为106 mg/L。其临界胶束浓度远小于化学表面活性剂十二烷基硫酸钠(SDS),而与非离子表面活性剂吐温相差不大。

图13 菌株发酵产物的表面张力Fig.13 Surface tension of extracted surfactant
基于以上分析,菌株发酵产物的分散性能优于鼠李糖脂标准品,乳化活性与鼠李糖脂标准品相当,其表面张力可降低至54.1 mN/m。朱湧[29]的研究结果表明:鼠李糖脂的表面张力通常为30 mN/m左右。两者间的显著差异说明该菌株发酵产物可能是一种具有新型结构的生物表面活性剂,将在以后的研究中进一步分析其化学结构。
3 结论
通过富集、分离筛选,从污水厂底泥中筛选到一株能够产表面活性剂的菌株,经形态学观察和分子生物学检测,鉴定为假单胞菌属,命名为PseudomonaslibanensisPbA。在27 ℃、 pH 7和质量分数为1%葡萄糖作为碳源的条件下,添加质量分数为1% KNO3,获得发酵产物为0.54 g/L。该菌株的发酵产物可能为糖脂类阴离子表面活性剂,在质量浓度为0.04 mg/mL时,排油圈直径为5.6 cm,优于鼠李糖脂标准品,乳化指数为60.3%,与标准品类似。随着质量浓度的增加,产物的表面张力从65.3 mN/m (质量浓度为0.4 g/L时) 减小至54.1 mN/m(大于质量浓度106 mg/L时);其临界胶束浓度为106 mg/L,与通常鼠李糖脂的表面张力降低至30 mN/m左右相比,差别较大,后续将对产物继续进行深入研究,包括成分的鉴定和化学结构的分析,并探寻此差别的原因。本研究为丰富生物表面活性剂生产菌,开发发酵生产流程及表面活性剂的应用提供了基础数据。
