原发性IgA肾病伴弥漫性新月体形成的临床特点及预后分析
2024-01-25林英英李贵森
文 珊,张 萍,林英英,王 蔚 ,李贵森
(1.西南医科大学附属医院肾脏内科,四川 泸州 646000;2.四川省医学科学院·四川省人民医院肾脏内科,四川 成都 610072)
IgA肾病( immunoglobulin A nephropathy,IgAN)是全世界范围内最常见的原发性肾小球疾病[1],是进展至终末期肾脏病 (end-stage kidney disease,ESKD) 的主要原因之一[2]。IgA肾病的病理特征以肾小球系膜区IgA或IgA沉积为主[3]。IgAN患者的临床表现有很大的异质性,从无症状的血尿或蛋白尿、高血压到急进性肾小球肾炎[3]。其病理特征也存在很大差异,可以表现为轻度系膜细胞增生到不同程度的毛细血管外增生性病变、新月体等[3]。IgA肾病的新月体形成具有广泛的毛细血管外增生的组织学特征,预后不良的风险更高[4]。本课题组前期研究发现,高达48%的IgAN患者可出现不同程度的新月体形成[4]。部分IgA肾病患者临床表现为肾功能快速进行性恶化,在短时间内进展至肾功能衰竭,病理活检发现超过50%的肾小球囊腔内有新月体形成,因此诊断为弥漫性新月体IgA肾病(diffuse crescentic IgA nephropathy,CIgAN)[5,6]。即使强化免疫抑制治疗,即激素联合环磷酰胺治疗,患者预后仍然不良,近70%的患者在5年内进展至ESKD[7,8]。CIgAN在IgAN中较为罕见,发病率低,文献少有报告[5,7,9]。本研究首次在中国西部大样本人群中报道CIgAN的临床表现、病理特征及预后,为临床治疗及预后评估提供新的依据。
1 资料与方法
1.1 一般资料本研究为弥漫性新月体IgA肾病患者的单中心回顾性研究。选择2007年7月至2022年7月在四川省人民医院肾脏内科确诊的原发性IgAN且超过50%的肾小球有新月体形成的33例患者。入选标准:①病理组织活检符合IgA肾病的诊断标准;②取样肾组织中肾小球数≥8个;③超过50%的肾小球有新月体形成[5,6]。排除标准:①肾活检确诊年龄小于14岁;②继发性IgA肾病,如过敏性紫癜、系统性红斑狼疮或肝硬化等。本研究已获得所有参与者的知情同意,本研究经四川省医学科学院·四川省人民医院伦理委员会批准。
1.2 方法
1.2.1临床基线资料 ①人口学资料:包括患者性别、年龄、体重指数(BMI)等;②临床资料:肾活检时血压并根据收缩压/舒张压计算平均动脉压(MAP),血清肌酐(Cr),尿酸(UA),eGFR,尿素氮(BUN),血清白蛋白(Alb),血红蛋白(Hb),中性粒细胞/淋巴细胞比(NLR),血小板/淋巴细胞比(PLR),总胆固醇(TC),甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL),肉眼血尿,尿隐血,水肿,血浆免疫球蛋白IgG、IgA、IgM,血浆补体C3、C4,C反应蛋白( CRP),24 h尿蛋白定量,以及从发病到肾活检的持续时间,首发症状,肾外表现,住院期间是否接受透析治疗;③病理资料:包括IgG、IgA、IgM、C3、C1q、FRA沉积水平,以及球性硬化、肾小管萎缩/间质纤维化、间质炎症细胞浸润、新月体类型等。其中系膜细胞增多症、毛细血管内细胞增多症、节段性硬化症、间质纤维化/肾小管萎缩采用MEST牛津分型[10]。
1.2.2随访资料 ①患者随访时间,血清Cr,24 h尿蛋白定量,应用血管紧张素转化酶抑制剂(ACEI)或血管紧张素受体阻断剂(ARB)、糖皮质激素及免疫抑制剂治疗情况等。其中免疫抑制剂包括糖皮质激素(GC)、环磷酰胺(CTX)、吗替麦考酚酯(MMF)、来氟米特(LEF)等。②结局事件:主要终点为患者进入ESKD或eGFR较基线下降≥50%。ESKD定义为eGFR<15 ml/(min·1.73m2)或开始肾脏替代治疗或肾脏移植[11]。
1.3 统计学方法数据分析采用SPSS 17.0软件。符合正态分布的计量资料用均数±标准差表示,使用Shapiro-Wilk检验进行分析;不符合正态分布的计量资料则用M(P25,P75)表示;定性资料采用频数(频率)表示。肾脏累积生存率用Kaplan-Meier曲线表示。利用受试者工作特征曲线(receiver operating charateristic,ROC)对肾活检时Scr对弥漫性新月体IgA肾病预后预测的诊断效能进行了分析。计算曲线下面积(area under curve,AUC)。
2 结果
2.1 临床特征
2.1.1病因学、人口统计学和肾脏表现 在本中心2007年7月至2022年7月期间,2067例IgAN患者中有33例诊断为CIgAN,占1.6%。其中,男18例(55%),女15例(45%),肾活检时年龄36(21.5,51)岁。有11例患者(33.3%)体重超重(BMI≥24 kg/m2)。从出现症状到肾活检的时间间隔为1.7(0.9,3.2)月。13例患者(39.4%)出现肉眼血尿,18例患者(54.5%)有高血压病史,大多数患者(84.8%)有不同程度的水肿。26例患者(78.8%)血清肌酐升高,血清肌酐为152.7(91.85,271)μmol/L。eGFR(按CKD-EPI公式计算)为42.6(22.5,87.9) ml/(min·1.73m2),21例患者(63.6%)就诊时eGFR下降(<60 ml/(min·1.73m2)。所有患者就诊时尿隐血呈阳性。尿蛋白排泄量为3.7(2.7,8.8)g/d,其中,19例患者(57.6%)出现肾病范围蛋白尿(>3.5 g/d)。
2.1.2首发症状 25例患者表现为双下肢和(或)颜面部水肿,2例患者表现为肉眼血尿,2例患者表现为泡沫尿,1例患者表现为夜尿增多。
2.1.3肾外表现 13例患者有前驱呼吸道感染,8例患者与胃肠道症状有关,1例患者同时合并上呼吸道感染和胃肠道症状,1例患者日晒后出现面部红斑,1例患者出现膝关节疼痛。
2.1.4实验室检查特征 5例患者(15.2%)C3水平较低;29例患者血清C4水平正常,4例患者略有升高。全部患者抗中性粒细胞胞浆抗体呈阴性。血清白蛋白17.7~43.9 g/L[(28.7±6.5)g/L],其中有25例患者(75.8%)血清白蛋白<35 g/L。C反应蛋白水平为2.3(1.0,7.0)g/L。血尿酸水平为(381.9±112.9) μmol/L,有15例患者(45.5%)血尿酸>420 μmol/L。血红蛋白为(116.9±21) g/L,4例患者血红蛋白<90 g/L。NLR为3.20(2.13,4.96),PLR为136.96(88.72,178.46),血清IgA为2.15(1.70,2.86)g/L,BUN为9.46(4.55,15.5) mmol/L。
2.2 病理学特征
2.2.1光学显微镜 肾活检时,平均新月体的百分比为62.5%(54.2%,66.7%),以细胞纤维性新月体为主(平均百分比为26%±17%),其次是细胞性新月体20%(12%,42%)和纤维性新月体5%(0,21%)。22例(66.7%)活检标本显示弥漫性系膜细胞增生。节段性系膜细胞增生的程度从无或轻度(n=17)到中度(n=11)到重度(n=5)。间质炎症细胞以轻度(n=24)浸润为主,而中度(n=4)和重度(n=5)浸润较少。病理表现为M1、E1、S1和T1/2的患者分别有22例(66.7%)、13例(39.4%)、11例(33.3%)和7例(21.3%)。
2.2.2免疫荧光 所有肾小球(n=33)的初始活检标本均显示IgA、C3沉积。免疫荧光沉积物有四种亚类模式:IgA、IgA+IgG、IgA+IgM和IgA+IgG+IgM,本研究中,IgA+IgM的模式(66.7%)更常见,而IgA +IgG的模式(6.1%)罕见。7个活检标本(21.2%)显示C1q染色。见图1。
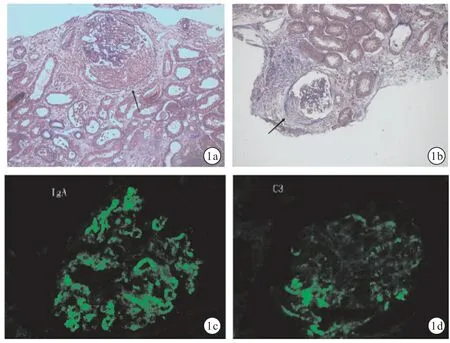
图1 肾病理组织学显示肾小球具有不同类型的新月体 a:细胞性新月体(PAS,×200);b:细胞纤维性新月体(PAS,×200);c:免疫荧光显示IgA沉积(×400);d:免疫荧光显示C3沉积(×400)
2.3 治疗共有32例患者(97%)接受了免疫抑制剂治疗,其中23例患者(69.7%)接受糖皮质激素+环磷酰胺治疗,3例患者(9.1%)接受糖皮质激素+吗替麦考酚酯/来氟米特,6例患者(18.2%)单用糖皮质激素治疗。就诊时,2例患者(6.1%)需要依赖血液透析治疗。有10例患者(30.3%)接受了ACEI或ARB药物治疗。
2.4 随访及预后共有22例CIgAN患者(66.7%)随访时间>6个月,随访时间为24.6(8.3,71.7)个月,10例(45.5%)患者达到复合肾脏结局,其中8例(36.4%)进展至ESKD(3例在6个月内发生,5例在6个月后发生),2例(9.1%)eGFR下降≥50%(2例均在6月后发生)。第一年、第三年和第五年的累积肾脏存活率分别为(81.0%±8.6%)、(64.3%±11.0%)、(57.9%±11.6%)。见图2。所有进入随访队列的患者均接受了激素加免疫抑制剂治疗,16例患者接受积极免疫抑制治疗(定义为大剂量甲基强的松龙静脉冲击+环磷酰胺治疗)[10]的患者中,有6例患者(37.5%)进展至复合肾脏结局;在6例未接受积极免疫抑制治疗(单用激素/激素+其它免疫抑制剂)的患者中,有4例患者(66.7%)进展至复合肾脏结局。
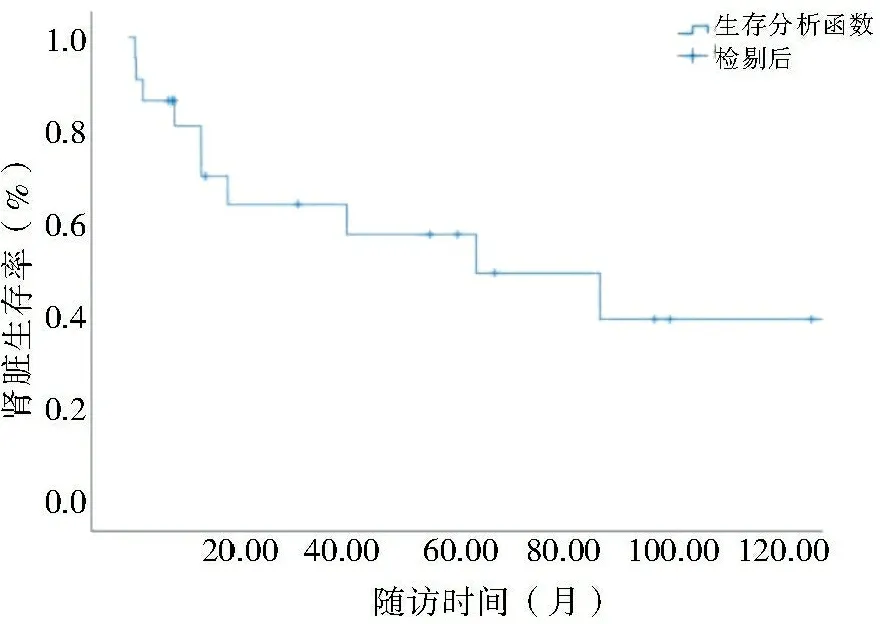
图2 弥漫性新月体IgA肾病患者的肾脏生存率
2.5 弥漫性新月体IgA肾病疾病进展和预后COX回归分析多因素Cox回归模型结果显示,Scr(HR=1.008,95%CI:1.001~1.015,P=0.036)是CIgAN患者发生复合肾脏结局的独立危险因素。而新月体的比例并不影响患者预后(HR=1.007,95%CI:0.946~1.073,P=0.822)。见表1。

表1 多因素Cox回归分析影响弥漫性新月体IgA肾病患者肾脏不良结局的因素
2.6 ROC曲线评估Scr对CIgAN患者的预后预测价值约登指数以确定CIgAN患者出现复合肾脏结局的Scr的最佳临界值。AUC为0.783(P=0.025,95%CI 0.591~0.976)。Scr的临界值为149μmol/L(特异性为75%,灵敏度为70%),即Scr大于149μmol/L的CIgAN患者预后较差。见图3。

图3 肾活检时Scr 预测患者发生复合肾脏结局的ROC曲线
3 讨论
CIgAN在临床上是一种罕见疾病,预后较差,往往在短时间内进展至肾功能衰竭。目前国内外关于CIgAN的研究较少,其临床表现、病理特征及预后尚不完全清楚。本文首次报道了中国西部地区2007年7月至2022年7月共2067例原发性IgA肾病患者中33例CIgAN的详细临床病理特征,其中22例患者纳入随访队列研究。研究结果发现CIgAN预后较差,46%的患者在5年内发展至复合肾脏结局; Scr浓度是CIgAN患者发生复合肾脏结局的独立危险因素,而新月体的百分比与复合肾脏结局的发生没有独立相关性,CIgAN患者预后不良,尤其是肾活检时Scr浓度大于149 μmol/L的CIgAN患者。
IgAN病理活检常发现有新月体形成,本课题组前期研究发现,四川1242例IgAN中595例(47.9%)患者肾组织中至少有一个新月体形成[4]。当超过50%的肾小球内有新月体形成时,则称为CIgAN[5]。Tang等[5]已经报道CIgAN占IgAN的1.14%,占弥漫性新月体肾炎的16.4%。日本[9]一项研究报道在515例儿童IgAN患者中,有25例患者(4.9%)患有新月体型IgAN。我中心研究发现,在2067例原发性IgAN患者中,CIgAN患者有33例,占1.6%。造成上述发生率的不同,可能与地域差异有关。此外,与既往报道类似[5,6],CIgAN患者以中青年男性多见。
在本研究队列中,我们发现有76%的患者首发症状表现为双下肢水肿和(或)颜面部水肿,超过一半的患者临床表现为AKI,高于Shima[9]的报道(24%),在长期随访中,AKI不是CIgAN发生复合肾脏结局的危险因素,表明AKI在我们研究队列中是可逆的,这与Shima[9]的报道类似。众所周知,IgA肾病患者常出现肉眼血尿,Shima[9]报道CIgAN患者肉眼血尿的发作比例显著高于非CIgAN患者,Tang等[5]报道90%的患者在发生肉眼血尿后1个月内进行了肾活检,本研究所有患者尿隐血均阳性,平均尿红细胞648(298,3316)个/μl,这些数据提示血尿的发生可能与新月体的形成有关。既往研究[5,7,9]显示CIgAN患者与非CIgAN患者相比,高血压患病率与24 h尿蛋白排泄量较高。Tang等[5]报道25例患者就诊时有16例患者(64%)患有高血压,所有患者都有明显的蛋白尿,其中48%的患者有肾病范围蛋白尿(大于3.5g/d)。印度学者[6]报道52例CIgAN患者就诊时的平均尿蛋白排泄量为(4.2±2.7)g/24h,高血压患病率为87%。本研究33例患者,患者从发病到肾活检的时间短(平均1.7(0.9,3.2)月),平均尿蛋白排泄量为3.68(2.67,8.81)g/24 h,有97%的患者尿蛋白大于1g/d,58%的患者出现肾病范围尿蛋白(大于3.5 g/d),发现肾病范围蛋白尿与患者预后没有关系;此外,本研究队列有55%的患者就诊时有高血压病史,COX比例风险回归模型显示平均动脉血压是发生复合肾脏结局的危险因素,但不是独立危险因素。关于CIgAN的肾外表现,尚无研究详细报道,本研究队列该病肾外表现包括呼吸道感染、胃肠道症状、皮疹、日晒后出现面部红斑、膝关节疼痛等。其中,有46%的患者在就诊前或就诊时出现呼吸道感染症状,提示呼吸道感染可能与该病的发生发展有关。
在本研究中,平均新月体百分比为63%,其中细胞纤维性新月体占比最大(26%),其次是细胞性新月体(20%)和纤维性新月体(5%),这与既往研究类似[6,7]。最近印度[6]报道CIgAN与少免疫性新月体肾炎相比,细胞性新月体比例较低,肾小球硬化和肾小管萎缩程度较高,Tang等[5]研究显示25例患者平均球性硬化百分比为(25.6±23.3)%,来自Lv等[7]大型多中心队列研究(n=113例)显示,7.9%的患者肾活检时存在球性硬化,58%的患者有重度肾小管萎缩和间质纤维化,在本研究中,42%的患者存在球性硬化,21%的患者有中重度肾小管萎缩和间质纤维化,这些研究结果显示,相对较高的慢性化病变可能是CIgAN患者远期肾存活率低的原因。此外,本研究队列患者免疫荧光沉积物观察到四种亚类模式,IgA+IgM沉积模式高于仅IgA沉积的模式。
本研究发现46%的患者达到了复合肾脏结局,其中36%的患者进展至ESKD,来自国内Tang等[5]的一项回顾性研究对25例CIgAN患者进行分析,其中15例患者接受了6个月以上的随访且均接受强化免疫抑制治疗(甲基强的松龙冲击和/或静脉注射环磷酰胺),33.3%的患者进展至ESKD。来自Ramachandran等[12]的一项队列研究,共18例新月体IgAN患者,研究显示,环磷酰胺联合类固醇治疗仅在极少数患者中有效,患者12个月ESKD发生率为77.7%。Lv等[7]的一项多中心队列研究包括113例新月体IgAN,所有患者均接受大于12个月的随访,其中接受了强化免疫抑制治疗的43例患者的5年生存率仅为28%。这些队列研究结果提示,CIgAN患者预后较差。本研究有22例患者进入随访队列,8例(36%)进展至ESKD,近一半的患者在5年内发展至复合肾脏结局。多因素COX比例风险回归模型显示,肾活检时Scr浓度是患者发生复合肾脏结局的独立危险因素,而新月体比例不是该部分患者不良预后的独立危险因素。相对而言,Scr浓度更能反应肾脏的损伤情况,与患者预后更为相关。
本研究通过绘制ROC曲线发现,对于肾活检时Scr浓度大于149 μmol/L的患者(特异性为75%,灵敏度为70%),即使接受了免疫抑制剂治疗,患者发生复合肾脏结局的风险仍然较高,查阅文献,目前无相关报道。KDIGO指南[8]推荐新月体IgAN参照ANCA相关性血管炎的治疗方案,即激素联合环磷酰胺治疗。在Lv等[7]的多中心队列研究中,接受大剂量甲基强的松龙(7~15 mg/kg/天)加环磷酰胺冲击治疗的患者第一年肾脏生存率高于未接受该治疗方案的患者。在本研究中,接受激素加环磷酰胺治疗的患者中有38%的患者发生复合肾脏结局,而未接受该治疗方案的患者中有67%的患者发生复合肾脏结局,此研究结果虽无法评估激素联合环磷酰胺治疗对CIgAN患者肾脏的影响,但可以说明强化免疫抑制治疗有降低该病患者发生复合肾脏结局风险的趋势。为改善CIgAN患者的不良预后,近年来,国内外学者对该部分患者的治疗进行了积极探索,一方面,既往小样本研究[13]报道血浆置换治疗可以延迟CIgAN疾病进展,然而,来自我国王梓等[11]的一项多中心回顾性研究发现,血浆置换并没有降低新月体型IgAN ESKD及死亡的发生率。另一方面,有越来越多的证据表明补体过度激活与IgAN的发病机制有关,尤其是在新月体型IgA肾病中[14],因此,未来的研究应评估补体阻断治疗对免疫抑制剂耐受的新月体型IgAN患者的疗效。Daisuke等[15]报道称补体因子5抑制剂依库珠单抗可有效治疗1例非典型溶血尿毒综合征和新月体IgA肾病并存的42岁男性患者(该患者对大剂量激素、血浆置换和血液透析治疗效果不佳)。
本研究存在一定的局限性:一方面,由于是单中心的回顾性研究,存在选择偏差;另一方面,由于弥漫性新月体IgA肾病发病率较低,患者的数量(33例)并不多,未来需要更多的研究对该病进行探索。
综上所述,弥漫性新月体IgA肾病患者预后不良,46%的患者在5年内发展至复合肾脏结局,呼吸道感染是该病的主要诱因。肾活检时Scr浓度是发生复合肾脏结局的独立危险因素,而新月体的百分比与复合肾脏结局的发生无关。对于肾活检时Scr浓度大于149 μmol/L的弥漫性新月体IgA肾病患者,即使接受了免疫抑制剂治疗,患者预后不良的风险仍然较高,需要替代治疗来减少该部分患者不良事件的发生。
