体外膜肺氧合辅助肺移植术治疗对终末期肺病患者预后的影响及相关因素分析
2024-01-24高改青朱金霞王慧敏
高改青,王 鑫,朱金霞,王慧敏
(郑州大学第一附属医院,河南 郑州 450000)
终末期肺病主要通过肺移植手术进行治疗,其中围手术期患者的体外肺辅助装置和相关措施是手术成功的关键[1]。体外膜肺氧合(ECMO)是临床上呼吸、循环支持的主要方式之一,目前已经有超过40年的历史,其在术前、术中、术后的心肺支持应用已逐渐成熟,术前,ECMO在术前可作为肺移植的过渡手段,术中可辅助血液流动和促进气体交换,术后通过提供氧合支持保护植肺功能,在肺移植手术安全性和移植受者的预后方面发挥着重要作用[2,3]。静脉-静脉(V-V)转流和静脉-动脉(V-A)转流是ECMO辅助肺移植常见的两种转流方式,但临床上关于转流方式的选择并无明显指征,多由医生根据患者肺通气和氧合状况综合考虑选择,关于两种转流方式的临床应用效果及对预约后的影响尚缺乏确切报道[4,5]。基于此,本研究拟通过分析我院ECMO辅助肺移植术治疗的终末期肺病患者资料,探讨不同转流方式下患者的预后情况,分析预后相关影响因素。
1 资料与方法
1.1 一般资料2020年4月至2022年6月我院收治的87例ECMO辅助肺移植术治疗的终末期肺病患者。纳入标准:①符合临床诊断标准[6];②年龄>18岁。排除标准:①存在原发性动脉高压史或无肺动脉高压;②存在其他器官移植史或多器官联合移植史者;③未使用ECMO或术前已使用ECMO;④术中或术后更换ECMO转流方式者;⑤ECMO撤出后再次使用者。本研究涉及的肺移植术均通过医院器官移植伦理委员会批准,供肺获取和手术流程符合中国肺移植术操作规范(2019版)[7]。87例患者中男62例,女25例,年龄32~61岁[(46.76±6.53)岁],有吸烟史者38例,合并高血压18例,糖尿病13例;原发病:特发性肺纤维化61例,慢性阻塞性肺疾病5例,支气管扩张9例,尘肺12例;NYHA心功能分级Ⅰ级25例,Ⅱ级47例,Ⅲ级15例。根据转流方式不同分为VA-ECMO组44例和VV-ECMO组43例,两组性别、年龄等资料比较差异无统计学意义(P>0.05),VA-ECMO组平均肺动脉压及重度动脉压占比高于VV-ECMO组(P<0.05)。见表1。
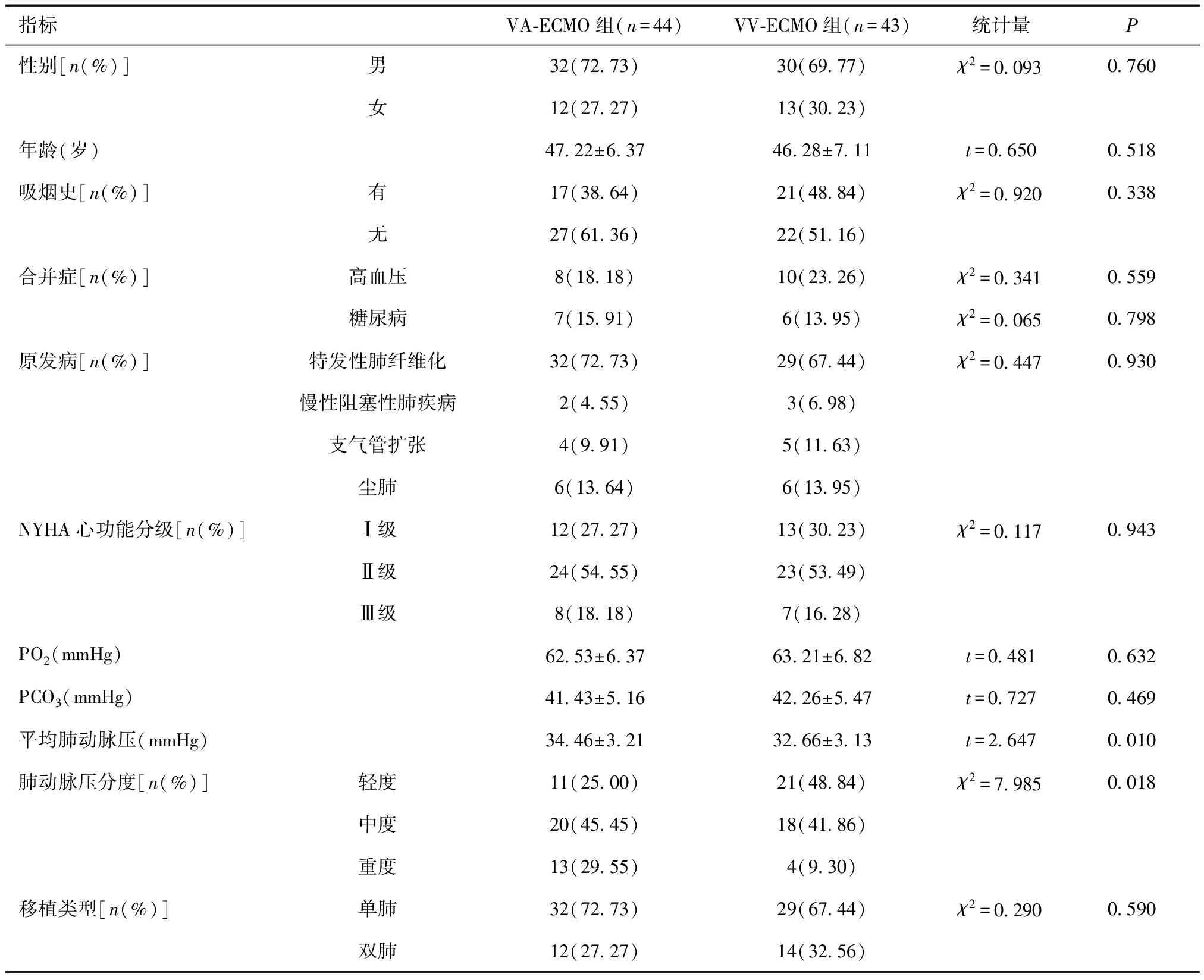
表1 两组基线资料比较
1.2 方法ECMO辅助肺移植术:所有患者均进行肺移植术治疗并给予术中ECMO辅助治疗,患者麻醉完成后放置Swan-Ganz导管、双腔气管导管,测定即时肺动脉压、动脉血氧饱和度,而后完成肺移植手术。术中ECMO辅助治疗参照临床指南[8]制定的说明进行操作,ECMO流转方式根据单肺通气时的氧合和心功能确定,V-V转流适应证:高碳酸血症、低氧血症、轻微肺动脉压者;V-A转流适应证:中重度肺动脉高压、心功能不全或存在心力衰竭风险者。V-A转流采用右侧股动脉插管,V-V转流采用股静脉、颈内静脉置管。ECMO流转期间维持激活凝血时间在160~200 s,流速为1.5~3.0 L/min,手术结束后将ECMO流量降至1 L/(min·m2)以下,若血流动力学平稳,氧合指数>300,可撤除ECMO,反之则维持使用ECMO。
1.3 观察指标①VA-ECMO组和VV-ECMO组手术时间、ECMO流转时间、输血量、尿量等指标;②VA-ECMO组和VV-ECMO组患者术后原发性移植物功能障碍(PGD)、术后72 h内休克、再次气管插管或气管切开等并发症发生情况及术后6个月生存情况;③分析影响行肺移植术治疗的终末期肺病患者预后的危险因素。
1.4 统计学方法采用SPSS 25.0统计学软件处理数据。计数资料以例数(%)表示,组间比较采用卡方检验;计量资料以均数±标准差表示,组间比较采用t检验;影响因素分析采用Logistic多因素回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组术中相关指标比较VA-ECMO组手术时间长于VV-ECMO组,ECMO流转时间低于VV-ECMO组(P<0.05),两组输血量与尿量比较,差异无统计学意义(P>0.05)。见表2。

表2 两组术中相关指标比较
2.2 两组术后并发症及短期预后比较两组术后PGD率、术后72 h内休克率、再次气管插管或气管切开率、术后6个月生存率比较,差异无统计学意义(P>0.05)。见表3。

表3 两组术后并发症及短期预后比较[n(%)]
2.3 影响终末期肺病患者预后的危险因素分析肺动脉压、ECMO转流时间、术后PGD、再次气管插管或气管切开是影响终末期肺病患者预后的危险因素(P<0.05)。见表4。

表4 影响终末期肺病患者预后的危险因素分析
3 讨论
终末期肺病移植术受者身体机能通常较差,术中若呼吸循环不稳定则可能影响移植效果,严重者可危及生命,因此,术中介入心肺辅助技术治疗十分必要[9]。ECMO为临床危重症患者术中心肺辅助治疗的重要手段之一,具有肝素用量小、出血量低、全身性炎症反应小等特点。临床上ECMO转流辅助心肺功能的临床适应证如下:①麻醉后单肺通气时氧合指数较低,通过改善通气血流比后仍不能改善;②阻断一侧肺动脉后肺动脉压升高,右心室负荷增加,通过肺动脉扩张、血管活性药物调整后通气循环仍不稳定或有心力衰竭的趋势;③移植肺温和完成后,由肺内缺氧、灌注液流入等引起的呼吸循环不稳定;④移植肺恢复关注后因水肿、炎症等原因氧合指数降低[10,11]。随着ECMO临床应用的普及和在不同疾病中使用效果的改善,其应用效果也得到广泛认可。
作为一种体外生命支持手段,ECMO不同的转流方式可呈现出不同的临床应用效果。临床上常见的转流方式有V-A转流、V-V转流,V-A转流常选用股静动脉插管方式,通过引流大部分回心血量,降低心室前负荷,进而使左心室前负荷降低,可辅助支持呼吸和循环功能,采用V-A转流在为患者提供呼吸支持的同时还可实现右心减压和体循环灌注辅助,为患者心肺功能恢复争取时间,临床上多用于重症患者的体外辅助治疗,但临床上V-A转流操作较为复杂,整体耗时较长,且存在心肌耗氧量和心室负荷增加的风险[12]。V-V转流通常采用双侧股静脉、股静脉或颈静脉穿刺,主要为全身各器官提供呼吸辅助支持,但对心脏负荷的降低效果有限,以经皮穿刺技术为基础的V-V置管操作简单,可为全身各器官供氧并保持氧耗平衡[13]。在临床工作中,低氧血症、高碳酸血症者优先采用V-V转流,而中、重度肺动脉高压患者选用V-A转流,部分患者无明显的转流方式指征,若存在肺动脉高压或心功能不全,考虑到肺切除或肺移植过程中氧合指数下降,心负荷增加,则优先选用V-A转流以避免增加血流动力学紊乱和心力衰竭风险[14]。本研究结果显示,VA-ECMO组手术时间显著高于VV-ECMO组,术中ECMO流转时间显著低于VV-ECMO组,说明V-A转流操作更为复杂,因而耗时较长,而V-V转流对心脏负荷的减缓作用有限,因此转流时间较长。研究发现,转流时间延长可加大肺移植患者死亡风险[15]。术后短期预后方面,两组术后PGD率、术后72 h内休克、再次气管插管或气管切及6个月内生存率比较均无显著性差异。提示两种转流方式对患者预后影响差异较小,其可能是由于ECMO流转时间不同而引起的预后差异。多因素Logistic回归分析显示,肺动脉压、ECMO转流时间、术后PGD、再次气管插管或气管切开均是影响终末期肺病患者预后的危险因素,提示临床上可通过肺动脉压测定预测不良预后风险,并积极把控术中规范操作,降低ECMO转流时间,以减少PGD及气管再次插管或切开发生率,降低不良预后发生风险。
综上,ECMO辅助肺移植术治疗终末期肺病采用V-A转流和V-V转流患者短期预后比较无显著性差异,而肺动脉压、ECMO转流时间、术后PGD、再次气管插管或气管切开是影响终末期肺病患者预后的危险因素。
