复合益生菌发酵玉米-豆粕型日粮对哺乳期羔羊瘤胃发酵参数及菌群结构的影响
2024-01-24王圆圆朱会霞丁亚伟钱周泽郭云霞孙金旭郝庆红
■ 王圆圆 李 月* 朱会霞 丁亚伟 钱周泽 张 昇 郭云霞 孙金旭** 郝庆红**
(1.河北农业大学生命科学学院,河北保定 071001;2.河北省湿地保护与绿色发展协同创新中心,河北衡水 053000;3.围场满族蒙古族自治县农业农村局,河北承德 068451)
反刍动物瘤胃是一个庞大的发酵罐,其含有丰富的细菌、真菌和原虫等微生物,能够高效分解饲料,因此,调控瘤胃发酵对反刍动物生长和生产具有重要意义[1]。影响瘤胃发酵的因素有很多,其中饲料是一个尤为重要的因素。发酵饲料是粗饲料经过微生物发酵制成的饲料,粗饲料中富含纤维素和木质素等,难以被动物直接消化吸收。发酵可以使粗饲料原料营养成分发生转化,增强动物的消化吸收。大量研究表明,微生态制剂可以产生如活性肽、多糖、有机酸等活性物质,这类物质能增强机体的免疫功能[2],提高抗氧化功能[3-4],改善动物的肠道微生态平衡[5-6],同时可以提高动物的采食量以及饲料利用率[7]。微生物发酵饲料目前作为一种高效的替代抗生素产品[8],研究多集中在单一饲料原料进行发酵后等比例替代配方中玉米或豆粕;对于复合菌种选择及最佳比例的规定不统一;发酵饲料在单胃动物中已广泛使用,但在幼龄反刍动物上报道较少,尤其是在哺乳期羔羊上未见报道。基于此,本试验以玉米、豆粕、麸皮为发酵底物,以筛选的产蛋白酶和淀粉酶的益生菌菌株乳酸杆菌RSG-1(Lactic bcillus,CGMCC22061)、地衣芽孢杆菌Y5-39(Bacillus licheniformis,CGMCC22062)和枯草芽孢杆菌B-1(Bacillus subtilis,CGMCC22064)为发酵菌种制备发酵饲料,通过对复合益生菌发酵饲料的品质进行综合评价,并进行哺乳羔羊饲喂试验,探讨其羔羊瘤胃微生物菌群数量、瘤胃液发酵参数和多样性的影响,以期为复合益生菌发酵饲料在羔羊生产中的应用提供理论依据和技术支撑。
1 材料与方法
1.1 发酵饲料制备
玉米∶豆粕∶麸皮=6∶2.5∶1.5 底物,其中对照组不做处理,发酵组用复合益生菌(乳酸杆菌RSG-1∶枯草芽孢杆菌B-1∶地衣芽孢杆菌Y5-39=1∶1∶4)接种,接种量10%,含水量45%,青贮袋25 kg,扎带扎好后,室温30 ℃静置发酵14 d。发酵饲料组成及营养水平见表1。要确保发酵饲料的最佳饲用效果,做好密封并及时利用,开封后发酵饲料在室温下可以储存14 d,未开封的发酵饲料可储存1 个月。在试验期间共发酵3 批次饲料,并对每批次发酵饲料进行检测,保证测定结果一致。
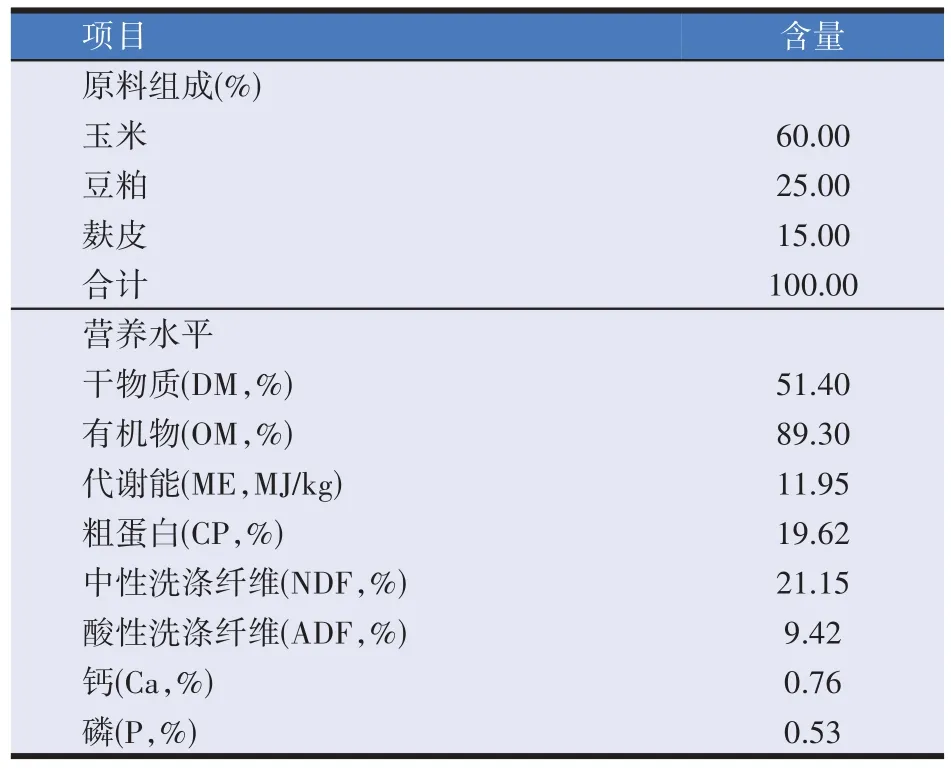
表1 发酵饲料组成及营养水平(风干基础)
1.2 试验设计与日粮组成
选择15 日龄、体重为(6.80±0.30) kg 的健康随母哺乳的湖羊羔羊48 只(公母各1/2),随机分4 组,每组12 只,对照组及试验Ⅰ、Ⅱ、Ⅲ组分别饲喂含有0(对照)、5%(FF1)、10%(FF2)、15%(FF3)发酵饲料的羔羊料。羔羊试验饲粮组成及营养水平见表2。预试期5 d,正试期47 d。于试验结束当天利用羊瘤胃专用采集管采集瘤胃液。
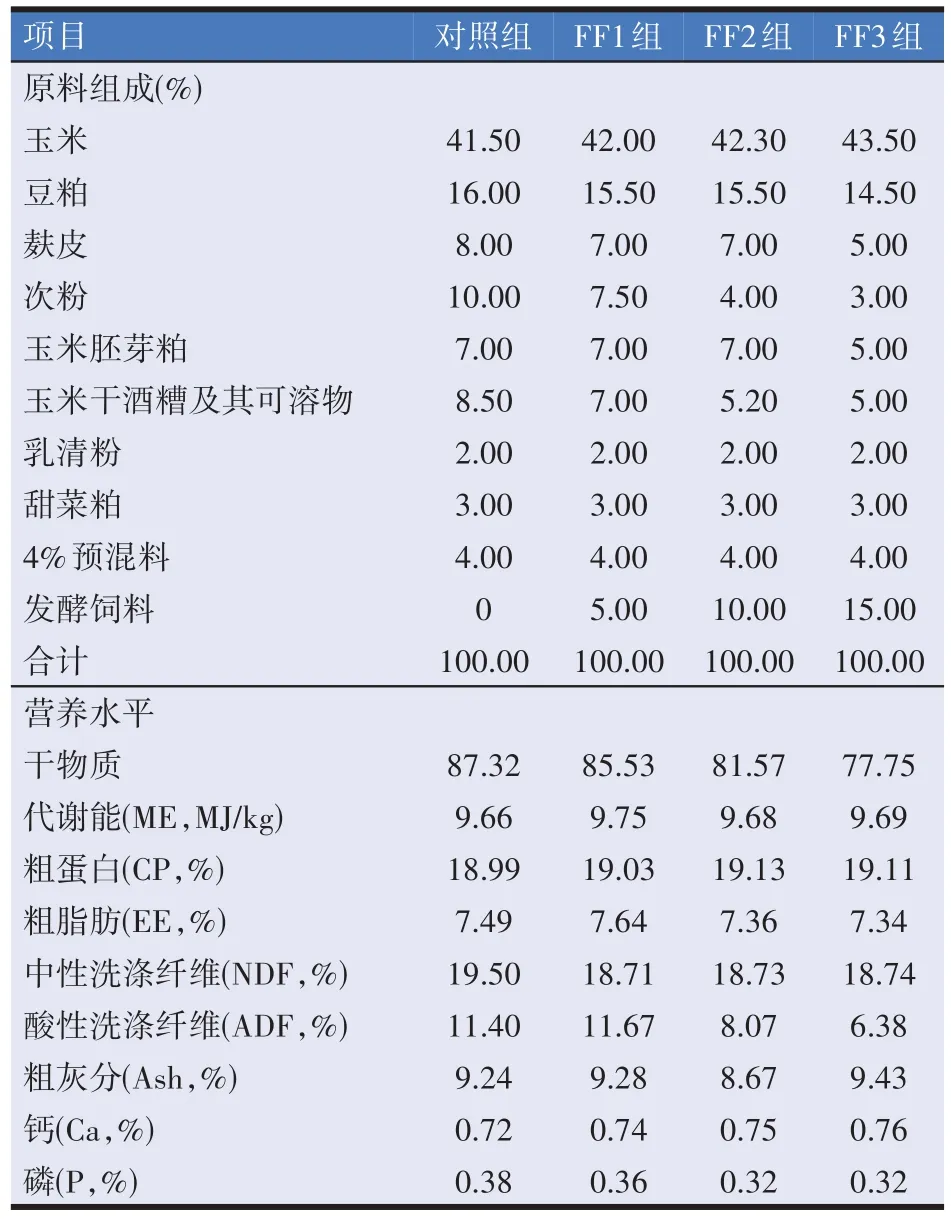
表2 试验饲粮组成及营养水平(干物质基础)
1.3 饲养管理
试验开始前对试验羊舍及周围环境进行打扫消毒,试验期间羔羊随母哺乳,在母子栏饲养,试验期间各组羔羊群体饲养,并于每日07:00 和17:00 按照试验设计进行饲喂,所有羔羊自由采食与饮水。
1.4 指标测定与方法
1.4.1 瘤胃液处理及pH测定
瘤胃液样品与纯化水按1∶10 放于锥形瓶中,37 ℃、180 r/min 振荡30 min 得到浸提液,用pH 计(PHS-3C,上海禹昂自动化科技)测定pH,然后将滤液分为3 份,一份用于测定氨态氮(NH3-N)、菌体蛋白(MCP)含量,一份用于测定挥发性脂肪酸(VFA)含量,一份用于测定菌群多样性。
1.4.2 氨态氮浓度
使用苯酚-次氯酸钠比色法[9]测定。
1.4.3 菌体蛋白(MCP)含量
菌体蛋白测定参照Broderick 等[10]阐述的差速离心法进行。瘤胃液经2 层纱布过滤后,于39 ℃、4 000 r/min离心15 min去除原虫及饲料颗粒。将上清液在12 000 r/min 离心20 min,弃去上清液,用15 mL 0.85%生理盐水重复洗涤、离心、沉淀2次,沉淀即为细菌组分。将上述高速离心收集的沉淀细菌组分无损失地转移到消化管中,按凯氏微量定氮法进行测定。
1.4.4 挥发性脂肪酸含量
用含有25%偏磷酸瘤胃液测定VFA,参照孙蕊等[13]的方法:称取1 g样品于10 mL容量瓶,加0.01 mol/L磷酸二氢钾定容,超声30 min,利用液相色谱法进行样品中乳酸(LA)、乙酸(AA)、丙酸(PA)、丁酸(BA)、戊酸(VA)含量的测定,以C18色谱柱、0.5 mL/min流速、35 ℃柱温、进样10 μL,在210 nm波长检测。计算VFA含量。
式中:X——样品中有机酸的含量(mg/kg);
m——样品称样量(g);
V——样品定容体积(mL);
C——各有机酸在标准曲线上计算的浓度(μg/mL)。
1.4.5 微生物多样性
滤液用来提取总DNA,经PCR 扩增后对产物进行纯化等操作后形成测序文库(Illumina Novaseq 6000)。将纯化后的扩增子等摩尔汇集在一起,将同一样本的PCR 产物混合后使用2%琼脂糖凝胶回收PCR 产物,进行回收产物纯化、检测与建库。使用fastp 软件对原始测序的序列进行质控,使用FLASH软件进行拼接。使用UPARSE 软件[11],在97%的相似度下聚类获得OTU 评估,比对Silva16S 对各个OTU[12]代表性的序列进行分类分析后得到相应的物种分类信息,然后在门(Phylum)水平统计4 组间群落组成,生成物种相对丰度(QIIME)。
1.5 统计分析
采用SPSS 22.0 软件中独立T检验对发酵饲料营养价值及抑菌活性数据进行统计分析,采用单因素方差分析(one-way ANOVA)对发酵饲料饲喂羔羊瘤胃数据进行分析,P<0.01 为差异极显著,P<0.05 为差异显著。试验数据以“平均值±标准误”表示。
2 结果与分析
2.1 复合益生菌发酵料对羔羊瘤胃发酵参数的影响
由表3 可知,瘤胃液pH FF2、FF3 组极显著低于对照组(P<0.01),FF2 组显著低于FF1 组(P<0.05),FF2 组和FF3 组差异不显著(P>0.05);氨态氮(NH3-N)浓度FF2 组显著高于其他各组(P<0.05),FF1、FF3组与对照组相比无显著差异(P>0.05);菌体蛋白(MCP)含 量FF1、FF2、FF3 组 间 差 异 不 显 著(P>0.05),但均极显著高于对照组(P<0.01)。

表3 复合益生菌发酵料对瘤胃液pH、氨态氮浓度菌体蛋白含量的影响
2.2 复合益生菌发酵饲料对羔羊瘤胃挥发性脂肪酸的影响
由表4可知,与对照组相比,FF1、FF2组和FF3组瘤胃液中乙酸的含量分别增加了18.88%(P<0.01)、15.31%(P<0.01)和70.07%(P<0.01);与对照组相比,FF1 组、FF2 组和FF3 组丙酸含量分别增加了64.91%(P<0.05)、21.29%(P>0.05)和36.01%(P>0.05);FF1、FF2、FF3 组戊酸分别降低了34.03%(P<0.05)、39.50%(P<0.05)、54.20%(P<0.05)。FF3组丁酸显著高于其他各组(P<0.05);与对照组相比,乙/丙值FF3 组增加了40.09%(P<0.05),FF1、FF2 组分别下降了28.45%(P>0.05)和13.36%(P>0.05)。TVFA 含量,FF1、FF2、FF3组分别提高23.02%、15.47%、35.77%(P<0.01),且FF3组比FF1、FF2组分别提高16.56%、24.03%(P<0.05)。
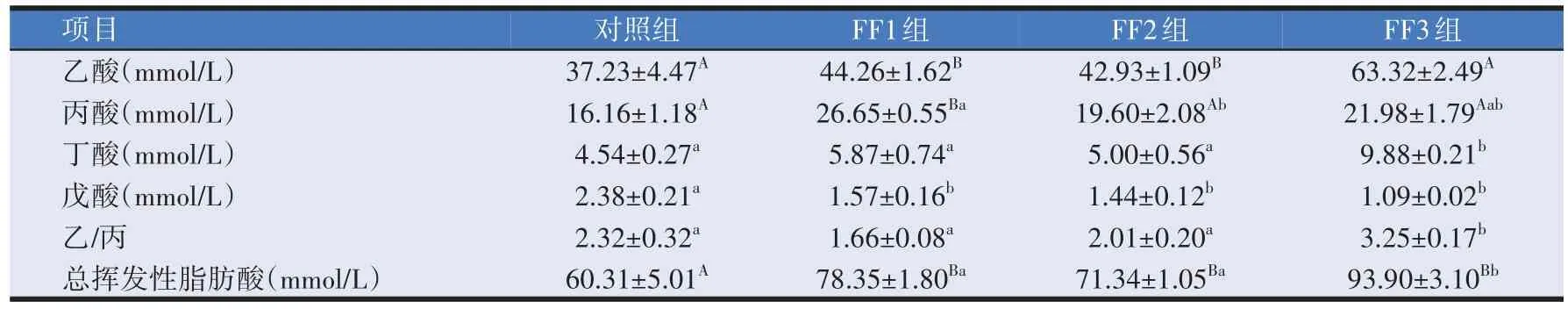
表4 复合益生菌发酵饲料对羔羊瘤胃发酵挥发性脂肪酸的影响
2.3 复合益生菌发酵饲料对羔羊瘤胃微生物多样性的影响
2.3.1 复合益生菌发酵饲料对羔羊瘤胃液微生物群落多样性的影响
α多样性反映微生物群落的丰富度和多样性。由表5和图1可知,Ace指数FF1、FF2组均显著低于对照组(P<0.05)。Chao1指数FF1组(P<0.01)和FF2组(P<0.05)显著低于对照组。菌落多样性指数Simpson和Shannon与对照组相比发酵饲料组呈下降趋势,但无显著差异(P>0.05),群落覆盖度指数Coverage指数各组均大于99%。

图1 瘤胃液细菌α多样性分析

表5 复合益生菌发酵饲料对羔羊瘤胃液α多样性的影响
2.3.2 复合益生菌发酵饲料对羔羊瘤胃液微生物群落结构的影响
图2 中Stress<0.05 表明该非度量多维排列(Nonmetric multidimensional scaling,NMDS)结果有很好的代表性。FF1、FF2、FF3组样本点相互接近,对照组则与各试验组分开,表明各试验组瘤胃微生物区系存在差异,也进一步说明添加复合益生菌发酵料可使哺乳期羔羊瘤胃微生物菌落结构发生变化。
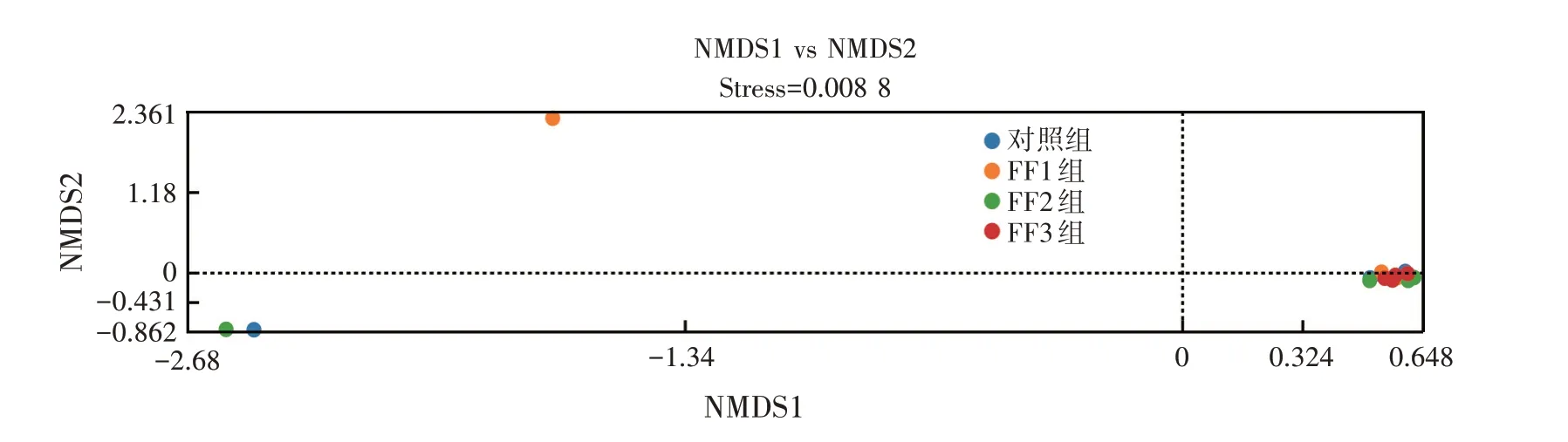
图2 NMSD结果
2.3.3 复合益生菌发酵饲料对瘤胃液微生物菌群属水平的影响
由表6 可知,对各试验组瘤胃液菌群中菌属丰度在前10 的进行分析。优势菌属包括普雷沃氏菌属1(Prevotella1)、琥珀酸菌属(Succiniclasticum)、钩吻 螺 科 NK3A20 菌 属(LachnospiraceaeNK3A20group)、瘤胃球菌_2 菌属(Ruminococcus_2)、瘤胃球菌_UCG-014 菌属(Ruminococcaceae_UCG-014)等。FF1 组与对照组相比普雷沃氏菌属1(Prevotella1)丰度差异显著(P<0.05),FF1 组与FF3 组无明显差异(P>0.05);FF2 组与对照组相比琥珀酸菌属 (Succiniclasticum)丰度差异显著(P<0.05),与FF3 组相比无显著差异(P>0.05);FF1 组与对照组相比瘤胃球菌_2菌属(Ruminococcus_2)无明显差异(P>0.05),与FF2组相比差异极显著(P<0.01),FF2 组与FF3 组相比差异极显著(P<0.01)。
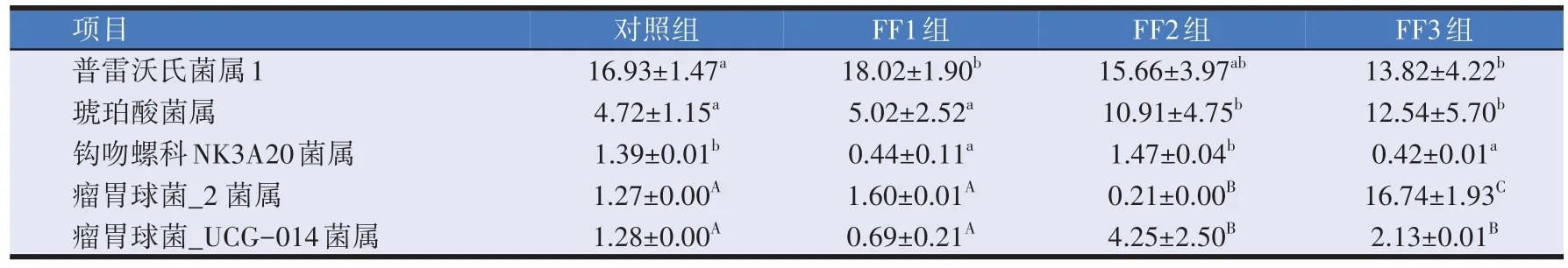
表6 复合益生菌发酵饲料对羔羊瘤胃液微生物菌群属水平相对丰度的影响
2.3.4 复合益生菌发酵饲料对羔羊瘤胃液微生物菌群门水平组成的影响
由表7可知,在门水平上,FF3组厚壁菌门丰度比对照组显著提高了24.21%(P<0.05)。FF1 组和FF3组拟杆菌门相对丰度比对照组显著提高了23.30%、9.05%(P<0.05),比FF2 组提高8.5%(P>0.05)。对照、FF2组和FF3组放线菌门相对丰度比FF1组显著降低86.36%、88.33%、75.80%(P<0.05)。FF3 组巴氏菌门相对丰度比对照、FF1 组和FF2 组显著提高75.86%、94.40%、84.91%(P<0.05)。
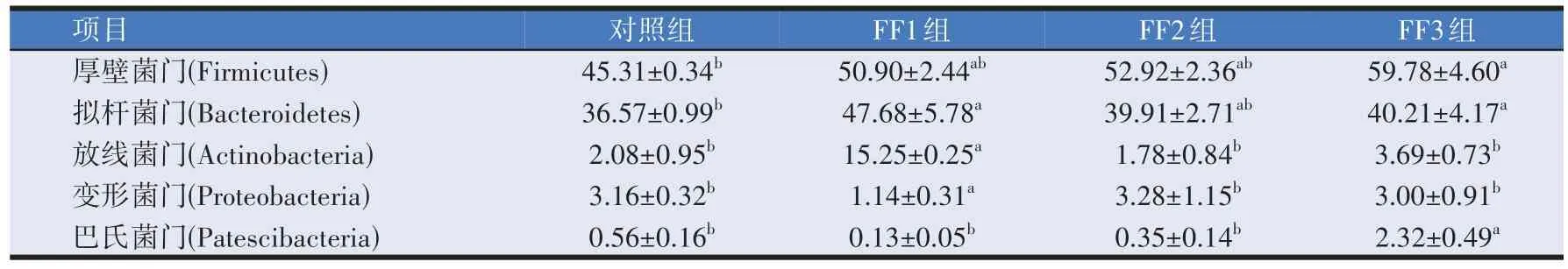
表7 复合益生菌发酵饲料对羔羊瘤胃液微生物菌群门水平相对丰度的影响
3 讨论
3.1 复合益生菌发酵饲料对瘤胃发酵参数的影响
反刍动物的瘤胃是一个相对稳定的厌氧发酵器官,瘤胃内的pH、氨态氮含量和挥发性脂肪酸含量是评价瘤胃发酵内环境的主要指标。pH 作为重要的参数指标,直接反映瘤胃发酵情况。正常情况下瘤胃的pH为5.5~7.5[6]。本试验中,饲喂复合益生菌发酵料后瘤胃pH为6.75~7.18,在正常范围内,随着复合益生菌发酵料添加比例增加呈下降趋势。表明复合益生菌发酵料显著影响瘤胃发酵情况,推测可能是由于复合益生菌发酵料中的有益菌促进了碳水化合物的消化代谢,增加了瘤胃中TVFA 的含量而导致瘤胃pH 下降。瘤胃中氨态氮主要来源于饲粮中的蛋白质、非蛋白氮、微生物蛋白及尿素循环,其含量的高低直接反映反刍动物瘤胃微生物氮的供应情况。氨态氮过低不利于微生物蛋白质合成及纤维类物质的降解利用,过高则会造成氮源的浪费甚至引起动物氨中毒[14]。适宜的瘤胃氨态氮含量有利于瘤胃微生物生长。研究表明,促进瘤胃微生物增殖所需氨态氮的适宜浓度为5.0~30.0 mg/dL[15]。本试验结果表明,复合益生菌发酵料饲喂后氨态氮含量为9.78~14.36 mg/dL,均在正常范围内,且FF2组显著高于其他各组。FF2组氨态氮含量高可能是由于粗蛋白含量略高于其他组,氨态氮含量与粗蛋白含量有关[16],可溶性蛋白和非蛋白含氮物含量高,且降解速率缓慢,有利于氨态氮和微生物蛋白的合成[17]。微生物可利用氨态氮产生菌体蛋白,本试验中,发酵饲料各组菌体蛋白(MCP)含量极显著高于对照组。在生产中使用适量酵母培养物也能够显著改善瘤胃内环境,提高机体对瘤胃内氨态氮的利用率[18-19]。可能由于瘤胃中有益菌大量生长繁殖,促进瘤胃中氮的降解和合成平衡,消耗饲料氨态氮进而合成菌体蛋白[20]。本试验结果表明,发酵饲料15%的添加量,可促进瘤胃中氨态氮代谢、增加菌体蛋白的含量。
瘤胃中挥发性脂肪酸(VFA)为反刍动物提供了70%~80%的能量,而且乙酸、丙酸、丁酸占总挥发性脂肪酸的95%左右。瘤胃上皮对VFA吸收速率与瘤胃液pH有关。据报道,当pH≥7时,吸收率为乙酸>丙酸>丁酸,反之相反[21],这可能是FF2组乙酸、丙酸和丁酸含量低于FF1组和FF3组的原因之一。FF2组的VFA含量最低,可能是10%复合益生菌发酵料条件下,瘤胃上皮对其吸收效率最佳。饲料的营养水平可显著影响VFA的含量[22]。前期试验结果表明,饲喂15%复合益生菌发酵料可提高哺乳期羔羊生长性能,平均日增重显著提高(45.5%),平均日采食量提高17.2%,说明复合益生菌发酵饲料添加比例会影响羔羊的采食量和消化率[23]。在限饲条件下瘤胃中VFA含量显著下降,高营养水平的饲粮可显著提高荷斯坦奶公牛瘤胃液中乙酸、丙酸和丁酸的含量[24],这与本研究结果一致。试验证实,复合益生菌发酵料可增加饲料中乳酸菌和酸溶蛋白的含量[25],在饲料发酵过程中蛋白酶活性的增加促进了饲料中大分子蛋白降解成小分子蛋白,利用动物的消化吸收,进而促进羔羊的生长性能[26]。小肽能够刺激发酵非碳水化合物的细菌的增殖,促进可溶性糖和淀粉等的降解,同时提高丙酸含量,降低乙/丙值,使发酵类型向丙酸发酵转变[27]。张腱皓等[28]研究表明,复合微生态制剂中活酵母可显著降低月龄滩羊瘤胃内乙/丙值,提供更多能量,从而提高生长性能。另外,乳酸菌可通过刺激瘤胃消化纤维的细菌提高营养物质消化吸收率达到显著提高荷斯坦奶牛瘤胃液TVFA 含量[29]。本研究中添加复合益生菌发酵料组瘤胃液TVFA含量均极显著高于对照组,可能是益生菌促进了瘤胃发酵[30]。
3.2 复合益生菌发酵饲料对羔羊瘤胃微生物多样性的影响
瘤胃微生物菌群对宿主的健康和生长性能至关重要。瘤胃微生物区系受诸多因素的影响,其中饲粮是最重要的因素之一。本试验中,随着发酵饲料添加量比例增加,Chao1和Ace指数先降低后增加,Shannon指数先增加后降低,可能是微生物发酵饲料中寡糖类物质可提高适口性,提高免疫力,小肽类为羔羊提高营养物质[31],有机酸可促进有益菌的增殖[32]。这些代谢物质可以调控微生物生长,从而影响了瘤胃微生物群落结构[33]。Yin等[34]报道,羔羊从出生至20日龄后,瘤胃内的微生物属水平与瘤胃中挥发性脂肪酸浓度和微生物蛋白水平的变化相关,挥发性脂肪酸含量与普雷沃氏菌属1(Prevotella1)、Ruminococcaceae UCG-014、Ruminococcus2丰度呈正相关。本试验结果表明,复合益生菌发酵料可显著增加哺乳期羔羊瘤胃挥发性脂肪含量,同时普雷沃氏菌、Ruminococcaceae UCG-014、Ruminococcus2 丰度等菌属的丰度显著增加。作为瘤胃的优势菌门[35],厚壁菌门是主要降解纤维素的菌群,拟杆菌门主要将饲料中碳水化合物分解生成丙酸,为机体提供能量,同时还能降解多糖促进营养物质吸收[36]。本研究发现,发酵料组羔羊瘤胃液厚壁菌门、拟杆菌门相对丰度比对照组显著增加。在日粮中添加1%复合菌(酵母菌、枯草芽孢杆菌、植物乳杆菌)颗粒料,可增加拟杆菌门丰度,使氨态氮含量减少,菌体蛋白增加,说明复合菌颗粒料中的益生菌提高了瘤胃中微生物多样性,进而利用氨态氮生成菌体蛋白[37],这与本试验中菌体蛋白含量增加的结果一致。放线菌门是一类革兰氏阳性细菌,大部分是腐生菌,本研究中10%发酵饲料组放线菌门相对丰度低于对照组,推测可能是饲料发酵后有害菌减少,饲用后可改善瘤胃菌群环境,抑制放线菌的生长[38]。而FF1组和FF3组瘤胃液放线菌门相对丰度高于对照组,这可能与乙酸和丙酸含量有关,也是导致VFA含量发生变化的原因之一[39]。
4 结论
在本试验条件下,10%发酵饲料可使哺乳期羔羊瘤胃pH 降低,氨态氮浓度和菌体蛋白含量、TVFA 含量增加,同时琥珀酸菌属、Ruminococcaceae UCG-014、Ruminococcus2及厚壁菌门、拟杆菌门丰度显著升高。
