姜黄醇减轻Erastin诱导的小鼠海马神经元铁死亡的研究 *
2024-01-23陈俊逾
李 玥 陈俊逾
(新疆医科大学第四临床医学院神志病科,新疆 乌鲁木齐 830099)
铁死亡是Dixon S 等[1]于2012 年提出的一种新的、铁依赖性的细胞程序性死亡。不同于传统的细胞凋亡,铁死亡兼具凋亡和坏死的形态学特点,主要表现为细胞相互分离、变小变圆,细胞膜完整但发生聚缩,无核固缩,及线粒体皱缩、线粒体嵴减少甚至消失、线粒体膜密度增加、线粒体外膜破裂等[2]。铁死亡现象广泛存在于体细胞当中,参与神经系统退行性病变的发生;铁蛋白自噬是由核受体共激活因子4(NCOA4)介导的铁蛋白吞噬过程,即NCOA4的有效结构域可以和铁蛋白重链1 亚基(FTH1)结合,形成复合物,参与溶酶体自噬,从而在细胞内释放大量铁离子[3]。已有研究[4]表明,小鼠海马神经元细胞(HT22)神经毒性模型中,铁蛋白自噬通量增加,NCOA4 和FTH1 共定位增加。目前有多种化合物被证实可以诱导铁死亡,敲低NCOA4的神经细胞对铁死亡诱导剂Erastin的敏感性减低[5,6]。
姜黄醇是传统中药莪术中的活性成分,是一种具有生物活性的小分子倍半萜化合物[7]。化学分离姜黄醇提取物后发现,姜黄醇中的酚羟基结构是其抗氧化活性基础;酚羟基甲基化具有对酚类物质的自由基清除作用,抗氧化物中酚羟基数越多,其抗氧化活性越强[8,9]。适当剂量的姜黄醇可抑制细胞氧化应激反应,抑制脑缺血再灌注损伤小鼠模型的海马神经元凋亡[10]。已有体外研究[11,12]证明,姜黄醇能够调控非Caspases 依赖的线粒体途径诱导的程序性细胞死亡,且可通过抑制Yes 相关蛋白(YAP)/NCOA4轴发挥抗铁死亡作用。亦有系统药理学研究[13]表明,姜黄醇可能通过多靶点发挥抗铁死亡作用。基于此,本研究探究姜黄醇是否可以通过调控NCOA4 介导的自噬以调控铁死亡,并发挥神经保护作用。
1 材料与方法
1.1 材料
1.1.1 实验细胞HT22细胞系购自武汉普诺赛生命科技有限公司(CL-0697-D)。
1.1.2 主要试剂与耗材姜黄醇、Erastin 均购自上海麦克林生化科技股份有限公司;NCOA4、半胱氨酸/谷氨酸反向转运蛋白(xCT)、FTH1、谷胱甘肽过氧化物酶4(GPX4)、长链脂酰辅酶A 合成酶4(ACSL4)、β-actin抗体购自Abcam 公司;膜铁转运蛋白(FPN1)抗体购自武汉三鹰生物技术有限公司;山羊抗兔IgG 二抗购自武汉博士德生物工程有限公司;CCK-8 试剂购自武汉三鹰生物技术有限公司;细胞铁含量检测试剂盒购自北京索莱宝科技有限公司;小鼠GPX4 酶联免疫吸附测定试剂盒购自于江莱生物科技有限公司。
1.2 研究方法
1.2.1 细胞分组与处理(1)工作液的配置:①1 µM Erastin 工作液:将1 mg Erastin 加至5 mL 离心管,常温下离心2 min(转速:1000 r/min,离心半径:15.9 cm);再加入1.8280 mL 的二甲基亚砜(DMSO)充分涡旋、混匀,即获得。②5 µM 姜黄醇工作液:将5 mg 姜黄醇溶于2.1155 mL 的DMSO 中,充分吹打、混匀;涡旋3 次,每次10 s,即获得。(2)细胞分组及给药处理:本实验分4 个实验组,即对照组、DMSO 组、Erastin 组和Erastin+姜黄醇组。细胞复苏后,传代2~3 代以获得足量HT22细胞,接种至6孔板和96孔板中;待细胞生长密度达到80%时,弃原培养基,给予含药培养基或完全培养基换液处理。①对照组:予完全培养基换液,继续培养48 h。②DMSO 组:予含0.1%的DMSO 完全培养基换液,继续培养48 h。③Erastin 组:将50 µL 的1 µM Erastin工作液溶于100 mL 完全培养基中,获得Erastin 浓度为0.5 µM 的含药培养基,给予含Erastin 完全培养基换液,继续培养24 h;更换为完全培养基,继续培养24 h。④Erastin+姜黄醇组:将50 µL 的5 µM 姜黄醇工作液溶于5 mL 完全培养基中,获得姜黄醇浓度为50 µM 的含药培养基;给予含Erastin 完全培养基换液,继续培养24 h;更换为含姜黄醇完全培养基,继续培养24 h。
1.2.2 细胞活力检测(CCK-8法)将HT22 细胞接种于96 孔板中,每组设置3 个复孔;待细胞贴壁生长密度达80%,按组别给药处理;每孔加入10 µL 的CCK-8 试剂,继续培养4 h;酶标仪562 nm 波长下检测每孔分光度,并计算不同组别的细胞活力。
1.2.3 HT22铁死亡相关蛋白表达检测(Western Blot法) 将HT22 接种于6 孔板中,待细胞贴壁生长密度达80%,按组别给药处理;干预后,每孔加入放射免疫沉淀法裂解缓冲液(RIPA蛋白裂解液),提取总蛋白,并以二辛可宁酸(BCA)法检测浓度;各组总蛋白取20 µg制备蛋白质样品;蛋白质样品经十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳后,转移到聚偏二氟乙烯膜(PVDF)膜上,用5%脱脂牛奶封闭2 h;加入相应一抗,4 ℃孵育过夜;加入铁自噬相关蛋白(NCOA4、FTH1)、铁死亡相关蛋白[GPX4、铁泵蛋白(FPN)、ACSL4]二抗,室温孵育2 h;加入增强化学发光法(ECL)试剂显色,并使用Image J软件分析目标蛋白灰度值。
1.2.4 细胞铁含量检测冰浴超声波破碎细胞,然后使用铁含量测定试剂盒测定铁含量。酶标仪510 nm 波长检测平均光密度值,根据标准曲线计算细胞铁含量。
1.2.5 GPX4浓度测定(酶联免疫吸附法)使用RIPA 蛋白裂解液裂解细胞,离心后取上清液,然后通过GPX4酶联免疫吸附测定试剂盒测定各组上清液GPX4 浓度。酶标仪450 nm 波长检测平均光密度值,根据标准曲线计算细胞铁含量。
1.3 统计学方法采用GraphPad Prism 8.0 分析数据,计量资料以(±s)表示,多组间比较行单因素x2分析,两两比较行SNK-q检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 姜黄醇对Erastin诱导的HT22细胞存活率影响对照组细胞与DMSO 组细胞活力比较,差异无统计学意义(P>0.05);Erastin组较对照组细胞活性显著降低,Erastin+姜黄醇组较Erastin 组细胞存活率显著升高,差异均有统计学意义(P<0.05)。见表1。
表1 姜黄醇对Erastin诱导的HT22存活率影响(± s)
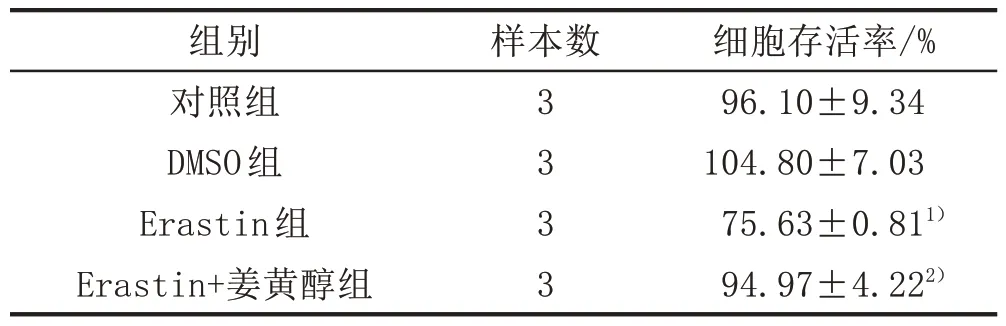
表1 姜黄醇对Erastin诱导的HT22存活率影响(± s)
注:与对照组比较,1)P<0.05;与Erastin组比较,2)P<0.05。
细胞存活率/%96.10±9.34 104.80±7.03 75.63±0.811)94.97±4.222)组别对照组DMSO组Erastin组Erastin+姜黄醇组样本数3333
2.2 姜黄醇对Erastin诱导的HT22细胞铁含量影响与对照组、DMSO 组比较,Erastin 组细胞铁含量较显著升高,差异有统计学意义(P<0.01);与Erastin 组比较,Erastin+姜黄醇组HT22 铁含量显著下降,差异有统计学意义(P<0.01)。见表2。
表2 姜黄醇对Erastin诱导的HT22铁含量影响(± s,ng/104 cell)
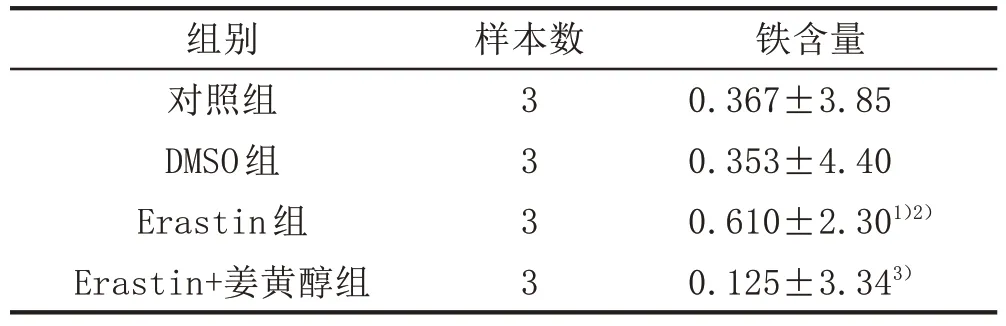
表2 姜黄醇对Erastin诱导的HT22铁含量影响(± s,ng/104 cell)
注:与对照组比较,1)P<0.01;与DMSO 组比较,2)P<0.01;与Erastin组比较,3)P<0.01。
铁含量0.367±3.85 0.353±4.40 0.610±2.301)2)0.125±3.343)组别对照组DMSO组Erastin组Erastin+姜黄醇组样本数3333
2.3 姜黄醇对Erastin诱导的HT22细胞GPX4酶活性影响 对照组、DMSO组细胞GPX4酶活性比较,差异无统计学意义(P>0.05);与对照组比较,Erastin 组细胞GPX4 酶活性降低,差异有统计学意义(P<0.05);与Erastin 组比较,Erastin+姜黄醇组细胞GPX4 酶活性升高,差异有统计学意义(P<0.05)。见表3。
表3 姜黄醇对Erastin诱导的HT22 GPX4酶活性影响(± s)
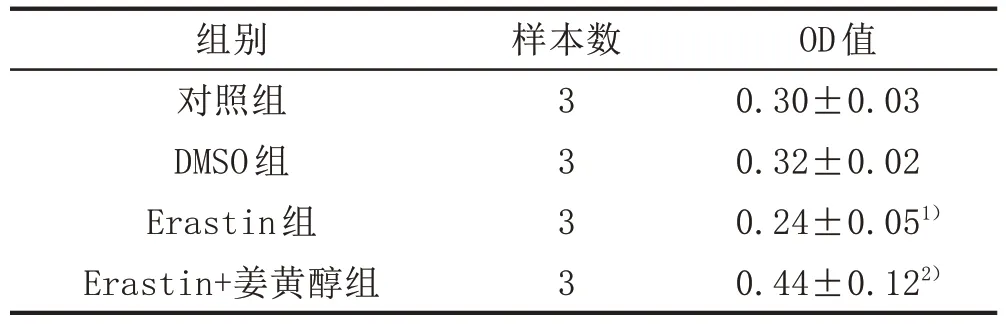
表3 姜黄醇对Erastin诱导的HT22 GPX4酶活性影响(± s)
注:与对照组比较,1)P<0.05;与Erastin组比较,2)P<0.05。
OD值0.30±0.03 0.32±0.02 0.24±0.051)0.44±0.122)组别对照组DMSO组Erastin组Erastin+姜黄醇组样本数3333
2.4 姜黄醇对Erastin诱导的HT22细胞铁死亡相关蛋白表达水平影响与对照组比较,Erastin 组NCOA4、ASCL4 蛋白水平显著上调,FTH1、FPN、GPX4 蛋白水平显著下调,差异均有统计学意义(P<0.01);与Erastin 组比较,Erastin+姜黄醇组NCOA4、ASCL4 蛋白水平显著下调,FTH1、FPN、GPX4 蛋白水平显著上调,差异均有统计学意义(P<0.01);DMSO 组、对照组比较,上述蛋白表达差异均无统计学意义(P>0.05)。见图1、表4。
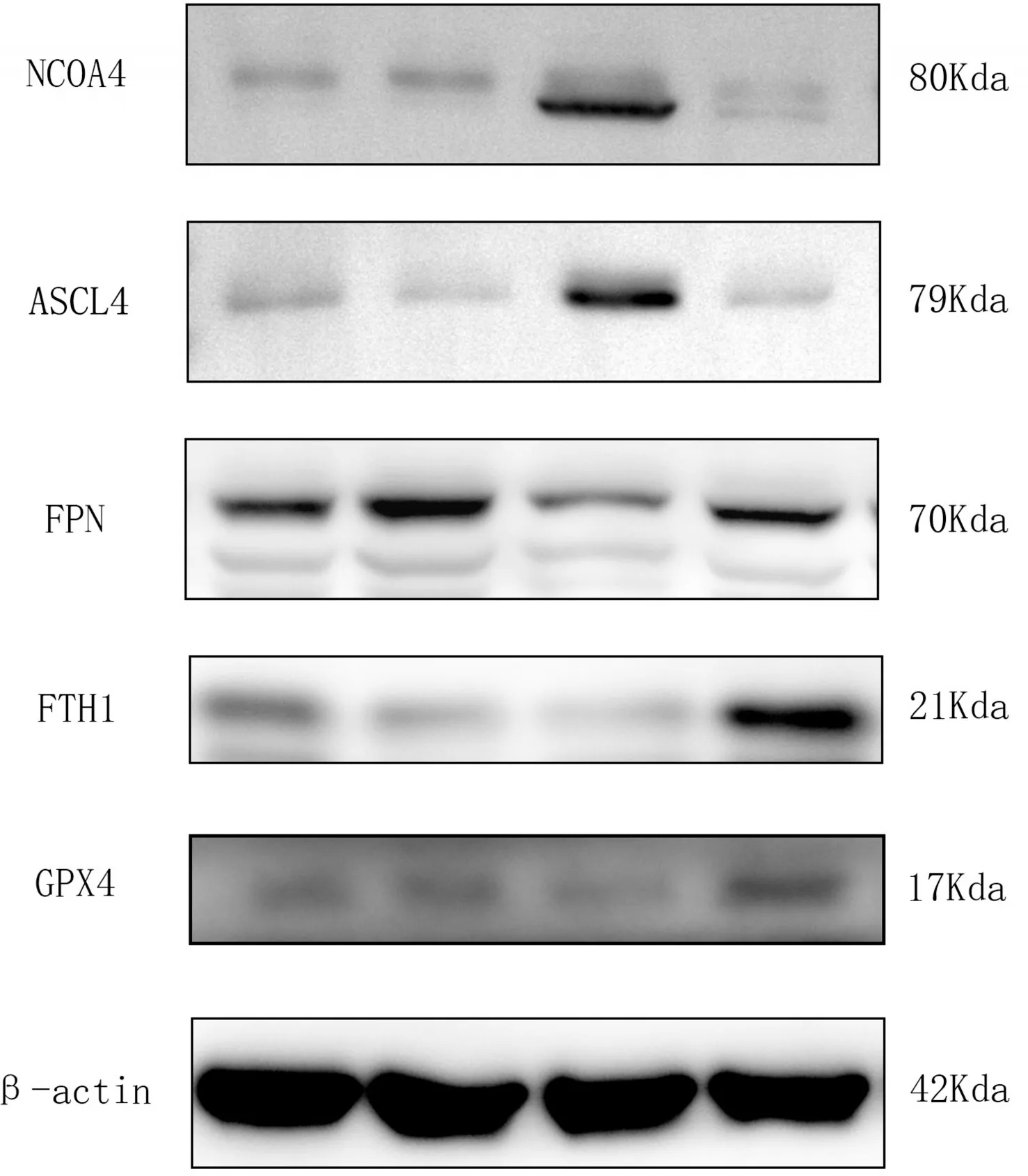
图1 Western blot检测NCOA4、FPN、ASCL4、FTH1、GPX4蛋白水平
表4 姜黄醇对HT22细胞铁死亡相关蛋白表达水平影响 (± s)
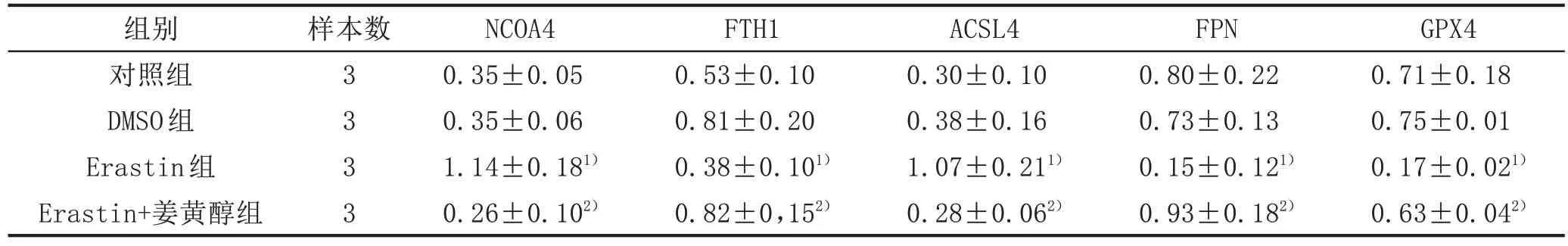
表4 姜黄醇对HT22细胞铁死亡相关蛋白表达水平影响 (± s)
注:与对照组比较,1)P<0.01;与Erastin组比较,2)P<0.01。
组别对照组DMSO组Erastin组Erastin+姜黄醇组GPX4 0.71±0.18 0.75±0.01 0.17±0.021)0.63±0.042)样本数3333 NCOA4 0.35±0.05 0.35±0.06 1.14±0.181)0.26±0.102)FTH1 0.53±0.10 0.81±0.20 0.38±0.101)0.82±0,152)ACSL4 0.30±0.10 0.38±0.16 1.07±0.211)0.28±0.062)FPN 0.80±0.22 0.73±0.13 0.15±0.121)0.93±0.182)
3 讨论
作为近年来肿瘤、炎症、神经系统疾病及诸多领域神经退行性疾病的研究靶点,铁死亡被广泛研究。铁死亡涉及铁代谢、脂代谢、糖代谢和氨基酸代谢等多途径,而铁自噬是其最为重要的上游机制之一,NCOA4是铁自噬过程中重要的货物蛋白,在该过程中发挥重要的调节作用。
作为传统中草药莪术有效提取物,姜黄醇不仅能够发挥强抗脂质过氧化作用,且具有较好的安全性。早期动物研究[10,14]发现,姜黄醇可改善多种神经系统疾病,例如卒中和再灌注损伤、阿尔茨海默病、脑动脉粥样硬化等,具有发挥神经保护作用、治疗神经系统疾病的重要潜力[15]。并有研究[12]表明,姜黄醇可能通过调节NCOA4 发挥抗铁死亡作用。但是关于姜黄醇调控NCOA4/FTH1 作用鲜有研究。文章的创新点在于,探究了姜黄醇在体外减轻Erastin 诱导的神经元细胞铁死亡,与调节铁死亡相关蛋白表达水平、降低细胞内亚铁含量、提高细胞活力相关。如预期Erastin 可通过抑制xCT功能、降低GPX4 水平,诱导HT22 小鼠海马神经元发生铁死亡;而姜黄醇处理后,HT22亚铁含量降低、细胞活性升高,铁死亡相关蛋白GPX4、FTH1、FPN 水平升高,NCOA4、ACSL4 水平降低,提示姜黄醇在体外可以调控铁自噬,从而缓解神经元细胞铁死亡。
GPX4 是一种可以修复细胞不饱和脂肪酸氧化损伤的硒蛋白,能够特异性将具有细胞毒性的脂质过氧化氢转化为无毒性的脂醇,是保护细胞抗氧化损伤的关键酶。xCT 是由轻链的溶质载体家族7 成员11(SLC7A11)和重链溶质载体家族3 成员2(SLC3A2)构成的异二聚体,胱氨酸与谷氨酸通过System XC-在生物膜内外进行1∶1转运[16]。胱氨酸经xCT进入细胞内,被还原为半胱氨酸,进一步在γ-谷氨酰半胱氨酸合成酶(GCL)、谷胱甘肽合成酶(GSS)作用下合成谷胱甘肽(GSH);GSH 是体内强抗氧化物,也是GPX4 的关键辅助因子,在抗氧化应激方面发挥重要作用。xCT 被阻断时,胱氨酸无法与谷氨酸进行交换,细胞内谷氨酸堆积,过量谷氨酸具有直接细胞毒性;同时胞内GSH 合成底物胱氨酸缺乏,GSH 耗竭,导致GPX4 酶活性下降,促进铁死亡发生[17]。
已有研究[18]证明,ACSL4 是铁死亡的标记物,多不饱和脂肪酸(PUFA)在ACSL4 催化下形成多不饱和脂肪酸-酰基辅酶A(PUFA-coA),再经过酯化后插入生物膜磷脂中,形成脂质过氧化底物。Fe2+进入不稳定铁池后,部分游离铁以铁蛋白的形式储存,未结合的Fe2+由FPN 转运出细胞外,从而维持不稳定铁池稳态;FPN表达水平下降,不利于细胞内游离铁转出胞外,加速细胞铁死亡[19]。
NCOA4 作为选择性铁自噬过程中的重要调节蛋白,是靶向自噬体的货物蛋白。Mancias[3]提出了NCOA4 介导的铁自噬,还鉴定了NCOA4 和FTH1 的结合泛素化系统调节;NCOA4表达升高不仅促进细胞铁死亡,并可增加细胞对铁死亡的敏感性;FTH-1 作为细胞储铁元件之一,随细胞铁自噬增加而减少。
上述证据为本研究结果提供了理论机制,姜黄醇调节Erastin 处理后的HT22 细胞的铁死亡相关蛋白表达水平、减轻细胞内游离铁蓄积,提高了细胞活性。综上所述,姜黄醇可在体外抑制HT22 铁死亡,发挥神经保护作用。但本研究尚缺乏靶向NCOA4/FTH1 的反向验证实验,后续我们将对该方向进行深入研究。
