肝星状细胞特异性Grk2基因敲除小鼠模型的制备及鉴定
2024-01-22王语涵许雅萍陈婷婷高萍萍孙妩弋
王语涵,许雅萍,李 南,陈婷婷,李 玲,高萍萍,王 华,魏 伟,孙妩弋
(1. 安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,安徽 合肥 230032;2. 安徽医科大学第一附属医院肿瘤科,安徽 合肥 230022)
G蛋白偶联受体激酶2(G protein-coupled receptor kinase 2,GRK2)是一种丝氨酸/苏氨酸激酶,广泛表达于多种组织中[1]。GRK2蛋白由689个氨基酸残基组成,其结构包括氨基端结构域、激酶结构域和羧基端结构域。GRK2不仅能磷酸化G蛋白偶联受体,参与其信号调节,还可以磷酸化多种非受体底物,并以激酶活性依赖的方式与其他底物相互作用[2]。GRK2也可与细胞内激酶信号分子直接作用并调节其活性,如PI3K/Akt、MEK1/2、p38 MAPK[3]。此外,GRK2还可结合并磷酸化细胞骨架蛋白,包括tubulin、ezrin、synuclein[4]。提示GRK2参与多种细胞内信号转导,进而影响疾病的发生发展。
1996年,Jaber等[5]提出,Grk2基因敲除纯合子(Grk2-/-)小鼠具有胚胎致死性。Grk2-/-胚胎在妊娠15.5 d之后无法存活,而Grk2基因敲除杂合子小鼠(Grk2+/-)在妊娠期之后正常存活,但小鼠体质量和体型与野生型小鼠相比较小,生长速度减慢[6]。GRK2在肝脏中表达丰富,肝脏中非实质细胞之一肝星状细胞(hepatic stellate cell,HSC)位于肝窦的内皮间隙,占总肝细胞群的8%~10%[7]。由于HSC在肝脏中占比较低等特点[8],本研究通过Cre-loxP重组酶系统特异性敲除C57BL/6J小鼠HSC中Grk2基因,为探究HSC中GRK2在肝脏疾病中的作用提供研究基础。
1 材料与方法
1.1 材料
1.1.1实验动物Grk2fl/fl小鼠与Lrat-Cre小鼠,均购自江苏集萃药康生物科技股份有限公司。实验动物饲养繁殖于安徽医科大学临床药理研究所SPF屏障环境[实验动物使用许可证号:SYXK(皖)2020-001]。饲养环境为恒温(22±2)℃,湿度50%±5%,12 h/12 h昼夜交替。所有操作经安徽医科大学临床药理研究所实验动物伦理委员会批准。
1.1.2主要试剂 蛋白酶K,购自美国Sigma公司;2×Taq PCR Master Mix,购自北京博迈德基因技术有限公司;引物购自生工生物工程(上海)股份有限公司;Super Red核酸染料,购自北京兰杰柯科技有限公司;抗β-actin抗体,购自Affinity公司;抗Desmin抗体,购自武汉爱博泰克生物科技有限公司;抗GRK2抗体,购自美国Santa Cruz公司;Alexa Fluor 647山羊抗兔荧光二抗、Alexa Fluor 488山羊抗鼠荧光二抗,均购自美国Thermo Fisher Scientific公司。
1.1.3仪器 通用型电泳仪(北京六一生物科技有限公司,型号DYY-7C);全自动化学发光图像分析系统(上海天能科技有限公司,型号Tanon 5200);正置光学显微镜(德国LEICA公司,型号DM4B);冰冻切片机(德国LEICA公司,型号CM 1950);PCR仪(美国BIO-RAD公司,型号T100)。
1.2 方法
1.2.1HSC特异性敲除Grk2小鼠的构建策略与流程Grk2位于小鼠19号染色体,在其2号外显子的两端插入loxP位点(Fig 1A)。根据Cre-loxP原理,将带有loxP位点的Grk2fl/fl小鼠与HSC特异性表达Cre重组酶的Lrat-Cre小鼠交配,Cre酶在HSC内特异性识别loxP位点,实现在HSC内特异性敲除。将Grk2fl/fl小鼠与Lrat-Cre+/+小鼠进行交配得到Grk2fl/-/Lrat-Cre+/-的小鼠,将其与Grk2fl/fl小鼠进行杂交,对其子代进行鉴定并筛选得到Grk2fl/fl/Lrat-Cre+/-(Grk2ΔHSC)实验组小鼠和Grk2fl/fl/Lrat-Cre-/-对照组小鼠(Fig 1B)。
1.2.2HSC特异性敲除Grk2小鼠的基因型鉴定 将4周龄的小鼠进行编号,剪下3~5 mm的鼠尾,加入相应鼠尾裂解液和蛋白酶K,置于55 ℃恒温水浴锅消化过夜。次日3 000 r·min-1离心5 min,取200 μL裂解后产物,使用乙醇提取法获得小鼠DNA样本。依据引物(Tab 1)进行PCR反应。PCR体系的构成:12.5 μL 2×Taq Mix、9.5 μL去离子水、正反向引物(10 μmol·L-1)各1 μL和DNA模板(100 mg·L-1)1 μL,总体积25 μL。取13 μL扩增产物进行2%琼脂糖凝胶电泳。电泳结束后在凝胶扫描成像系统显影,根据观察到的扩增片段长度进行基因鉴定。
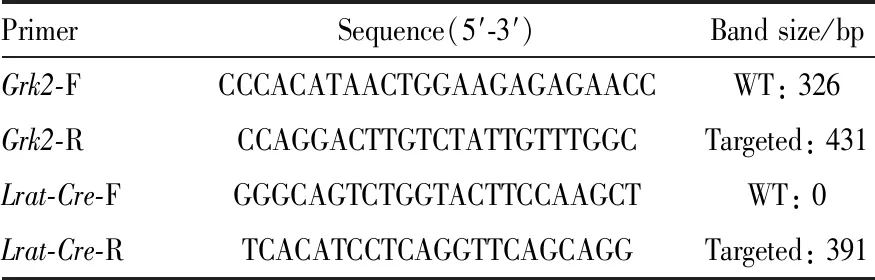
Tab 1 Primer for genotyping of Grk2ΔHSC mice
1.2.3观察小鼠的基本情况和繁育能力 观察实验组Grk2ΔHSC小鼠和对照组Grk2fl/fl小鼠的体质量、生长发育状态、繁殖能力等。
1.2.4Grk2ΔHSC小鼠原代HSC的分离 小鼠禁食12 h,麻醉后置于解剖台上,消毒后剪开腹腔,拨开肠道,暴露肝脏、肝门静脉与下腔静脉,于肝门静脉平行插入留置针,将Hank’s液用蠕动泵以合适的速度通过肝门静脉灌入肝脏,待肝脏变成淡白色,将Hank’s液替换为Ⅳ型胶原酶溶液,继续灌注。剥离肝脏,去除胆囊,把肝脏放入装有Ⅳ型胶原酶溶液的培养皿中。将肝脏剪碎并制成细胞团块悬浮液,置于37 ℃恒温水浴锅中消化30 min。消化完成后用滤网过滤肝脏悬浮液,然后4 ℃、2 000 r·min-1离心15 min,取沉淀弃上清液,用Hank’s液清洗沉淀,离心弃上清液。DMEM培养液重悬后,用25% Percoll和100% Percoll梯度离心分离,4 ℃、3 000 r·min-1离心15 min。吸取中间层的细胞,再次4 ℃、2 000 r·min-1离心10 min,下层沉淀即为HSC。
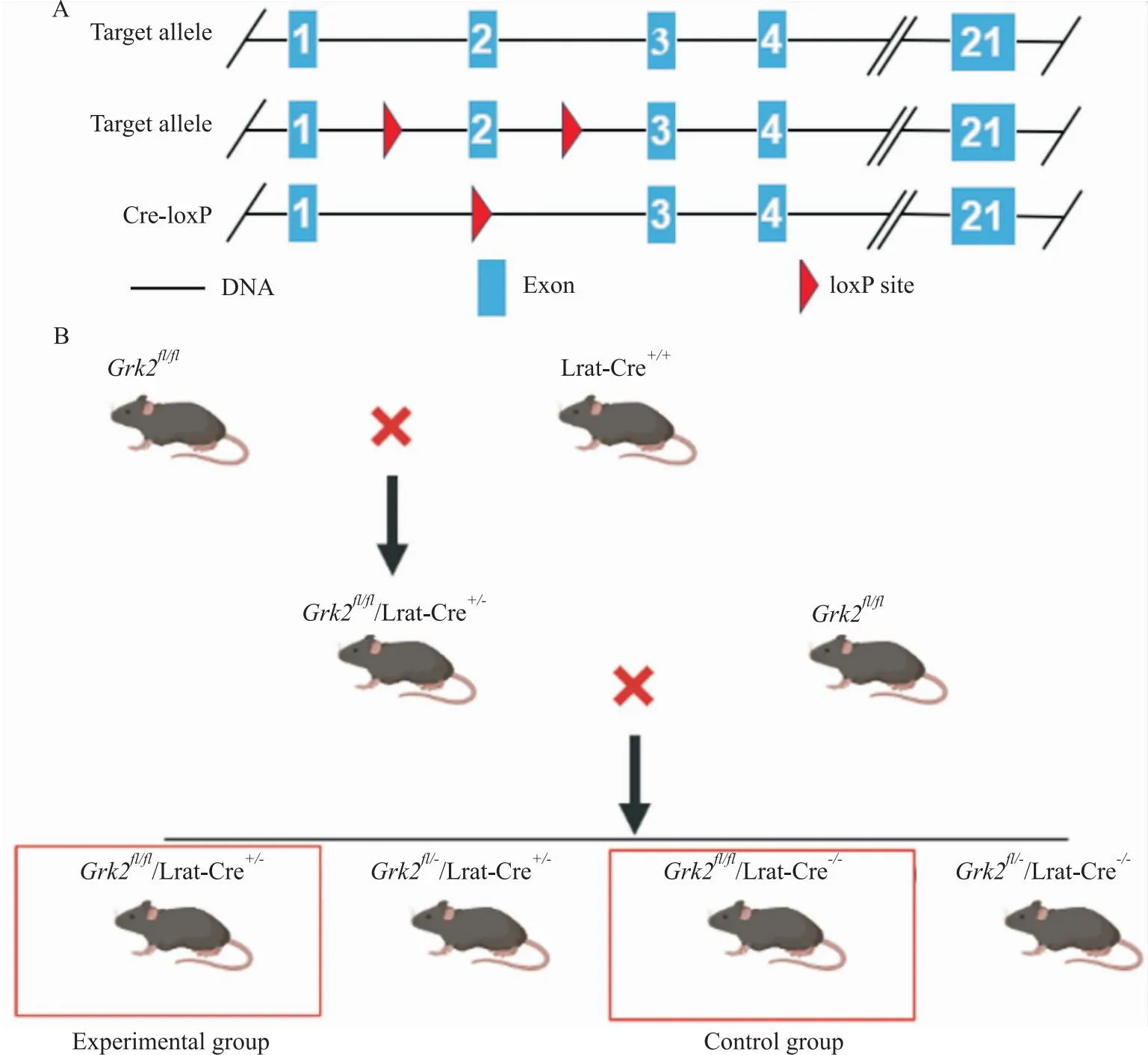
Fig 1 Establishment strategy (A) and flow chart (B) of Grk2ΔHSC
1.2.5免疫荧光双染检测HSC中GRK2的表达 将小鼠肝脏用4%多聚甲醛固定24 h后,用15%蔗糖脱水24 h,再用30%蔗糖脱水24 h,最后用OCT包埋。冰冻切片机切片,厚度为6 μm。用PBS清洗3 min,重复3遍后,用0.5% Triton X-100通透30 min,再用50×EDTA冷修复10 min,PBS清洗3 min,重复3遍后,用5% BSA封闭1 h,加入Desmin抗体和GRK2抗体,4 ℃孵育过夜。次日复温1 h后,用PBS清洗5 min,重复3遍后,荧光二抗室温孵育1.5 h。PBS清洗后,DAPI孵育10 min,使用抗荧光淬灭剂封片,正置光学显微镜观察拍照。
1.2.6检测Grk2ΔHSC小鼠HSC中GRK2蛋白表达 将小鼠原代HSC加入裂解液(RIPA ∶PMSF=99 ∶1)研磨后,冰上裂解30 min,吸取裂解液,12 000 r·min-1离心20 min,取上清,加入上样缓冲液,煮沸10 min。进行SDS-PAGE电泳,转膜,PVDF膜用5%脱脂牛奶室温封闭2 h,分别加入GRK2抗体和β-actin抗体4 ℃孵育过夜。加入对应二抗室温孵育2 h,用ECL发光显影液于凝胶成像系统中检测目的蛋白条带。采用ImageJ软件定量分析条带灰度值,根据GRK2与β-actin条带灰度值的比值,计算其相对表达量。
1.2.7检测小鼠心脏、脾、肺和肾脏组织中GRK2蛋白表达 称取适量小鼠肺、脾、肾脏和心脏组织于1.5 mL EP管中,加入裂解液后冰上裂解,12 000 r·min-1离心20 min,取上清弃沉淀,加入上样缓冲液,煮沸10 min,进行Western blot检测,步骤同“1.2.6”。
1.2.8肝脏及其它器官组织HE染色 将小鼠肝脏、肺、脾、心脏和肾脏组织石蜡包埋、切片,石蜡切片于二甲苯中脱蜡10 min,依次用梯度乙醇水化,使用苏木精染色,经流水洗去染料,0.1%的盐酸乙醇分化,流水冲洗后,0.5%伊红染液浸泡,流水冲洗多余染液,依次经梯度乙醇脱水,再经二甲苯浸泡,最后中性树脂封片。待树脂风干后,使用正置荧光显微镜观察并拍照。
2 结果
2.1 HSC特异性敲除Grk2小鼠的一般情况Grk2fl/fl/Lrat-Cre小鼠与Grk2fl/fl小鼠每日正常饮水,体质量无明显差异,生长发育良好,性情无变化。Grk2ΔHSC雌鼠每胎产4~9只小鼠,成活率>90%。
2.2 HSC特异性敲除Grk2小鼠基因鉴定6~8周的Grk2fl/-/Lrat-Cre小鼠与Grk2fl/fl小鼠交配产生子代基因型鉴定结果见Fig 2。使用flox引物和Cre引物进行PCR扩增,琼脂糖凝胶电泳对基因型进行鉴定。若有Lrat-Cre重组酶基因,可扩增出391 bp的目的片段。若小鼠基因型为Grk2fl/fl纯合子,则仅扩增出431 bp的目的片段,若小鼠基因型为Grk2fl/-杂合子,则能同时扩增出431 bp和326 bp的片段。Fig 2中1、2、3、4、5均为带有391 bp的Lrat-Cre基因目的条带,其中1、3带有431 bp的Grk2fl/fl基因目的条带。结果提示,1和3为Grk2ΔHSC小鼠,2、4、5为Grk2fl/-/Lrat-Cre杂合子小鼠。
2.3 免疫荧光双染与Western blot验证HSC中GRK2的表达HSC为肝脏非实质细胞,其中Desmin是HSC标记蛋白之一[7]。Fig 3免疫荧光结果显示,Grk2fl/fl小鼠肝组织中Desmin(绿色荧光)与GRK2(红色荧光)具有明显共定位(白色箭头),而Grk2ΔHSC小鼠肝组织中未见明显的Desmin和GRK2共定位,提示Grk2ΔHSC小鼠HSC中GRK2的表达明显降低。为进一步确证HSC中GRK2已被敲除,分离Grk2ΔHSC小鼠的原代HSC,提取蛋白,利用Western blot检测GRK2蛋白表达。Fig 4结果显示,Grk2fl/fl对照组小鼠原代HSC中表达GRK2;与Grk2fl/fl小鼠相比,Grk2ΔHSC小鼠HSC中GRK2蛋白的表达明显降低,提示成功构建了Grk2ΔHSC小鼠模型。
2.4Grk2ΔHSC小鼠其他器官GRK2蛋白水平为了观察HSC中特异性敲除Grk2对其他器官组织中GRK2表达的影响,Western blot检测了其他主要组织中GRK2的表达情况。如Fig 5所示,在肺、脾、肾脏和心脏组织中,两组小鼠GRK2蛋白的表达差异无显著性。提示HSC中敲除Grk2基因对小鼠其他器官组织中GRK2蛋白的表达无明显影响。
2.5Grk2ΔHSC小鼠肝脏及其他组织HE染色为分析HSC中Grk2敲除对小鼠肝脏组织的影响,HE染色观察Grk2ΔHSC小鼠肝脏组织形态。如Fig 6所示,Grk2ΔHSC和Grk2fl/fl小鼠肝组织中,均以中央静脉区为中心,呈放射状排列,肝小叶结构、形态正常,肝板排列整齐,肝细胞排列紧密,未见有变性、坏死、脂肪滴异常累积以及炎性细胞浸润。提示HSC特异性敲除Grk2对肝组织无明显影响。

Fig 2 Results of genotype identification of mice by PCR

Fig 3 Expression of GRK2 in HSC of Grk2ΔHSC mice by immunofluorescence double staining (×200)
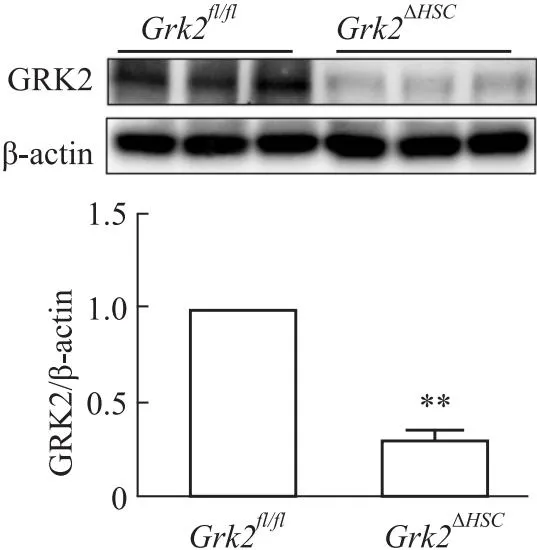
Fig 4 Expression of GRK2 in HSC of Grk2ΔHSC mice n=6)
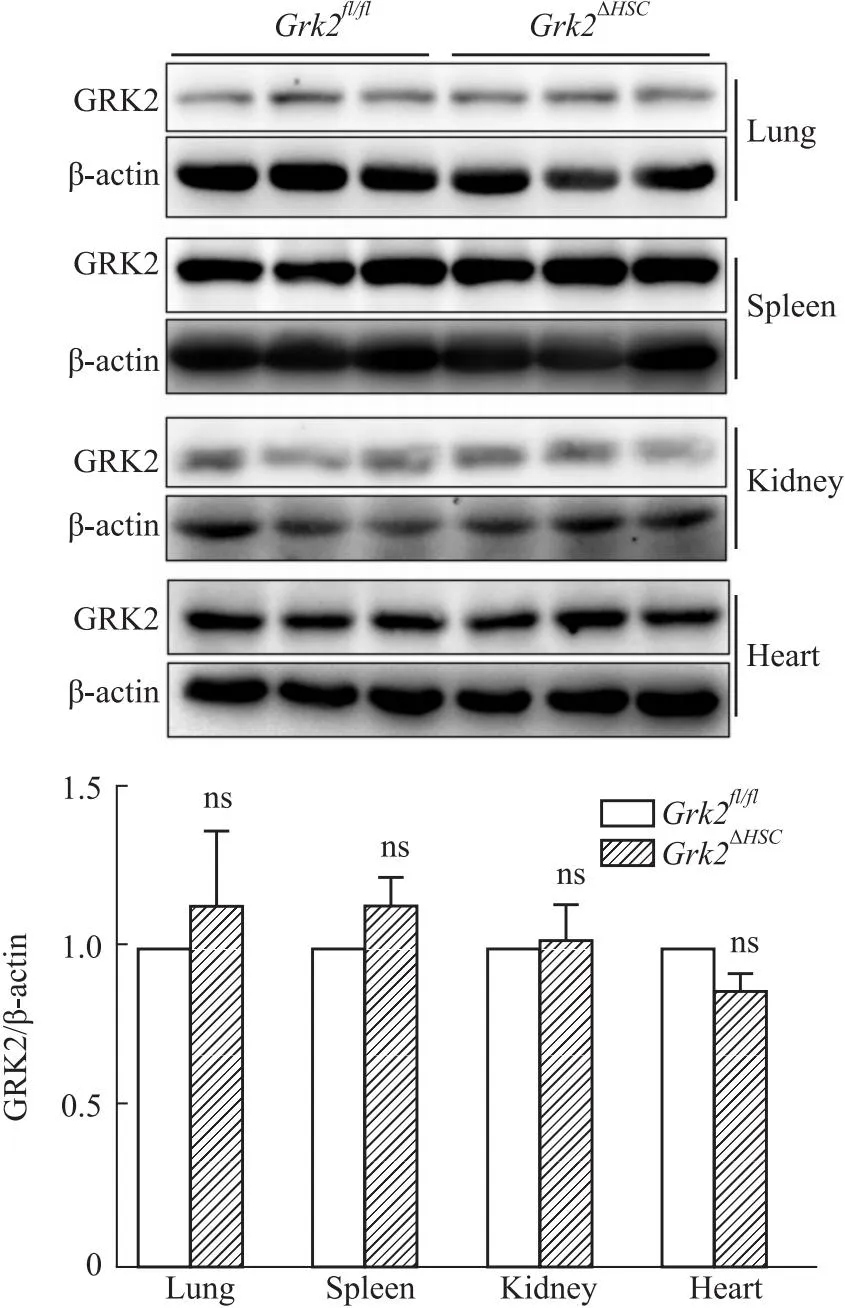
Fig 5 Expression of GRK2 in other tissue n=6)
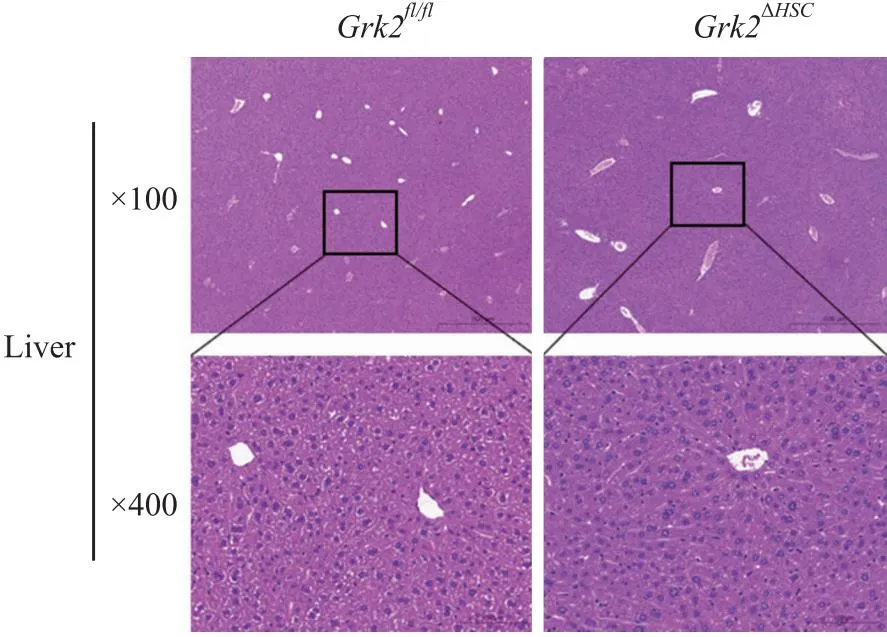
Fig 6 HE staining results in liver tissue of Grk2ΔHSC and Grk2fl/fl mice
为进一步明确HSC特异性敲除Grk2对其他组织是否有影响,HE染色观察小鼠肺、脾、心脏和肾脏组织。如Fig 7所示,Grk2ΔHSC小鼠与Grk2fl/fl小鼠肺组织中肺泡未见有增大,组织结构正常,间质无明显增宽等病变;两组小鼠脾组织中红、白髓边界清晰,生发中心清晰可见,脾索网络结构良好;心肌细胞排列整齐,大小无明显差异;两组小鼠肾小球形态完整无损伤,肾小管排列紧密无异常,未见炎性细胞浸润。以上结果表明,Grk2ΔHSC小鼠与Grk2fl/fl小鼠中其他器官组织学形态无明显改变。提示HSC特异性敲除Grk2基因小鼠并未影响肝脏及主要器官组织学形态。
3 讨论
由于小鼠和人类之间的遗传和病理生理学的相似性,基因工程小鼠模型通常是研究人类疾病的首选。然而,某些基因的全身性敲除小鼠可能会引起胚胎发育异常,纯合子致死等问题,导致没有存活的小鼠进行基因功能研究。由于基因的改变可能在不同的细胞和组织中发挥不同的作用,产生复杂的表型[9]。因此,细胞特异性敲除小鼠模型正逐渐成为研究的重要工具。Cre-loxP重组酶系统因其操作简单而被广泛应用于生物医学研究的基因编辑。Cre重组酶是整合酶家族的位点特异性重组酶,于1984年在噬菌体P1中发现,且是由噬菌体P38进行编码的单体蛋白[10]。单个38 ku的Cre重组酶识别两个重复的34个碱基对的loxP位点,介导相同方向的两个loxP位点之间的DNA片段缺失,或两个倒置的loxP位点之间的DNA片段翻转[11]。

Fig 7 Histopathological examination results of lung, spleen, heart and kidney tissues in Grk2ΔHSC and Grk2fl/fl mice (×200)
肝脏是维持全身生理稳态的中枢器官,是一个高度结构化的器官,其最小结构单位是呈六边形的肝小叶。肝细胞占肝组织大部分,排列在沿小叶轴径向延伸的肝板中[12]。肝脏内的间质细胞包括HSC、成纤维细胞和血管平滑肌细胞等。HSC位于肝细胞和血窦之间的窦周间隙。在正常肝脏中,HSC有助于协调肝脏发育,维持细胞外基质正常结构[13]。HSC也分泌生长因子和细胞因子,并作为类维生素A或含维生素A代谢物的主要储存库。肝损伤后,HSC会失去含类维生素A的脂滴,分化为肌成纤维细胞。活化后的HSC表达α平滑肌肌动蛋白,并合成大量的胶原纤维,进而促进肝纤维化形成[14]。如果肝损伤得到改善,HSC数量将由于细胞凋亡而减少,剩余的将少部分去分化变为未激活的HSC,这些静止的HSC有助于去除纤维化瘢痕并重建HSC基底细胞外基质支架[15]。
本课题组前期研究发现,猪血清诱导的免疫性肝纤维化大鼠肝脏组织和原代HSC中GRK2表达水平随造模时间的延长有下降趋势,提示GRK2的表达变化可能在肝纤维化发生发展中具有重要的调控作用[16]。有研究表明,腺苷A2A受体的激活促进HSC产生胶原,从而参与肝纤维化的发生发展[17]。结合Khoa等[18]研究发现,GRK2磷酸化腺苷A2A受体使其脱敏,提示GRK2可能通过调节腺苷A2A受体脱敏从而参与肝纤维化。本研究采用两个方向相同的loxP位点标记在Grk2基因的两端,Lrat-Cre酶在HSC内识别并切除在两个loxP位点间的目的基因,产生Grk2基因缺失的重组DNA。选用Lrat-Cre工具鼠与Grk2fl/fl小鼠进行多代繁育和基因鉴定,最终得到Grk2ΔHSC小鼠。
本实验采用免疫荧光双染和Western blot检测小鼠HSC中GRK2的表达,结果显示与对照组相比,实验组小鼠HSC中GRK2水平明显降低,而在肺、脾、肾脏和心脏的表达变化差异无显著性,表明HSC特异性敲除Grk2基因小鼠表型符合预期。Grk2ΔHSC小鼠生长发育良好,子代存活率高。HE染色显示肝脏及主要器官组织(肺、脾、心脏和肾脏)结构正常,未见细胞变性、坏死和炎性细胞浸润等病变,与Grk2fl/fl小鼠组织形态学无明显差异。本研究为后续研究GRK2在肝脏疾病中的潜在作用提供了小鼠模型,后续研究将继续探讨HSC特异性敲除Grk2基因对肝脏疾病进程的影响,以进一步明确GRK2在肝脏疾病中的功能机制。