苦参和土茯苓联用改善小鼠银屑病样皮损的作用机制
2024-01-22武兴康马瑜爽秦雪梅
武兴康,王 鹭,李 洋,马瑜爽,秦雪梅
(1. 山西大学化学生物学与分子工程教育部重点实验室,中医药现代研究中心,2. 地产中药功效物质研究与利用山西省重点实验室,3. 名优晋药再开发山西省重点实验室,山西 太原 030006)
银屑病是一种炎症介导的慢性、复发性、系统性的不可治愈性皮肤疾病,临床表现为皮肤局限或广泛分布鳞屑性红斑或斑块,在中国其发病率约为0.4%[1]。除皮肤症状外,还可以合并其他系统异常,如伴内脏及关节损害,中重度银屑病患者可合并其他相关疾病,如代谢综合征、心血管疾病等。银屑病的确切病因与发病机制尚未完全阐明,遗传背景、环境诱因等因素相互作用,最终形成角质形成细胞异常增殖与皮肤免疫微环境正反馈环路,主要表现为炎症、氧化应激、代谢紊乱等[1]。中医病机为燥湿互化引起的血热、血毒、血瘀等[2]。由于银屑病患病人群呈现年轻化,反复发作,经久不愈,其治疗以确保患者安全为首要,尽量控制病情和避免复发。国家中医局规定银屑病为中医治疗的优势病种,外用药物是银屑病首选治疗方法,安全性高,患者依从性好,但患者可选择药物少,近30多年全球仅上市1个外用新药:本维莫德乳膏[3]。本维莫德乳膏疗效优于银屑病外用药“金标准”卡泊三醇,但仍存在不足,无应答率为30%~70%,不良反应率约38.7%[4]。因此,发展新的药物用于银屑病的外用治疗是患者的需求。
苦参(SophoraeFlavescentisRadix,SF)和土茯苓(RhizomaSmilacisGlabrae,RSG)都是皮肤科常见中草药,两者联用的方剂中多采用汤剂的方法治疗皮肤疾病且比例多为1 ∶1。根据银屑病的中医理论可推断出中药治疗银屑病应从“清热凉血解毒”入手从而达到“降燥祛湿”。研究报道使用凉血方治疗“血热型”银屑病的临床显效率达82%[5],在治疗银屑病的中药方剂中主要归经为肝、心、胃、肺等[6],苦参、土茯苓主要功效为清热凉血、清热燥湿等,主要归心、肝、胃经,20版药典中记载两者都用于治疗疥癣等皮肤病,是《中国银屑病诊疗指南(2018完整版)》推荐的银屑病进行期的中药药浴疗法的常用中药。蔺依等[7]发现苦参-土茯苓组合是中药外治寻常型银屑病使用频次>20的药物组合之一,然而苦参和土茯苓联用外治银屑病的系统研究尚未有文献报道。本研究采用咪喹莫特乳膏诱导的银屑病样皮损小鼠模型,评价苦参和土茯苓联用外治银屑病的作用,并利用代谢组学探索其作用机制。
1 材料与方法
1.1 动物BALB/C小鼠(♂,5~6周龄,SPF级)购于北京维通利华实验动物技术有限公司,SCXK(京)2021-0006。实验开始前适应性饲养1周,饲养环境温度为(25±2)℃,湿度为55%±5%,12 h明暗交替光照,实验期间动物自由摄食和饮用水。动物实验遵循山西大学动物伦理委员会的规定并通过动物实验伦理审查(批号: SXULL2022019)。
1.2 试剂咪喹莫特乳膏(IMQ cream,5%)购于四川明欣药业有限责任公司,本维莫得乳膏(tapinarof,0.1%)购于广东中昊药业有限公司,苏木精-伊红(HE)染色试剂盒购于北京索莱宝科技有限公司,Ki67抗体(ab92742)和Goat Anti-Rabbit IgG H&L抗体(ab205718)购于Abcam公司,CD3抗体(60181-1-Ig)和DAB溶液(PR30010)购于武汉三鹰生物技术有限公司。
1.3 药物制备及成分鉴定苦参和土茯苓药材采购于北京同仁堂,原料药粉碎成粗粉,加5倍量双蒸水,煎煮2次,每次2 h,合并滤液,浓缩至适量,冷冻干燥至粉末。称取凡士林,水浴加热熔融后,分别加入苦参、土茯苓和苦参土茯苓1 ∶1混合物的冷冻干燥粉末至5%的浓度[8],搅拌均匀至冷却,制备而成5%的苦参软膏、土茯苓软膏和苦参土茯苓软膏,4 ℃储存。使用UPLC-MS对其水提物进行结构鉴定,流动相为0.01 moL·L-1乙酸铵水和0.01 mol·L-1乙酸铵乙腈,流速为0.3 mL·min-1,质谱离子源温度为500 ℃,扫描范围为50~1 500 Da,根据Mass Bank、HMDB等数据库进行化合物的比对离子碎片。
1.4 银屑病小鼠模型的构建银屑病进行期的小鼠模型的构建,脱去小鼠背部毛发,面积约为3 cm2,适应2 d后将62.5 mg咪喹莫特乳膏涂抹于小鼠背部,连续涂抹6 d,诱导小鼠银屑病样皮损的发生[9]。咪喹莫特乳膏处理后8 h给予药物治疗,将62.5 mg的药膏涂抹于小鼠背部,连续治疗6 d,咪喹莫特乳膏处理前通过PASI评分评价小鼠银屑病的严重程度。
银屑病复发期的小鼠模型的构建,选取另一批小鼠经上述造模和治疗6 d后的小鼠,第7天停止造模和治疗,恢复14 d使得小鼠银屑病皮损自愈。然后,所有小鼠背部涂抹低剂量(20.8 mg)的咪喹莫特乳膏,连续6 d,诱导银屑病的复发。
两次取样前12 h进行空腹处理,采用眼眶取血的方法收集小鼠血清,剪取小鼠被处理部分的背部皮肤分为两部分,一部分置于-80 ℃保存,另一部分收集在4%的多聚甲醛中。
1.5 实验分组与药物处理实验动物分为6组:健康组(Health)、模型组(Model)、本维莫德组(Tapinarof),苦参组(SF)、土茯苓组(RSG)和苦参土茯苓组(SF+RSG),每组6只小鼠。健康组造模治疗过程中均涂抹62.5 mg凡士林;模型组造模时涂抹62.5 mg咪喹莫特乳膏,治疗时涂抹62.5 mg凡士林;阳性药物组、苦参组、土茯苓组和苦参土茯苓组造模时涂抹62.5 mg咪喹莫特乳膏,治疗时分别涂抹62.5 mg的本维莫得乳膏、苦参软膏、土茯苓软膏和苦参土茯苓软膏。
1.6 PASI评分PASI评分量表由皮损面积、红斑程度、厚度和鳞屑程度4个指标组成。根据《银屑病PASI评分标准小程序》中皮损面积、红斑程度、厚度和鳞屑程度4个指标的严重程度进行选择,最后计算获得PASI评分。
1.7 HE染色皮肤组织固定于福尔马林溶液中,用石蜡包埋后切片,经脱蜡和复水后,HE染色试剂盒进行染色,经过乙醇脱水和二甲苯透明后,封片保存。显微镜观察并拍照分析。
1.8 免疫组化将组织固定于福尔马林溶液中,石蜡包埋后切片,经过脱蜡复水抗原修复后,ddH2O洗涤,加入透膜封闭液(50 g·L-1BSA)孵育60 min。去除透膜封闭液,TBST(25 mmol·L-1Tris、137 mmol·L-1NaCl、2.7 mmol·L-1KCl、0.5 mL·L-1Tween-20、pH 7.4)洗3遍。切片与一抗工作液4 ℃孵育过夜;去除一抗工作液,TBST洗3遍,加入二抗工作液室温孵育2 h;去除二抗工作液,TBST洗3遍。滴加适量DAB溶液,染色2~5 min后迅速用ddH2O冲洗干净;经过乙醇脱水和二甲苯透明后,封片保存。显微镜观察并拍照分析。
1.9 代谢组学样品制备与检测将血清从-80 ℃取出,于冰上融化,2 200 r·min-1涡旋5~10 s。取50 μL血清至另一离心管中,加入200 μL甲醇乙腈混合液(甲醇 ∶乙腈=1 ∶1),2 200 r·min-1涡旋混合2 min,13 000 r·min-1、4 ℃离心20 min。取上清液,将上清液用离心浓缩仪进行浓缩或氮吹干燥,用20%甲醇进行复溶后,13 000 r·min-1、4 ℃离心10 min,取上清用LC-MS检测分析。
色谱柱采用Waters ACQUITY UPLC®HSS T3柱(1.8 μm,2.1×150 mm),柱温50 ℃,流速0.35 mL·min-1,进样量5 μL,自动进样器温度4 ℃。洗脱条件:流动相A为含0.1%甲酸的水,流动相B为含0.1%甲酸的乙腈;0~1 min,5% B;1~22 min,5%~100% B;22~26 min,100% B;26~28 min,100%~5% B;28~30 min,5% B。
质谱仪采用Triple TOF 5600质谱仪(美国AB Sciex公司),离子源类型为ESI,毛细管电压5 500 V/-4 500 V,离子源温度450 ℃,辅助气N2,气帘气(CUR)30 psi,雾化气(GS1)55 psi,辅助气(GS2)55 psi,去簇电压(DP)60 V/-60 V,碰撞能量(CE)45/-50 eV,模式采用数据依赖性采集方案(IDA),TOF MS扫描范围100~1 500 Da。
1.10 代谢组学数据处理与分析使用HMDB(http://www.hmdb.ca/)数据库、MSDAIL软件、SCIEX OS软件进行代谢物数据收集,峰面积经归一化处理后,采用SIMCA软件进行数据主成分分析(principal component analysis,PCA)、偏最小二乘(partial least squares discrimination analysis,PLS-DA)和正交偏最小二乘法(orthogonal partial least squares-discriminant analysis,OPLS-DA)分析中的VIP(variable importance in the projection)> 1及t检验(P<0.05)进行差异代谢物的筛选,使用MetaboAnalyst 5.0 进行差异代谢物通路分析。
1.11 统计学分析数据分析和图表制作采用GraphPad Prism 8.0进行,多组间比较用Two-way ANOVA检验法分析或One-way ANOVA分析。
2 结果
2.1 苦参和土茯苓成分鉴定结果通过二级碎片质核比(m/z)比对,从苦参中检测出11个主要成分(Tab 1),分别为苦参碱、氧化苦参碱、氧化槐果碱、金雀花碱、臭豆碱、槲皮素、8-异戊烯基山奈酚、脱氧山奈酚、柚皮素、芒柄花黄素、鸡豆黄素。土茯苓中检测出10个主要成分(Tab 2),分别为落新妇苷、棕榈酸、胡萝卜苷、白藜芦醇、丁香酸、槲皮素、谷甾醇、亚油酸、油酸、阿魏酸。
2.2 苦参和土茯苓联用改善小鼠银屑病样皮损的研究为了探索苦参和土茯苓联用是否具有治疗银屑病的作用,采用咪喹莫特乳膏诱导的小鼠银屑病模型评价其药效(Fig 1A)。第7天小鼠背部图片显示,相比于健康小鼠,模型组小鼠背部皮肤红斑和鳞屑增多,苦参土茯苓联用组和阳性药物本维莫德均可以减少皮肤红斑和鳞屑,而苦参和土茯苓单用对皮肤红斑和鳞屑无明显作用(Fig 1B)。PASI评分结果表明,苦参土茯苓联用可降低小鼠银屑病的PASI评分,但药效作用弱于本维莫德(Fig 1C)。采用HE染色评价小鼠皮损处的皮肤结构,结果表明,模型组小鼠皮肤的表皮增厚,表皮突延长,并增多;苦参土茯苓联用可以减小表皮厚度,但作用弱于本维莫得;苦参和土茯苓单用对表皮厚度无明显影响(Fig 2)。综上,苦参和土茯苓联用改善小鼠银屑病样皮损,药效弱于本维莫德乳膏。

Tab 1 Main ingredients of SF
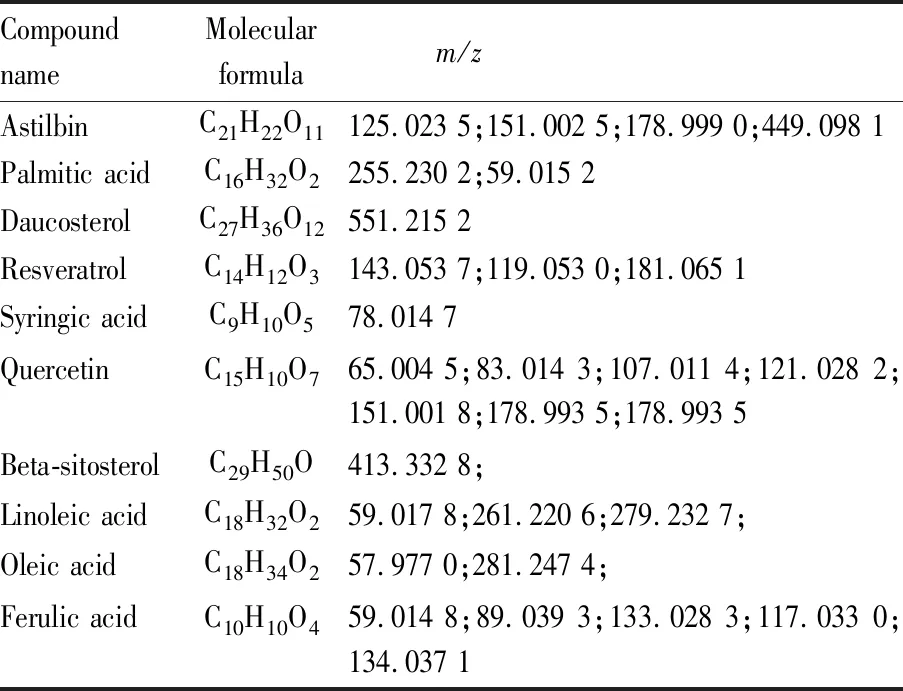
Tab 2 Main ingredients of RSG
2.3 苦参和土茯苓联用防治小鼠银屑病复发的研究为了评价苦参和土茯苓联用治疗银屑病治愈后疾病复发情况,小鼠于第7天停止造模治疗,恢复14 d至皮损自愈后,所有小鼠(包括健康组)给予低剂量(20 mg)咪喹莫特乳膏,诱发小鼠银屑病的复发(Fig 3A)。在造模和治疗期,模型组出现银屑病样皮损症状,苦参土茯苓联用缓解小鼠银屑病样皮损。由于咪喹莫特乳膏可诱导毛发形成[10],复发诱导过程中,除健康组外,其它组小鼠背部毛发形成,影响背部皮损PASI评分,因而采用皮肤镜观察皮损情况。结果显示,低剂量咪喹莫特乳膏诱导后,健康组皮肤无鳞屑无红斑,模型组皮肤红斑和鳞屑明显增多,本维莫德组和苦参土茯苓联用组的皮肤鳞屑较少(Fig 3B)。进一步,采用HE染色观察皮肤结构评价复发诱导后小鼠银屑病严重程度。结果表明,与健康组相比,模型组表皮增厚,表皮突延长(Fig 3C)。给药本维莫德组和苦参土茯苓联用后表皮厚度变薄,且两组的厚度一致,表皮突延长长度减小;而苦参组和土茯苓组的皮肤结构无明显变化(Fig 3C,D)。因此,苦参和土茯苓联用治疗小鼠银屑病后,小鼠银屑病复发程度减缓,且作用效果与本维莫德乳膏相当。
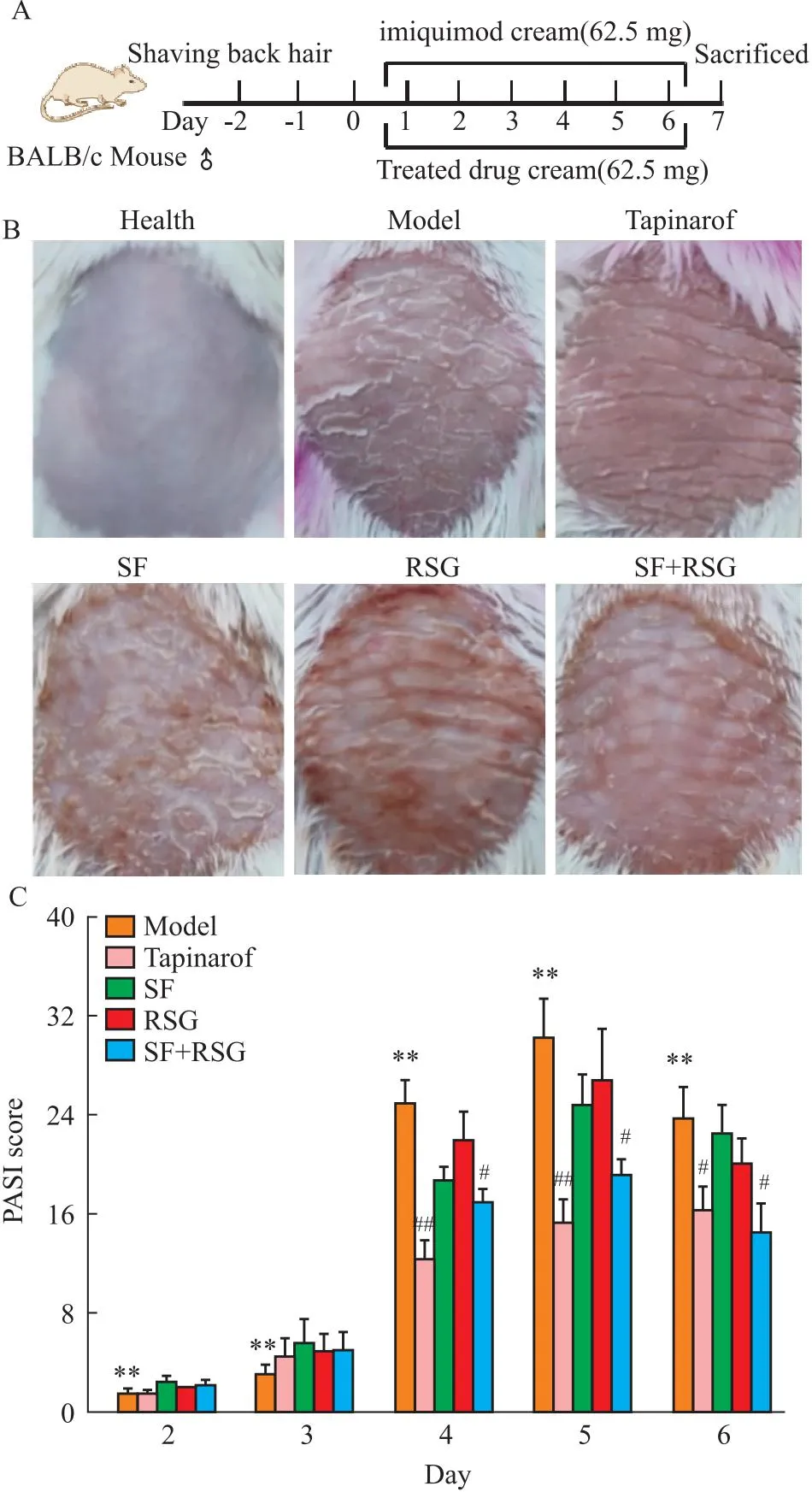
Fig 1 Combination of SF and RSG ameliorated skin lesion of IMQ-induced psoriasis-like
2.4 苦参和土茯苓联用抑制小鼠表皮细胞增殖外用苦参和土茯苓联用明显抑制小鼠银屑病皮损的表皮增厚,表皮角质形成细胞的过度增殖是引起银屑病表皮增厚的关键。为了评价苦参土和茯苓联用对表皮角质形成细胞增殖能力的影响,采用免疫组化检测皮肤中Ki67的表达量。结果表明,与健康组相比,治疗后和复发诱导后的模型组小鼠皮肤中Ki67的表达量明显升高,经本维莫德和苦参土茯苓联用治疗后小鼠皮肤中Ki67的表达量明显降低,且本维莫得效果较强;单用苦参和土茯苓治疗对Ki67的表达无影响(Fig 4)。经复发诱导后,与模型组相比,本维莫德组和苦参土茯苓联用组的小鼠皮肤中Ki67的表达量明显较低,且效果相当。综上,苦参和土茯苓联用抑制小鼠表皮角质形成细胞的增殖。

Fig 2 Combination of SF and RSG inhibited epidermal hyperplasia in skin of psoriatic mice
2.5 苦参和土茯苓联用抑制皮肤中T细胞的募集和活化T细胞的募集和活化是银屑病表皮细胞增殖的关键机制,如CD4+T细胞、Th17细胞和γδ T细胞是银屑病发生发展的关键细胞群,CD8+TRM细胞和Vγ4+Vδ4+T细胞是银屑病复发的关键细胞群[11]。结果表明,与健康组相比,治疗后和复发诱导后的模型组小鼠皮肤中CD3的表达量明显升高,经苦参土茯苓联用治疗后小鼠皮肤中CD3的表达量明显降低,单用苦参和土茯苓治疗降低CD3的表达,而本维莫得对CD3的表达无影响(Fig 5)。经复发诱导后,与模型组相比,本维莫德组和苦参土茯苓联用组的小鼠皮肤中CD3的表达量明显较低,且效果相当。综上,苦参和土茯苓联用减少皮肤中T细胞的数量,表明苦参和土茯苓联用抑制皮肤中T细胞的募集和活化。
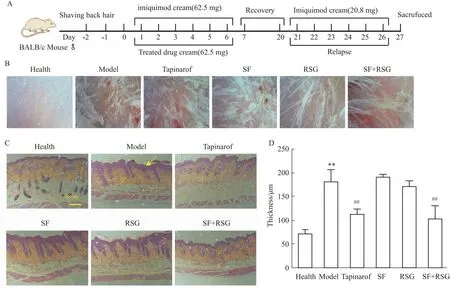
Fig 3 Combination of SF and RSG inhibited recurrent epidermal hyperplasia of psoriasis
2.6 血清代谢组学多元统计分析为了探索苦参和土茯苓联用延缓小鼠银屑病复发的作用机制,采用代谢组学技术评价诱导复发后小鼠血清代谢物轮廓的差异。应用OPLS-DA对各组血清样本进行代谢轮廓分析显示,健康组、模型组、本维莫德组和苦参土茯苓组明显分开,表明血清代谢物的变化与银屑病的发生发展预后相关(Fig 6A)。与模型组相比,苦参土茯苓组和本维莫德组的阴离子模式检测到的血清代谢物的调节趋势一致,而阳离子模式检测到的血清代谢物的调节趋势不一致,表明苦参土茯苓联用和本维莫德既有类似的作用机制,也有不同之处(Fig 6A)。
2.7 差异代谢物研究在银屑病发病中,与炎症相关的花生四烯酸代谢紊乱,二十二碳四烯酸等浓度发生变化,不饱和脂肪酸合成增加,形成氧化应激,磷脂酰胆碱和磷脂酰肌醇水平降低,必需氨基酸、棕榈酰肉碱等发生明显变化[12]。因此进行代谢组学研究,应用OPLS-DA分析苦参土茯苓组和模型组,发现两组代谢物轮廓明显分开(Fig 6B),表明苦参和土茯苓联用明显改善银屑病小鼠的代谢异常。分析得到健康组和模型组之间有22个差异代谢物(Tab 3),其中12个代谢物是苦参土茯苓组和模型组之间的差异代谢物(Fig 7)。苦参和土茯苓联用能够下调银屑病小鼠血清中的3-吲哚丙烯酸、二氢鞘氨醇、N-棕榈酰鞘氨醇、L-乙酰肉毒碱、鹅肌肽、马尿酸、肌醇-6-磷酸和色氨酸,上调银屑病小鼠血清中的14,15-EET、LPC 22 ∶6、LPC 22 ∶5/0 ∶0和LPC 22 ∶4/0 ∶0(Fig 7),表明苦参和土茯苓联用明显调节银屑病小鼠的代谢异常。
2.8 代谢通路研究应用Metaboanalyst数据库对差异代谢物进行分析。与银屑病复发明显相关的代谢通路主要花生四烯酸代谢、鞘脂代谢、色氨酸代谢、不饱和脂肪酸的生物合成、苯丙氨酸代谢、组氨酸代谢等,而苦参和土茯苓明显调节的代谢通路为:花生四烯酸代谢、鞘脂代谢、色氨酸代谢、苯丙氨酸代谢(Fig 8)。
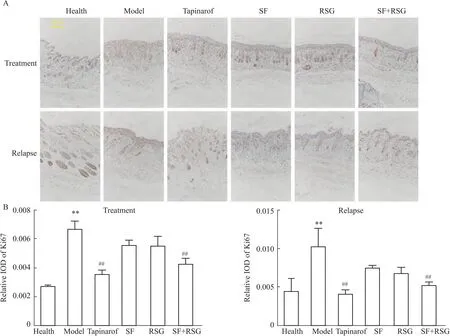
Fig 4 Combination of SF and RSG prevented proliferation of epidermal cells
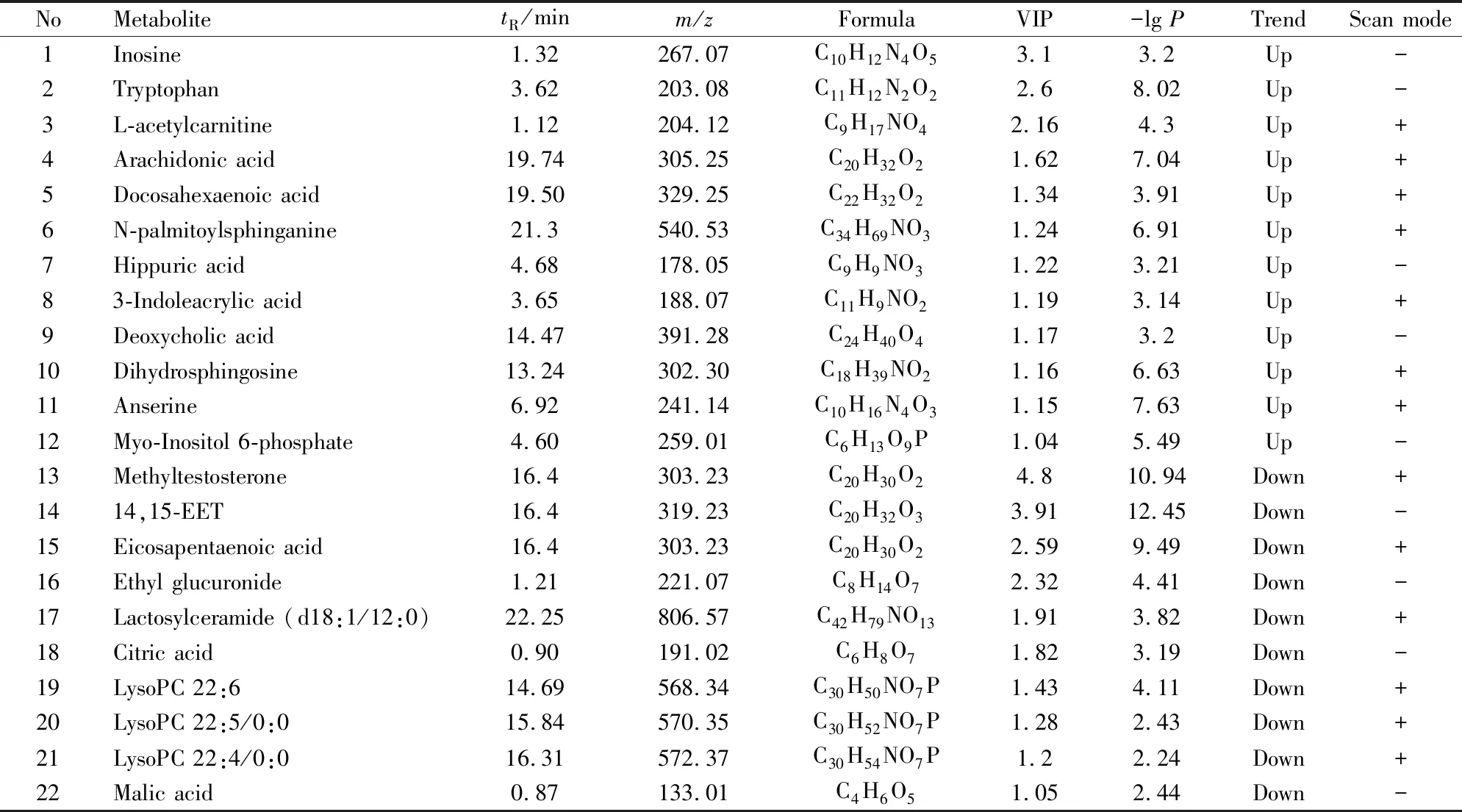
Tab 3 Differential serum metabolites associated with psoriasis
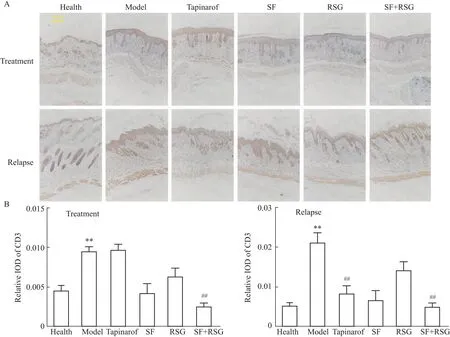
Fig 5 Combination of SF and RSG reduced T cell frequency in
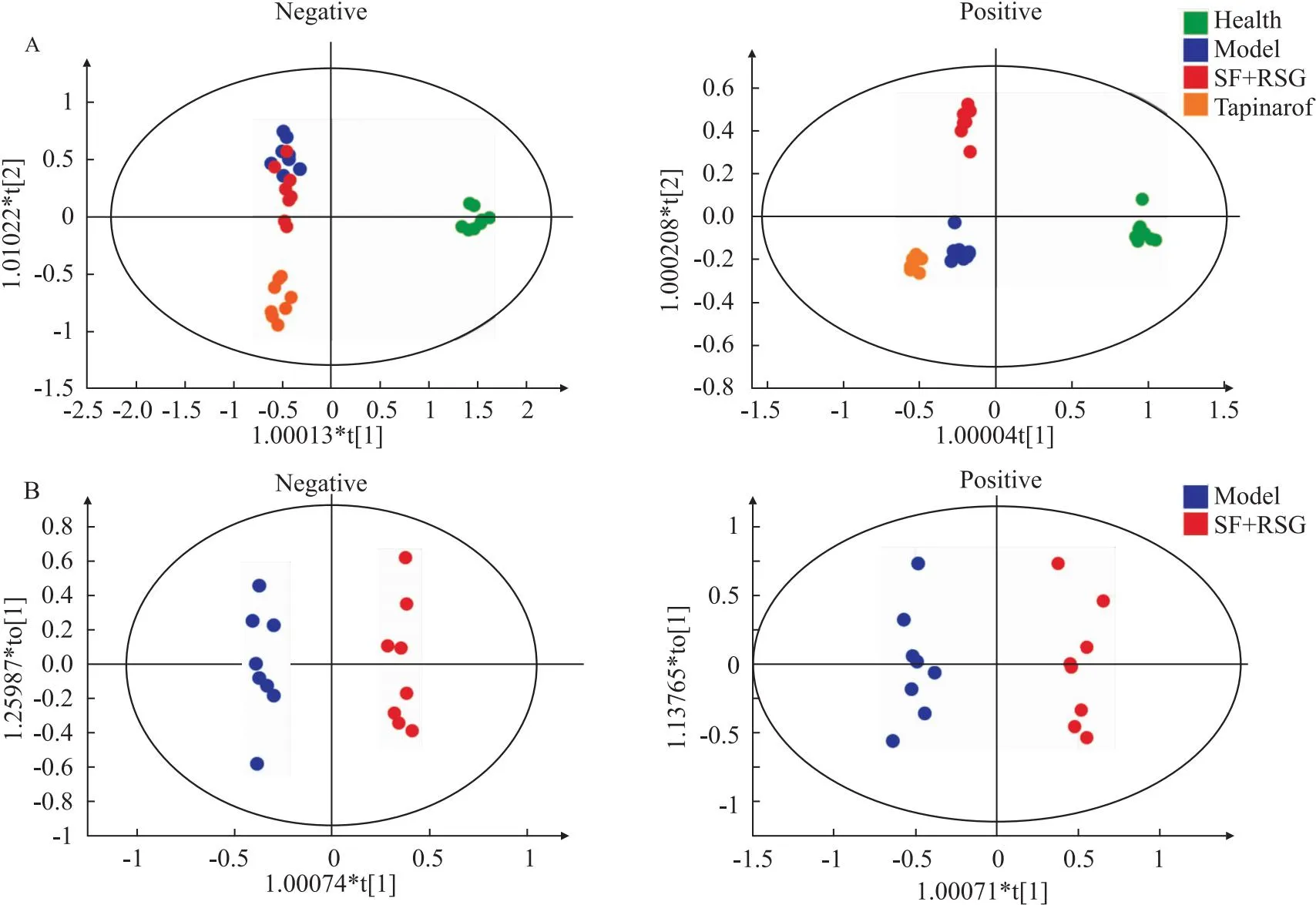
Fig 6 OPLS-DA score plots of plasma metabolic
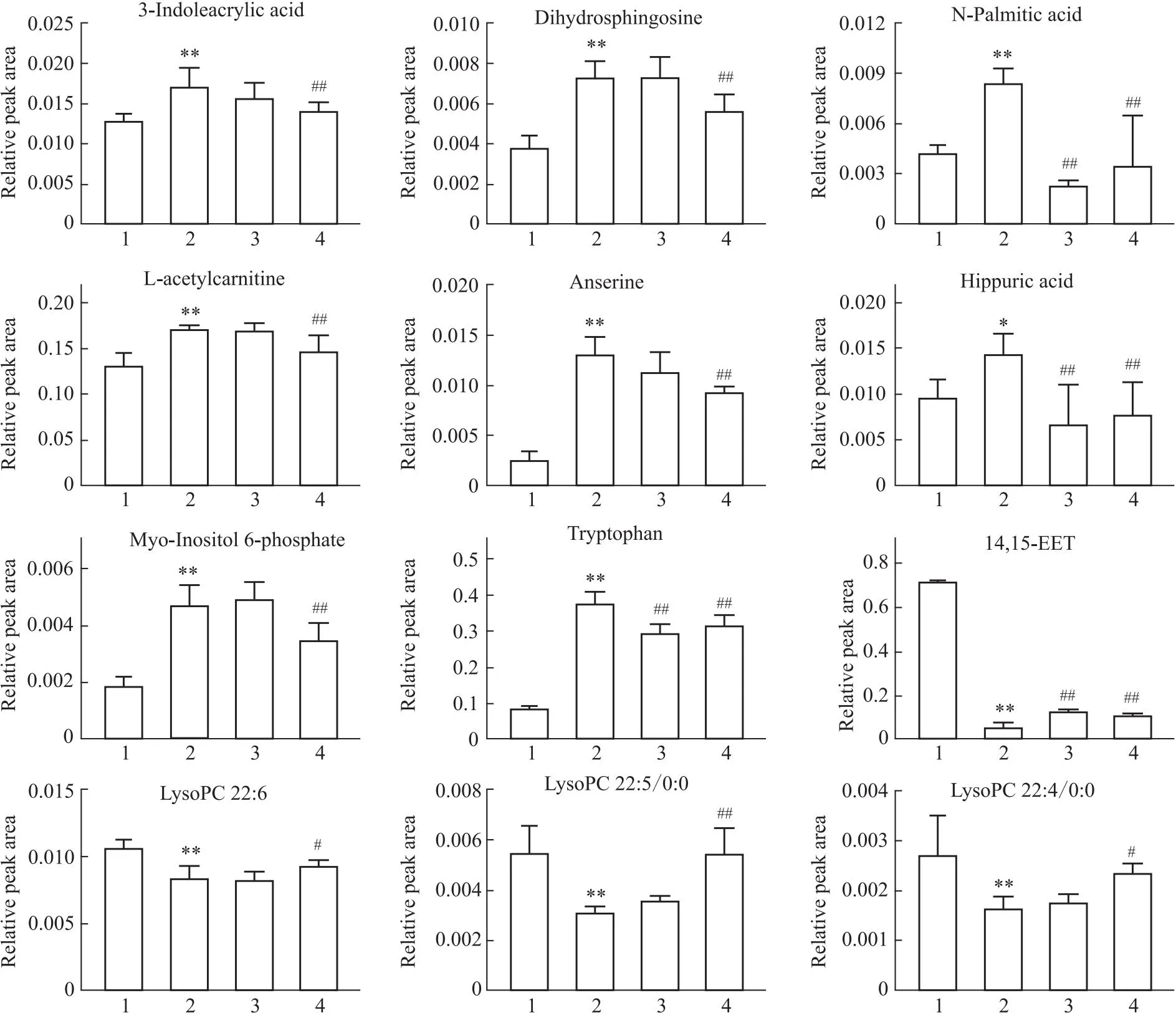
Fig 7 Relative peak areas of metabolites in serum regulated by
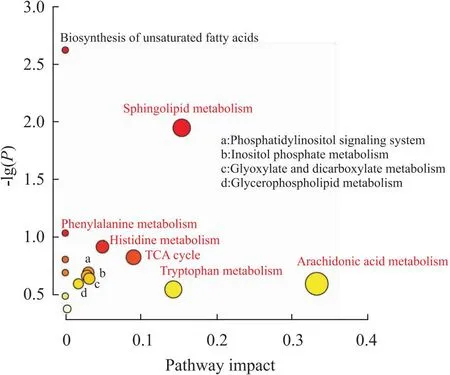
Fig 8 Metabolic pathways involved in psoriasis development and treatment
3 讨论
银屑病的复发是其治疗的难点,苦参和土茯苓联用治疗小鼠银屑病,虽然治疗作用弱于阳性药物本维莫德,但对治疗后小鼠银屑病复发的减缓作用与本维莫德相当。目前认为银屑病复发与炎症记忆有关,治愈的皮损部位存在记忆性CD8+T(CD8+TRM)细胞和炎症记忆性角质形成细胞,使得角质形成细胞能够快速响应银屑病诱导因素的刺激,形成细胞异常增殖与皮肤免疫微环境正反馈环路[13]。苦参和土茯苓降低皮肤中总T细胞的数量,说明苦参和土茯苓联用可能降低CD8+TRM的数量,从而减缓银屑病复发作用。
代谢途径可以控制免疫细胞和角质形成细胞的活化和分化,影响银屑病的发生发展。花生四烯酸代谢参与银屑病的多种病理过程:表皮细胞的分裂生长、角质形成细胞的炎症反应、T细胞的激活、中性粒细胞的募集等[14-15]。鞘脂代谢的关键产物,鞘氨醇-1-磷酸酯通过激活Ca2+信号通路抑制角质形成生长[16]。黄尿酸、5-羟基色氨酸等体内色氨酸代谢的关键产物是AhR的激动剂,激活AhR促进角质形成细胞的正常分化,诱导调节性T细胞的分化抑制Th17活化,已经成为银屑病外用药物的一个明显靶点[17-18]。本研究发现,苦参和土茯苓联用影响花生四烯酸、鞘脂、色氨酸、苯丙氨酸等代谢通路,表明苦参和土茯苓联用通过调节这四种代谢通路发挥抗银屑病作用。然而,本文结果只获得初步的代谢轮廓的改变,下一步应利用靶向代谢组学技术聚焦研究苦参和土茯苓联用如何调节这四条代谢通路。
综上所述,苦参和土茯苓联用改善小鼠银屑病样皮损,药效强于单用苦参和土茯苓,弱于阳性药物本维莫德;有效减弱小鼠银屑病痊愈后复发。苦参和土茯苓联用抑制小鼠表皮角质形成细胞的增殖和减少皮肤中T细胞的数量,其潜在分子机制为:调节花生四烯酸代谢、鞘脂代谢、色氨酸代谢、苯丙氨酸代谢等代谢通路(Fig 9)。本研究提供了一种减缓银屑病复发的潜在外用治疗药物,并初步阐明其作用机制。然而,本研究仍存在许多不足,针对苦参和土茯苓的配比,以及联用调节相关代谢通路减弱银屑病复发的分子机制,还需要进一步深入优化和研究,另外,还需要系统探索进行期和复发期银屑病小鼠的血清和皮损的代谢轮廓差异并阐明介导银屑病复发的关键代谢物。
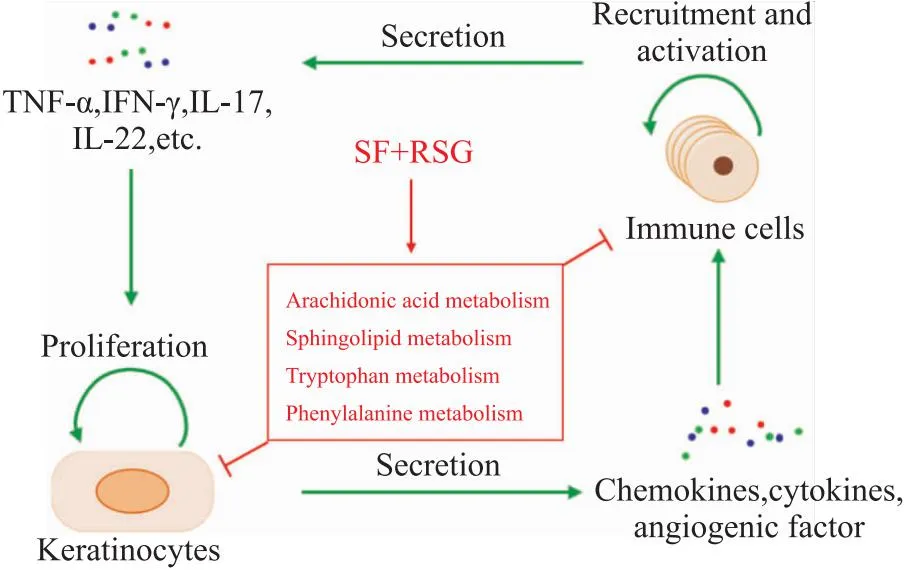
Fig 9 Proposed mechanisms for treating psoriasis via combination of SF and RSG