北苍术与朝鲜苍术健脾作用及机制研究
2024-01-22崔名杨丁奕辉徐志立
崔名杨,丁奕辉,曲 扬,徐志立,才 谦
(辽宁中医药大学药学院,辽宁 大连 116600)
北苍术[Atractylodeschinensis(DC.) Koidz.]与朝鲜苍术[Atractylodescoreana(Nakai) Kitam.]均为苍术属植物,药用部位是其干燥根茎[1]。北苍术与茅苍术被2020年版《中国药典》收录作为苍术药材使用。朝鲜苍术虽未被《中国药典》收录,但《中药大辞典》等书中对其有所记载[2]。经课题组前期调查确认,朝鲜苍术因其长势好、抗病虫害等优势,在一些地区常做北苍术使用,前期研究也表明,北苍术和朝鲜苍术均具有健脾作用,但朝鲜苍术作为北苍术使用是否合理,仍待进一步的实验验证。现代研究表明,采用非靶向代谢组学技术可以准确高效地定性、定量分析不同生物品种内小分子化合物的差异,该技术被广泛应用于食品、植物、微生物等研究领域[3-5]。钟薏文等[6]通过非靶向代谢组学的方法,分析筛选参苓白术散给药前后脾虚大鼠的潜在生物标志物,明确了参苓白术散治疗脾虚所涉及的代谢通路。因此,本研究从非靶向代谢组学的角度阐述北苍术与朝鲜苍术的健脾机制,并验证两者的健脾作用,为合理应用朝鲜苍术提供研究思路与实验参考。
1 材料
1.1 药材北苍术(采自湖北省罗田中药种植基地)、朝鲜苍术(采自辽宁省凤城市大梨树村种植基地)及番泻叶(购自国药控股国大药房有限公司,生产批号:20190501),均由辽宁中医药大学药用植物教研室许亮教授鉴定分别为菊科植物北苍术Atractylodeschinensis(DC.) Koidz.的干燥根茎、菊科植物朝鲜苍术Atractylodescoreana(Nakai) Kitam.的干燥根茎,以及豆科植物狭叶番泻CassiaangustifoliaVahl的干燥小叶。
1.2 实验动物SPF级♂ SD大鼠40只,6周龄,体质量160~200 g,购自辽宁长生生物技术有限公司[生产许可证号:SCXK(辽)-2021-0004],在辽宁中医药大学动物实验中心适应性喂养,室温20~23 ℃、相对湿度55%。实验经辽宁中医药大学实验动物伦理委员会批准,伦理批准号:2019YS(DW)-028-01。
1.3 试剂白细胞介素6(interleukin 6,IL-6)ELISA试剂盒(批号:21102850N)、免疫球蛋白G(immunoglobulin G,IgG)ELISA试剂盒(批号:21102835N)、胃动素(motilin,MTL)ELISA试剂盒(批号:21102859N)、淀粉酶(amylase,AMS)ELISA试剂盒(批号:21102840N)、血管活性肠肽(vasoactive intestinal peptide,VIP)ELISA试剂盒(批号:21102842N)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)ELISA试剂盒(批号:21102852N),均购自上海科兴商贸有限公司;甲醇(货号:67-56-1)、乙腈(货号:75-05-8),均购自CNW Technologies公司;氨水(货号:1336-21-6)购自Fisher Chemical公司;乙酸铵(货号:631-61-8)购自Sigma-Aldrich。
1.4 仪器十万分之一电子天平(德国Sartorius,型号:CP225D);高速万能粉碎机(温岭市林大机械有限公司,型号:DFT-200);隔水式恒温培养箱(上海精宏实验设备有限公司,型号:GNP-9080);酶标仪(芬兰Labsystems Multiskan MS,型号:352型);微量高速离心机(长沙湘智离心机仪器有限公司,型号:TG16W);超高效液相(Thermo Fisher Scientific公司,型号:Vanquish);高分辨质谱(Thermo Fisher Scientific公司,型号:Q Exactive HFX)。
2 方法
2.1 药液的制备取北苍术与朝鲜苍术的干燥粉末,根据大鼠与人之间每千克的体质量剂量的换算系数为6.25,加入蒸馏水,分别制成浓度为0.375 kg·L-1的北苍术混悬液与朝鲜苍术混悬液,临用现配[7]。将番泻叶清洗干净,加入8倍量的水后,沸腾煎0.5 h,过滤掉滤渣,将滤液浓缩成番泻叶水煎液,其浓度为0.125 kg·L-1[8]。
2.2 动物分组、造模及给药大鼠适应性喂养1周后,根据随机对照原则分为4组,每组10只,分别为正常对照组、模型组、北苍术组和朝鲜苍术组。正常组大鼠正常饲养,保持自由进食和饮水,其余组大鼠使用饮食不当、疲劳过度加苦寒泻下的复合因素法造成脾虚症模型[8]。造模方法为:单日灌胃猪油,双日游泳到力竭并给予甘蓝进食,保持游泳的水温与大鼠体温基本一致,2 d为1个周期,共进行7个周期。从15 d开始灌胃番泻叶水煎剂(10 mL·kg-1),每天1次,共7 d,完成造模。造模成功后,两个给药组分别灌胃北苍术混悬液和朝鲜苍术混悬液(10 mL·kg-1),每天1次,共7 d。
2.3 血浆样品采集各组大鼠禁食不禁水24 h,吸入乙醚麻醉后,进行腹主动脉取血,4 000 r·min-1离心10 min,取上清血浆在-80 ℃保存备用。
2.4 血浆生化指标检测采用ELISA法检测各组大鼠血浆中胃肠道指标AMS、MTL、VIP,以及免疫学指标IgG、IL-6、TNF-α的变化情况,严格按照试剂盒说明书操作。
2.5 血浆代谢组学样品处理将采集后得到的血浆样品在室温下解冻,吸取200 μL于1.5 mL EP管中,加入600 μL甲醇,涡旋震荡30 s,12 000 r·min-1离心10 min,转移上清液于40 ℃下氮气吹干,用100 μL甲醇将剩余残渣溶解,并涡旋震荡1 min,12 000 r·min-1离心10 min,转移上清液于进样小瓶中待检测。等量吸取各组中每个血浆样本,混合后作为质控(quality control,QC)样本。
2.6 色谱条件使用Vanquish超高效液相色谱仪,通过Waters ACQUITY UPLC BEH Amide (2.1 mm×100 mm,1.7 μm)液相色谱柱对目标化合物进行色谱分离。液相色谱由含有25 mmol·L-1乙酸铵、25 mmol·L-1氨水的水相(A相),以及乙腈(B相)组成。样品盘温度为4 ℃,进样量为2 μL。
2.7 质谱条件通过Thermo Xcalibur软件控制的Thermo Q Exactive HFX质谱仪收集一级和二级质谱数据。具体参数为:鞘气流速:30 Arb;辅助气流速:25 Arb;毛细管温度:350 ℃;全毫秒分辨率:60 000;MS/MS分辨率:7 500;碰撞能量:在NCE模式下10/30/60;喷雾电压:3.6 kV(正极)或-3.2 kV(负极)。
2.8 数据处理本实验对正、负离子模式下的血浆样本进行分析,原始数据经ProteoWizard软件转成mzXML格式后,使用自主编写的R程序包(内核为XCMS)进行峰识别、峰提取、峰对齐和积分等处理,然后与BiotreeDB(V2.1)自建二级质谱数据库匹配,进行物质注释,算法打分的Cutoff值设为0.3。数据经标准化处理后,导入SIMCA(16.0.2)软件进行主成分分析(principal component analysis,PCA)和正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)。
2.9 潜在生物标志物分析在血浆样本进行OPLS-DA分析后,对结果进行200次置换检验,评估OPLS-DA模型是否存在过拟合现象。在验证模型不存在过拟合现象后,采取OPLS-DA模型第一主成分的变量投影重要度(VIP)和P值相结合的方法,筛选差异代谢物。筛选标准:选取同时满足P<0.05和VIP>1的离子。以模型组与空白组的组间差异代谢物作为与脾虚相关的潜在生物标志物,同时分析北苍术和朝鲜苍术对潜在生物标志物的调节作用。采用京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)Pathway数据库(http://www.kegg.jp/kegg/pathway.html)对以上潜在生物标志物进行代谢途径分析。
3 结果
3.1 对胃肠道指标AMS、MTL、VIP的影响Tab 1结果显示,与正常组相比,模型组大鼠血浆中MTL、VIP水平明显升高(P<0.01),AMS水平明显降低(P<0.01)。与模型组相比,北苍术组和朝鲜苍术组大鼠血浆中MTL、AMS水平均明显升高(P<0.01),VIP水平明显降低(P<0.01)。朝鲜苍术组大鼠血浆中MTL水平明显高于北苍术组(P<0.05),AMS水平明显低于北苍术组(P<0.01)。
3.2 对免疫学指标IgG、TNF-α和IL-6的影响与正常组相比,模型组大鼠血浆中IL-6、TNF-α水平明显升高(P<0.01),IgG水平明显降低(P<0.05)。与模型组相比,北苍术组和朝鲜苍术组大鼠血浆中IgG水平均明显升高(P<0.01或P<0.05),TNF-α水平均明显降低(P<0.01),IL-6水平差异无统计学意义(P>0.05)。朝鲜苍术组大鼠血浆中TNF-α水平明显高于北苍术组(P<0.01),IgG水平明显低于北苍术组(P<0.05)。见Tab 2。
3.3 血浆样品的总离子流图血浆样品采用超高效液相色谱串联Q Exactive质谱仪(UPLC-QE-MS)分析,Fig 1为正、负离子模式下各组样本的总离子流图(total ion chromatogram,TIC)。
3.4 PCA分析PCA是一种统计方法,通过正交变换将观测到的一组可能有关联的变量转变成线性不相关的变量(即主成分)。Fig 2为正负离子模式下大鼠血浆的PCA得分散点图,图中呈现的样本基本处于95%置信区间之内,各组样本组内聚集较集中,组间分离程度较好,说明各组的血浆代谢物间存在明显差异,QC样本聚集较好,说明仪器稳定,实验结果可靠。
3.5 OPLS-DA分析通过OPLS-DA可以过滤出与分类变量无关的正交变量,进而分开分析正交与非正交变量,以获得更确切的代谢物组间差异以及实验组相关程度的信息。正、负离子模式下的各组大鼠血浆的OPLS-DA得分散点图如Fig 3所示,正常组和模型组的样本点完全分开,说明脾虚会导致大鼠潜在生物标志物发生改变。北苍术组和朝鲜苍术组的样本点与模型组完全分开,说明北苍术和朝鲜苍术都可以通过调节脾虚大鼠的潜在生物标志物来改善脾虚。北苍术组与朝鲜苍术组的样本点完全分开,说明二者对脾虚大鼠代谢通路的调节存在差异。从OPLS-DA得分图的结果可以看出,两组样本区分非常明显,并且全部处于95%置信区间之内。
置换测试随机模型的Q值都低于原始模型的Q值;Q的回归线与纵轴之间的截距低于0;同时,随着置换保留度的逐渐减小,置换的Y变量的比率增加,随机模型的Q逐渐减小。结果表明,原始模型具有良好的稳健性,不存在过拟合现象。Fig 4为正、负离子模式下正常组/模型组的OPLS-DA分析模型验证图。
3.6 潜在生物标志物筛选依据OPLS-DA模型结果,以VIP>1且P<0.05为标准,筛选正、负离子模式下的组间血浆差异代谢物。其中模型组与正常组相比,共筛选出180个血浆差异代谢物,作为与脾虚相关的潜在生物标志物;经北苍术与朝鲜苍术给药干预后,分别回调了70个和82个潜在生物标志物,其中共同调节的潜在生物标志物为52个。通过将北苍术与朝鲜苍术调节的潜在生物标志物聚类层次分析绘制的聚类热图,可以使结果更具可视化,见Fig 5。
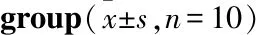
Tab 1 Determination of AMS, MTL and VIP contents in plasma of rats in each
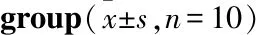
Tab 2 Determination of IgG, TNF-α and IL-6 contents in plasma of rats in each
Fig 1 Total ion flow chart of plasma in positive and negative ion modes of rats in each group

Fig 2 Scatter plot of PCA scores in plasma positive and negative ion modes of rats in each group
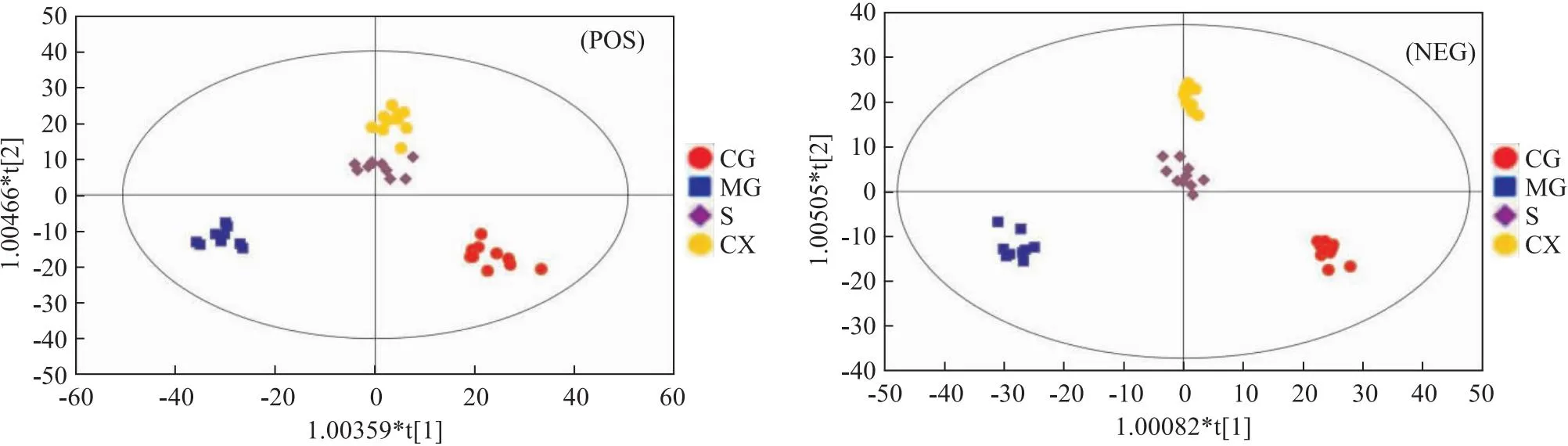
Fig 3 Scatter plot of OPLS-DA scores in plasma positive and negative ion modes of rats in each group

Fig 4 200 corresponding ranking test charts for blank/model groups in positive and negative ion modes

Fig 5 Regulatory effects of Atractylodes chinensis (A) and Atractylodes coreana (B) on different metabolites in rats with spleen deficiency
3.7 代谢通路分析将筛选出的差异代谢物名称输入Pathway数据库进行代谢通路分析,以Impact>0.1且-ln(p)>1为条件,筛选关键代谢通路。结果表明,北苍术的代谢途径涉及甘氨酸、丝氨酸和苏氨酸代谢及硫胺素代谢;朝鲜苍术的代谢途径涉及甘氨酸、丝氨酸和苏氨酸代谢,嘧啶代谢,丁酸代谢,核黄素代谢及硫胺素代谢,见Tab 3。
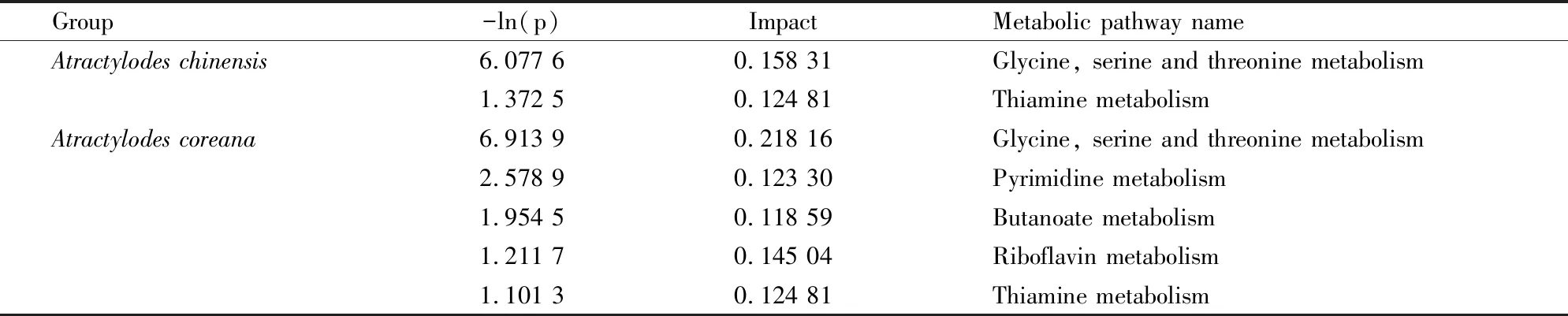
Tab 3 Key metabolic pathways of spleen deficiency regulated by Atractylodes chinensis/Atractylodes coreana
4 讨论
中医临床通常根据症状来判断脾虚,脾虚患者会表现出食欲减弱、脘腹隐痛、倦怠乏力、畏寒肢冷等症状[9],大多数是由于饮食失调、体虚劳累、忧思过度或者久病不愈等原因引起的[10]。本实验通过综合脾虚的临床症状与病因、朝鲜苍术和北苍术的功效作用等多方面因素,选取饮食不节、疲劳过度加苦寒泻下的复合方法制备脾虚大鼠模型。已有文献证明,该方法所造成的的脾虚模型症状与中医脾虚临床症状基本相符[11]。
本课题组前期研究表明,北苍术和朝鲜苍术均可以用于治疗脾虚,脾虚症常伴随胃肠功能紊乱。MTL是一种重要的脑肠肽和胃肠激素,可以促进胃肠蠕动,增强胃肠收缩力和张力,加速胃排空[12]。AMS是机体内重要的消化酶,当AMS分泌减少时,大鼠的消化功能会随之下降,故可以间接反映脾虚大鼠的消化功能[13-14]。VIP是存在于肠道神经系统中的一种神经递质,它会刺激胃肠道黏膜,增多水和电解质分泌,导致患者出现腹泻或者黏液便的情况[15]。以上3个指标均可反映胃肠功能的变化。本研究发现,与正常组相比,模型组大鼠血浆中MTL、VIP水平明显升高,AMS水平明显降低。VIP和AMS水平的变化说明造模成功,但正常情况下脾虚造模后MTL水平应降低。因此,本研究推测可能是脾虚大鼠过度虚弱产生了代偿机制,代偿性地加快胃肠蠕动来促进消化,从而导致模型组MTL水平异常升高。当北苍术和朝鲜苍术给药后,MTL和AMS水平均明显升高,VIP水平明显降低,从以上各组指标的回调趋势可以说明给药后缓解了脾虚症状,改善了胃肠道代偿,从而导致MTL水平进一步升高,这一升高属于正向调节作用,表明两种苍术都能够调节脾虚大鼠的消化系统紊乱,改善脾虚引起的腹泻症状。
有研究表明脾虚症会影响免疫器官的发育,导致肠道免疫功能下降[16]。IgG是一种重要的免疫球蛋白,其含量可反映机体免疫功能的高低[17]。TNF-α和IL-6作为细胞因子,不仅与免疫调节密切相关,而且TNF-α可以引发炎症等多种生理和致病现象,IL-6的水平可反映肠道炎症的程度[18]。本研究发现,与正常组相比,模型组大鼠血浆中IL-6、TNF-α水平明显升高,IgG水平明显降低,证明造模成功。北苍术和朝鲜苍术给药后,IgG水平均明显升高,TNF-α水平明显降低,IL-6水平未出现明显变化,表明两种苍术都能够缓解脾虚大鼠的炎症反应,提高机体免疫能力。
进一步基于UHPLC-QE-MS技术,研究北苍术与朝鲜苍术对脾虚大鼠的干预作用机制,共筛选出与脾虚相关的差异代谢物180个,经北苍术与朝鲜苍术给药干预后,分别回调了其中70个和82个血浆差异代谢物,证实了北苍术和朝鲜苍术可以通过调节脾虚大鼠的潜在生物标志物来改善脾虚。利用Pathway数据库对这些差异代谢物进行代谢通路的归属,发现北苍术和朝鲜苍术对脾虚大鼠代谢通路的调节存在差异。本研究发现,与正常组相比,模型组大鼠血浆中肌氨酸、苏氨酸、硫胺素水平明显下降,经北苍术与朝鲜苍术给药后均明显回调,提示北苍术与朝鲜苍术均能通过调节“甘氨酸、丝氨酸和苏氨酸代谢” “硫胺素代谢”治疗脾虚。模型组大鼠血浆中胞苷、尿嘧啶、脱氧尿苷、丙酮酸水平明显下降,琥珀酸半醛水平明显上升,经朝鲜苍术给药后明显回调,提示朝鲜苍术能通过调节“嘧啶代谢” “丁酸代谢”治疗脾虚,而北苍术对以上两个通路虽有调节作用,但差异无显著性。模型组大鼠血浆中核黄素水平明显下降,经朝鲜苍术给药后明显回调,提示朝鲜苍术能通过调节“核黄素代谢”治疗脾虚,而北苍术不能调节“核黄素代谢”,即“核黄素代谢”是朝鲜苍术特有的代谢通路。
综上,北苍术与朝鲜苍术均能够调节胃肠道与免疫学指标,具有一定的健脾作用,其作用机制可能与调节“甘氨酸、丝氨酸和苏氨酸代谢”与“硫胺素代谢”等代谢通路有关。目前研究结果可以看出,在健脾方面,朝鲜苍术可以作为北苍术应用,但两者略有差异,其中朝鲜苍术在改善胃肠功能紊乱和代偿机制方面更强,北苍术在免疫调节方面更强。