基于网络药理学探讨山奈酚-7-O-新橘皮糖苷抗前列腺癌的作用机制
2024-01-22张秋萍付杰军程智萍李巧凤郭宏伟
张秋萍,付杰军,程智萍,薛 薇,李巧凤,郭宏伟,
(1. 广西医科大学药学院,广西生物活性分子研究与评价重点实验室, 广西 南宁 530021;2.广西医科大学第一附属医院,广西 南宁 530021;3. 广西医科大学转化医学研究中心,长寿与老年相关疾病教育部重点实验室 广西 南宁 530021)
前列腺癌(prostate cancer, PCa)是老年男性常见的恶性肿瘤,GLOBOCAN 2020统计报告显示,2020年全球范围内新发癌症病例中,PCa的发病率为14.1%,仅略次于肺癌[1]。我国随着生活水平提升、人均寿命延长和人口老龄化增多等因素影响,PCa发病率呈不断上升态势,已逐渐成为严重影响我国男性生命健康的重要疾病之一[2]。目前,PCa分为雄性依赖性和非依赖性两大类,患者早期无明显症状,发现时多半已为晚期,易对治疗药物产生耐药性,最终发展为致命的雄激素非依赖性PCa,使得PCa的治疗陷入窘境[3]。近年来,传统中药民族药作为PCa的临床辅助治疗手段,在减少患者毒副作用,降低肿瘤复发率和改善患者生存质量方面表现出一定优势[4-5]。
我们课题组前期研究发现,荔枝核总黄酮(total flavonoids of litchi seed,TFLS)具有较好的抗PCa作用[6]。山奈酚-7-O-新橘皮糖苷(kaempferol-7-O-neohesperidoside,K7ON)作为TFLS的主要成分之一[7],2D结构见Fig 1,已被证实可显著抑制肺癌、肝癌和宫颈癌细胞的增殖[8],但对PCa细胞是否具有抑制作用,其分子机制如何,尚不清楚。因此,本研究旨在探讨K7ON抗PCa的作用及潜在分子机制,将选取恶性程度高、转移潜能强的雄激素非依赖性PCa细胞,其临床治疗研究的代表细胞株为PC3、DU145和C4-2;而LNCap保留着PCa细胞学及早期分化功能的显著特征,是早期雄激素依赖性PCa细胞的典型代表[9],故选取该四株细胞进行增殖、迁移等研究,为荔枝核抗PCa有效成分的筛选和开发提供相关研究基础。
1 材料与方法
1.1 细胞系人源PCa细胞PC3、C4-2、DU145和LNCap均由长寿与老年相关疾病教育部重点实验室提供。
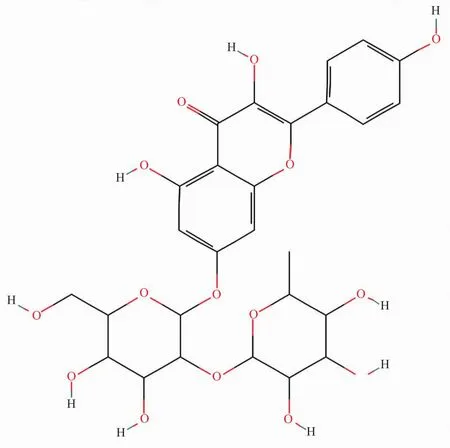
Fig 1 2D structure of K7ON
1.2 药物及试剂K7ON(CAS:17353-03-6,纯度99.89%,货号:1387 S)购自索莱宝公司;CCK-8试剂盒(货号:AR1199)购自珀金埃尔默公司;细胞裂解液(货号:89900)、蛋白/磷酸酶抑制剂(货号:A32961)购自Thermo Fisher科技公司;BCA蛋白定量试剂盒(货号:P0006)、超敏ECL化学发光试剂盒(货号:P0018S)购自碧云天公司;蛋白Marker 26616(货号:S27349)购自源叶公司;细胞周期试剂盒(货号:CCS012)购自联科生物公司;牛血清白蛋白(货号:A8020)、脱脂奶粉(货号:D8340)购自索莱宝公司;S相激酶相关蛋白2(Skp2,货号:2652T)、p27(货号:3686T)、细胞周期依赖性蛋白激酶抑制因子1A(p21,货号:2947T)和GAPDH(货号:2118S)抗体均购自CST公司。
1.3 主要仪器生物安全柜,细胞培养箱,全波长酶标仪Multishan GO,美国Thermo公司;37℃恒温孵育箱DNP-9162,中国上海精宏实验设备有限公司;4/-20/-80℃低温冰箱,中国海尔公司;电泳仪Powerpac Basic,美国Bio-Rad公司。
1.4 细胞培养PCa细胞(PC3、C4-2、DU145和LNCap)均在补充有10% FBS和1%青霉素-链霉素的RMPI-1640细胞培养基中培养,放入条件为37°C,5% CO2的细胞培养箱,2~3日更换一次培养液,待细胞密度长至85%以上即可传代。
1.6 划痕实验检测PCa细胞的迁移能力将对数生长期的DU145细胞接种于6孔板,当细胞汇合度达到95%~98%时,每孔加入20 mg·L-1的丝裂霉素C继续孵育2 h。使用无菌10 μL枪头在细胞生长单层划线形成划痕,D-PBS轻洗细胞3次,分别加入含不同浓度K7ON(0、32、64 μmol·L-1)的无血清培养基,每组设置3个平行孔。在给药后的0、12、24 h进行拍摄,各组别的每个时间点随机选取6个视野,采用ImageJ分析处理图片。
1.7 分子网络的构建
1.7.1K7ON潜在靶点的获得 从PubChem 分子库(pubchem.ncbi.nlm.nih.gov/)获得SMLIES和2D结构,通过SuperPred(https://prediction.charite.de/)、PharmMapper(http://www.lilab.ecust.cn/pharmmapper/)和Swiss Target Predictionn(http://www.swisstarget-prediction.ch/)数据库预测K7ON的作用靶点,再利用Uniprot数据库(https://www.un-iprot.org/uploadlists/)进行靶点蛋白和基因信息校正,得到相应的基因名称。
1.7.2PCa相关基因靶点的获得 通过Therapeutic Target Databaes(https://db.idrblab.ne-t/ttd/)、KEGG(https://www.kegg.jp/)、PharmGKB(https://www.pharmgkb.org/)以及GeneCards(https://www.genecards.org/)数据库网站检索靶点,输入关键词为“prostate cancer”,获得与PCa相关基因的靶点。
1.7.3K7ON与PCa共同靶点PPI网络的构建 将K7ON与PCa筛选出的靶点通过在线绘图工具Venny 2.1.0(https//bioinfogp. cnb. csic.es/tools/venny/)获得共同靶点,采用String平台(https://cn.string.db.org/)获得共同靶点的相互作用关系,通过Cytoscape软件进行可视化分析,根据Degree值大小建立PPI网络图。
1.7.4K7ON与PCa共同靶点功能和通路富集分析及“药物-靶点-疾病-通路”网络图的构建通过DAVID(https://david.ncifcrf.gov/)在线生物信息学平台将筛选出的共同靶点分别进行GO功能和KEGG通路富集分析,P<0.05为阈值,筛选出Top10的生物过程和信号通路,并通过生物信息分析平台(https://cloud.oebiotech.cn/task/detail/bub-ble-array/)绘制气泡图。最后运用Cytoscape软件,构建K7ON、共同靶点、疾病及Top10信号通路的“药物-靶点-疾病-通路”网络模型”网络图,以确定网络模型中的相互关系。
1.8 流式细胞术检测细胞周期DU145细胞常规培养,给予K7ON(5 μmol·L-1)干预48 h。清洗后离心重悬计数,按照试剂盒说明操作,每组取5×105个细胞以1 mL Buffer Solution重悬两次。依次加入Solution A、Solution B、Solution C,每次孵育10 min,同时设置阴性对照组。检测前以200目的滤网过滤细胞样品,使用BD Arial Ⅲ流式细胞仪检测细胞周期分布情况,ModiFit LT软件对结果进行处理分析。
1.9 Western blot检测DU145和C4-2的周期相关蛋白的表达将对数生长期的DU145和C4-2细胞接种于6 cm培养皿,给予不同浓度的K7ON(2.5、5 μmol·L-1)干预,同时设置对照组。48 h后以RIPA裂解法提取样品,BCA法检测蛋白浓度,各组的浓度调至相同(2 g·L-1)后加热变性。每组取等体积的蛋白样品进行电泳、转膜、封闭,而后4℃冰箱孵育一抗(Skp2、p27、p21,GAPDH; 1 ∶1 000),12~16 h后孵育二抗,1 h后洗净以化学发光显影系统显影。GAPDH作为内参,ImageJ统计条带灰度值,实验重复3次。
1.10 分子对接验证综合分析网络药理学及体外细胞结果,采用Sybyl X2.0软件评价Skp2与K7ON的直接结合能力。通过PDB数据库(https://www1.rcsb.org)下载该靶蛋白晶体结构,下载pdf格式文件导入Sybyl,进行除水分子、加氢原子等结构优化后保存。应用Pubchem数据库获得K7ON的sdf格式结构,使用Open Bable GUI软件将格式转化为mol2格式,导入Sybyl X2.0。将蛋白受体与化合物配体相互作用,根据Total Score评价Skp2与K7ON的结合作用,评分值大于5.0则证明两者具有较好的结合能力,最后利用PyMol软件绘制最优对接结果。
2 结果
2.1 K7ON对PCa细胞增殖的影响采用CCK-8法检测了K7ON对PCa细胞PC3、DU145、C4-2和LNCap活性的影响。结果表明,K7ON呈剂量和时间依赖性抑制PCa细胞增殖,见Fig 2。给药K7ON处理24 h、48 h和72 h后,PC3细胞的IC50(半数抑制浓度)值分别为169.2、75.29和13.21 μmol·L-1;DU145细胞的IC50值为 172.6、37.74和13.26 μmol·L-1;C4-2细胞的IC50值分别为 55.44、22.33和21.38 μmol·L-1。LNCap细胞的IC50分别为 36.18、27.73和19.33 μmol·L-1。上述结果表明K7ON可以显著抑制PCa细胞的增殖。
2.2 K7ON对DU145细胞迁移能力的影响采用划痕实验检测了K7ON对PCa细胞DU145迁移能力的影响。结果显示,与对照组相比,不同浓度的K7ON(32、64 μmol·L-1)作用于DU145细胞12 h和24 h后,细胞的迁移能力均显著下降(Fig 3)。以上说明K7ON能够抑制DU145细胞的迁移。
2.3 K7ON和PCa共同靶点的筛选及PPI网络构建将SuperPred、PharmMapper和Swiss Target Predictionn数据库预测到的所有K7ON潜在靶点,分别根据Probability或Norm Fit值筛选并去除重复项,导入UniProt数据库得到74个靶标蛋白所对应基因的规范名称。分别从Therapeutic Target Databaes、KEGG、PharmGKB以及GeneCards数据库分得到所有PCa靶点,经筛选和去除重复项后得到1 454个靶点。将PCa相关基因与K7ON靶点基因通过Venny2.1.0映射筛选出共同靶点34个,确定为K7ON治疗PCa的潜在靶点基因,见Fig 4A。
使用String数据库对共有靶点进行蛋白互相作用分析,构建共有靶点的相互作用网络图,将其倒入Cytoscape软件构建可视化分析。Fig 4B为共有靶点内部蛋白-蛋白相互作用网络图,节点大小及颜色深浅根据自由度从大到小变化,深橘色所示的节点如SKP2、p27、TP53等是K7ON抗PCa细胞增殖的核心靶点。
2.4 共同靶点GO功能和KEGG通路富集分析为了研究K7ON治疗PCa靶点参与的生命过程,将K7ON和PCa共有的34个靶点导入David数据库分别进行GO功能和KEGG通路富集分析。GO包括生物学过程(BP)、细胞组分(CC)和分子功能(MF)3部分,根据富集的P-Value从小到大进行排序并选取前10条进行绘图,见Fig 5A。GO功能富集分析中高度富集的主要包括细胞溶质(cytosol)、有丝分裂细胞周期的G1/S转换(G1/S transition of mitotic cell cycle)、ATP酶结合(ATPase binding)、细胞核(Nucleus)以及细胞周期调节(regulation of cell cycle)等。KEGG通路富集分析结果显示,共同靶点在21条信号通路中富集(P<0.01),主要包括癌症相关、前列腺癌以及细胞周期等多种疾病通路,见Fig 5B。最后,构建“药物-靶点-疾病-通路”网络模型,表明K7ON和PCa靶点之间的相互作用以及关键途径,见Fig 5C。以上结果提示K7ON抑制PCa细胞的增殖可能与调控细胞周期密切相关。
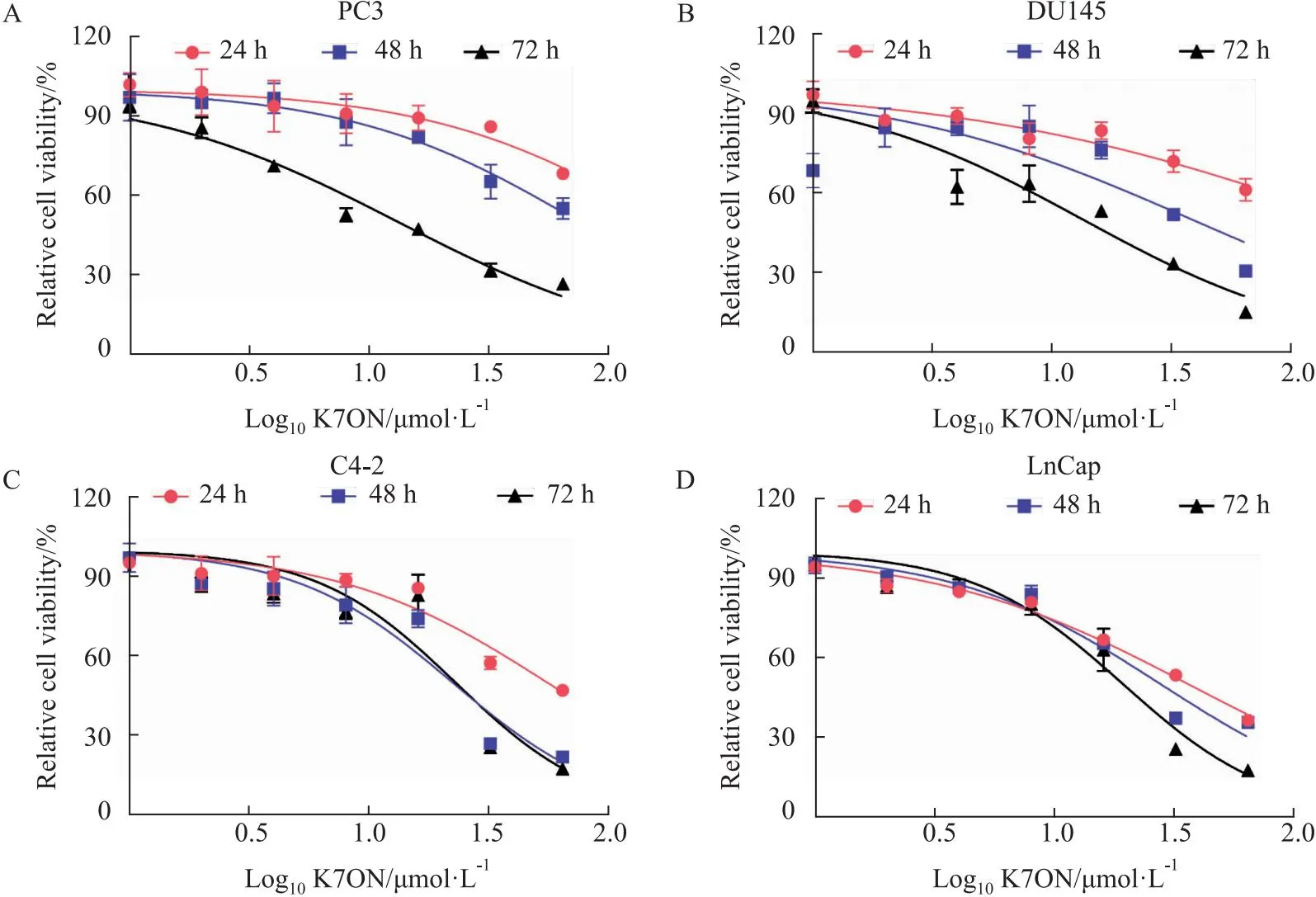
Fig 2 K70N inhibited proliferation of PCa cells in vitro A-D: Cell viability of PC3,DU145,C4-2 and LNCap cells treated with K7ON.

Fig 3 Effect of K7ON on migratory ability of DU145 cells in vitro
2.5 K7ON对DU145细胞周期的影响为了验证上述网络药理学预测结果,K7ON是否通过调控细胞周期抑制PCa细胞的增殖,我们通过流式细胞术检测K7ON对PCa细胞DU145周期的影响(Fig 6)。结果发现,在使用K7ON(5 μmol·L-1)干预24 h后,与对照组相比,K7ON处理组细胞周期S期的比例升高(P<0.001),G1期比例减少(P<0.01),说明K7ON可以使DU145细胞阻滞在S期。
2.6 K7ON对PCa细胞周期相关蛋白的影响为了进一步研究K7ON对PCa细胞周期的调控机制,我们采用Western blot对网络药理学预测的周期调控蛋白Skp2、p27以及p21进行检测,其中p27和p21是Skp2下游周期调控蛋白。结果显示(Fig 7),与对照组相比,使用不同浓度K7ON(2.5、5 μmol·L-1)作用48 h后,Skp2蛋白表达水平下调,而p27和p21的蛋白表达水平上调,差异有统计学意义。提示K7ON可能通过Skp2-p27/p21调控细胞周期抑制PCa细胞的增殖。
2.7 分子对接验证结果为了进一步研究K7ON是否通过与Skp2蛋白直接结合,进而调控其下游蛋白p27和p21的表达,我们将K7ON与核心靶点Skp2进行分子对接。对接的Result Score与结合能大小相关,结合能指示配体和受体相结合的能力。当Result Score大于5时,表示化合物与蛋白具有较好的结合能力,结合能越大则结合得越稳定[10]。分子对接Result Score为5.12,显示Skp2蛋白与K7ON具有较好的结合能力,提示K7ON可能与Skp2蛋白存在直接结合,进而调控下游周期蛋白p27和p21表达。利用PyMol软件对结果进行可视化,见Fig 8A。
3 讨论
PCa是老年男性最常见的恶性肿瘤,随着发病率的不断上升,PCa已逐渐成为严重影响我国男性寿命和生活质量的重要疾病之一[2]。虽已有研究表明原位PCa的五年生存率较高[11],但PCa患者早期大多无明显症状,发现时多半已为晚期,且易对治疗药物产生耐药性,最终发展为致命的去势抵抗性PCa,使得PCa的治疗陷入窘境[3]。近年来,传统中药和民族药在PCa治疗中发挥愈加重要的作用[4],从传统中药或民族医药中,寻找有效的抗PCa药物已成为目前研究的热点与趋势。具有行气散结之功的荔枝核常被临床中医师配伍应用治疗PCa及其引起的癌痛[12],本课题组前期研究发现,TFLS为荔枝核提取物抗PCa的主要活性成分[7],另有研究表明,TFLS中的化合物K7ON可显著抑制肺癌、肝癌、宫颈癌细胞的增殖[8],但K7ON对PCa细胞是否有抑制作用尚不清楚。因此,在本研究中,我们首先采用CCK-8法检测K7ON对PCa细胞活性的影响,结果显示,K7ON对不同类型PCa细胞均具有良好的增殖抑制活性。同时K7ON还可抑制DU145细胞的迁移能力,提示K7ON可抑制PCa细胞的增殖和转移。
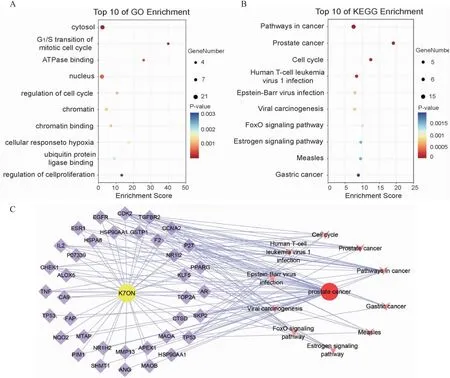
Fig 5 Enrichment analysis and network of common targets
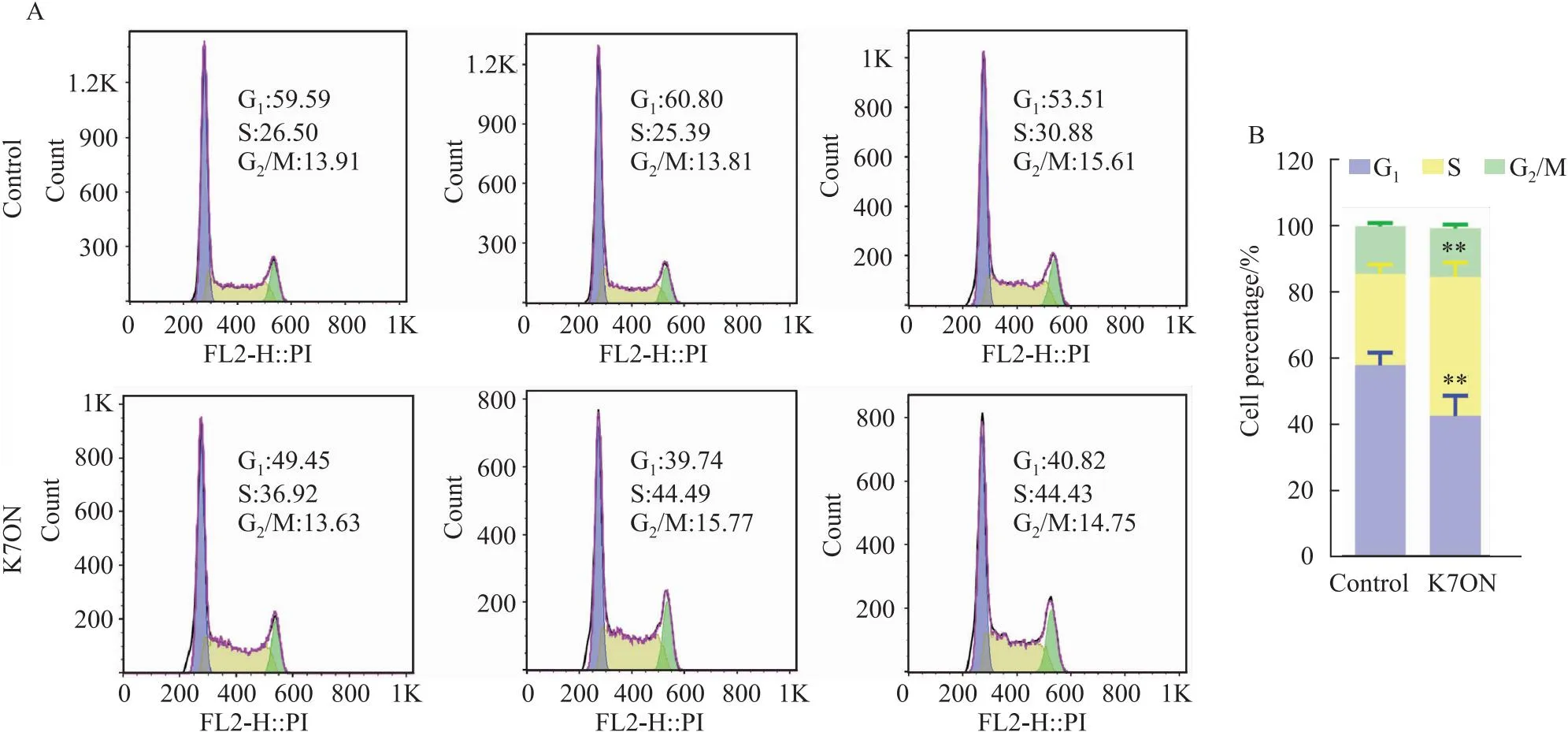
Fig 6 Effect of K7ON on cell cycle of PCa cells
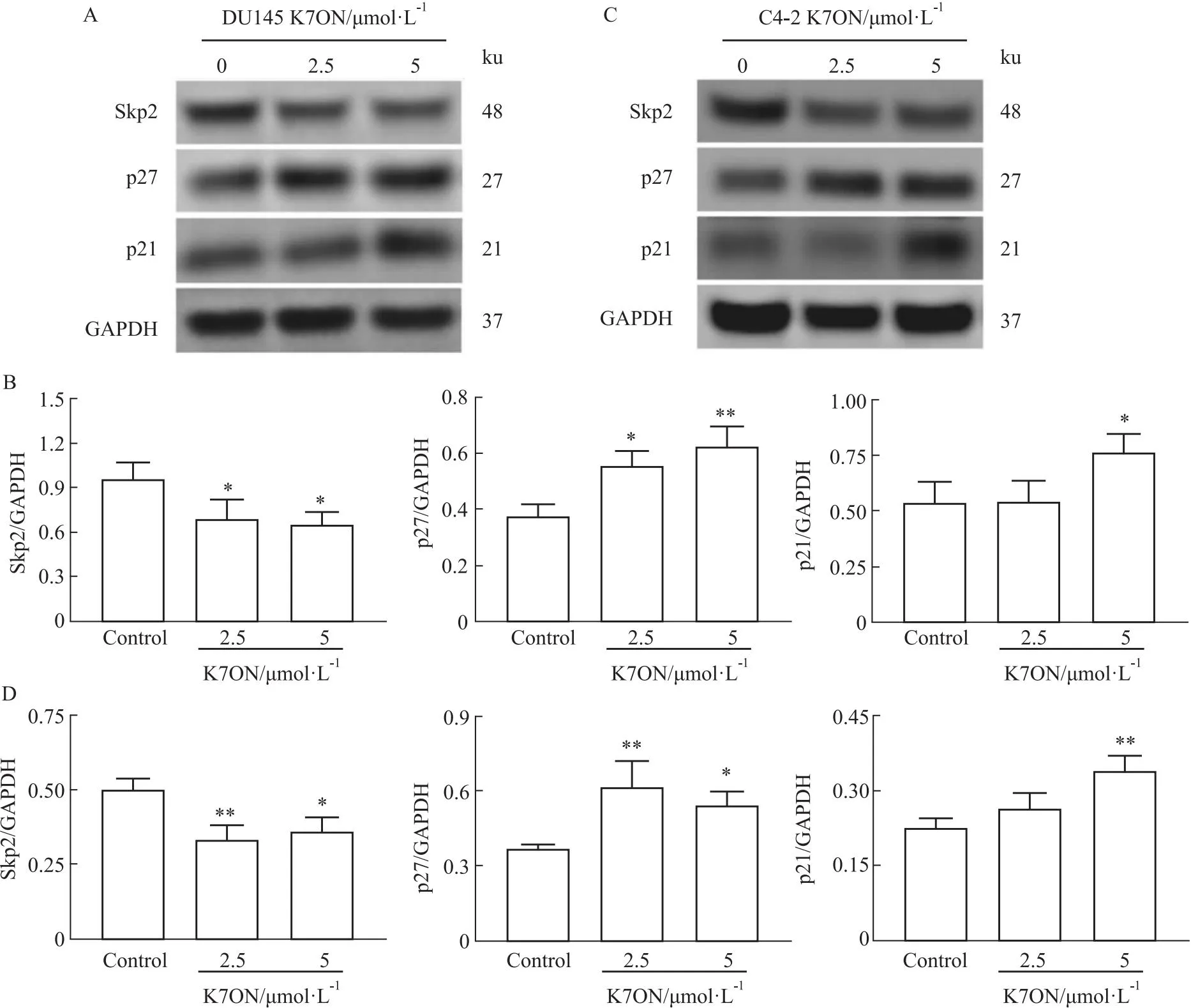
Fig 7 Effect of K7ON on Skp2-p27/p21 signaling pathway related proteins in PCa cells
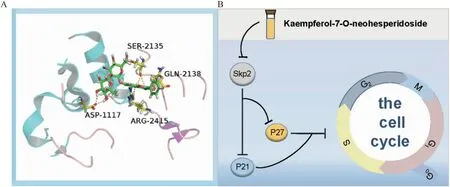
Fig 8 Molecular docking and mechanism graph
近年来,随着网络药理学的迅速发展,其被广泛应用于探索中药物质基础和作用机理的研究,已成为系统性预测疾病与药物之间复杂关系的综合工具。我们课题组前期已采用网络药理学的方法在国际学术刊物上发表多篇相关研究论文[13-14],因此,在本研究中我们采用网络药理学预测了K7ON抗PCa的潜在分子机制,结果提示K7ON治疗PCa与细胞周期调控密切相关,周期调控蛋白Skp2、p27等可能是K7ON抗PCa细胞增殖的核心靶点。Skp2主要参与细胞周期的调控,与肿瘤的发生、发展密切相关,在肿瘤的侵袭、转移中也扮演着重要的角色[15]。我们的研究也结果显示,K7ON可抑制PCa细胞DU145的迁移,同时阻滞DU145细胞周期于S期,提示Skp2可能是K7ON发挥作用的关键靶点之一。
细胞周期是细胞生命活动的基本过程,其调控的异常与肿瘤的发生密切相关。p27和p21被广泛认为是细胞周期的负调节因子,Skp2可通过泛素蛋白酶体途径降解p27和p21[15]。值得关注的是p27可通过调控细胞周期蛋白A(cyclin A)和周期蛋白依赖性激酶-2(cyclin-dependent kinase,CDK2)阻滞细胞于S期[16]。这与本研究发现K7ON阻滞DU145细胞周期停滞于S期一致,提示K7ON很可能是通过Skp2/p27信号通路调节PCa细胞周期。因此,我们进一步采用Western blot 对Skp2、p21和p27蛋白表达进行验证,结果发现K7ON可显著下调DU145和C4-2细胞中Skp2蛋白表达水平,上调p27和p21的蛋白表达水平。
流式细胞术和Western blot实验的药物浓度选择一般低于IC50,多篇文献中采用的IC20值已取得明显的变化[17-18]。此外,我们前期的Western blot预实验结果显示,当取DU145给药48 h的IC20值5 μmol·L-1时,DU145和C4-2细胞的周期蛋白表达皆发生显著的变化(P<0.05)。故而流式细胞术选取IC20值5 μmol·L-1检测DU145细胞周期变化;Western blot实验选择IC20值为高浓度,1/2的IC20值为低浓度。最后,Sybyl X2.0进行的分子对接结果显示Total Score值为5.12,说明配体K7ON与受体Skp2具有较好的结合能力,进一步提示Skp2可能是K7ON的潜在药效靶点。然而K7ON对Skp2是否存在直接靶向调控,而Skp2是否是通过泛素化途径调控p27和p21的表达尚不明确,后续我们将针对上述不足展开深入研究。
综上所述,K7ON可抑制PCa细胞的增殖和迁移,阻滞DU145细胞停滞于S期,其机制可能与调控Skp2-p27/p21信号通路有关(Fig 8B)。本研究为探索荔枝核抗PCa的有效成分及潜在分子机制提供理论依据。