基于TLR4/NF-κB信号通路探究红花黄色素对不同月龄APP/PS1小鼠学习记忆能力的影响
2024-01-22张梦玉郑艳杰叶红霞王春辉胡艳丽
张梦玉,郑艳杰,叶红霞,王春辉,胡艳丽
(石河子大学药学院/新疆植物药资源利用教育部重点实验室,新疆 石河子 832000)
阿尔茨海默病(Alzheimer’s disease,AD)是一种神经退行性疾病,其关键的病理变化包括β-淀粉样蛋白的沉积(β-amyloid precursor protein, Aβ)和神经原纤维缠结(neurofifibrillary tangles, NFTs)[1]。此外,神经炎症也是AD的早期病理表现,炎症反应会加重疾病进展,而抑制炎症反应可能降低AD的风险[2]。
小胶质细胞(microglia, MG)是参与调节慢性神经炎症反应的重要胶质细胞之一。活化的MG在一定程度上具有保护作用,可降低AD的发病率。活化的M1型MG可诱导促炎因子和趋化因子的表达,引起炎症反应[3]。M2型MG有助于吞噬细胞碎片,促进组织修复,并通过释放抑炎因子发挥抗炎作用[4]。因此,促使MG由M1型向M2型转变被认为是神经炎性疾病的潜在治疗方法。TLR4主要在MG中表达,是与M1型MG激活相关的关键转录因子,能够诱导促炎细胞因子的转录和释放。研究表明抑制TLR4/NF-κB信号通路的激活可减轻神经炎症,改善痴呆小鼠的认知损伤[5]。
红花黄色素(safflower yellow, SY)是中药红花水溶性提取物的主要活性成分。研究证明,SY通过抑制炎症反应和氧化应激来保护心血管系统和神经系统[6]。研究发现,SY可以改善多种AD模型动物的学习和记忆能力[7-8]。然而,SY对不同疾病时期APP/PS1小鼠学习记忆的影响,以及是否通过TLR4/NF-κB通路调节MG表型的转化发挥神经保护作用有待研究。
本研究评估了SY对不同月龄APP/PS1小鼠认知障碍的影响及对MG M1M2极化和TLR4/NF-κB信号通路的表达,阐明了SY治疗AD的最佳治疗期及其作用机制,为SY治疗AD不同疾病阶段提供依据。
1 材料与方法
1.1 药品与试剂红花黄色素(云南通海杨氏天然产物公司,(E=100色价,主要成分红花黄A和红花黄B,总色素含量 >90%,批号:YSCMY2020 0710);Arginase-1兔多克隆抗体(Santa);iNOS兔多克隆抗体(CST);小鼠β-actin单克隆抗体(中杉金桥);TREM2兔多克隆抗体(Bioss);TLR4鼠单克隆抗体(Santa);p-NF-κB p65兔多克隆抗体(Affinity);NF-κB p65兔多克隆抗体(Affinity);蛋白酶抑制剂(默克公司);BCA试剂盒(上海碧云天);PVDF膜(Amersham);ECL发光试剂盒(Affinity);IL-6试剂盒(Mlbio);TGF-β1试剂盒(Mlbio)。
精密称取15 mg SY溶于5 mL无菌氯化钠注射液中,配制成药物浓度为3 g·L-1的SY溶液。
1.2 仪器DMS-2型Morris 水迷宫,DTT-2型小鼠跳台仪(中国医学科学院);低温高速离心机(Eppendorf);组织匀浆机(德国IKA公司);酶标仪Thermo 3001(德国ZEISS公司);DYCZ-40D电泳仪,DYY-7C型电泳仪电源(北京六一);UVP化学发光成像系统;万分之一电子天平(日本A&G有限公司);ZD-9556A 水平脱色摇床(江苏盛蓝仪器制造有限公司)。
1.3 方法
1.3.1实验动物 3、6、9月龄APP/PS1(APPswe, PSEN1dE9)转基因小鼠(Tg)共68只及3、6、9月龄C57BL/6J小鼠(WT)共34只,体质量(22~29)g,购自南京君科生物工程有限公司,合格证号:2018000601886。实验动物饲养于温度为(23 ± 2)°C并且空气流通的房间内。实验期间小鼠自由饮水和摄食,严格遵循实验动物管理相关规定。
1.3.2实验动物分组及给药 3、6、9月龄APP/PS1小鼠与同月龄的C57BL/6J小鼠随机分为3组:WT组(n=12,n=12,n=10),Tg组(n=12,n=12,n=10),Tg+SY 30 mg·kg-1组(n=12,n=12,n=10)。SY 30 mg·kg-1组灌胃给予SY 30 mg·kg-1,WT组和Tg组给予生理盐水,每日1次,连续给药3个月至行为学实验结束。
1.3.3Morris水迷宫实验 平台置于水面下约1 cm,置于第一象限中心,水温保持在(22±2)℃。实验过程中保持水池边缘的标识物不变和环境安静,减少噪音对实验的干扰。定位航向实验中,小鼠每日训练两次。小鼠从相邻象限和相对象限的入水点面向池壁入水,记录小鼠找到平台的时间为逃避潜伏期。若小鼠未在120 s内找到平台,则需引导小鼠游上平台,使小鼠产生记忆,并记录逃避潜伏期为120 s。在空间探索实验中,撤去平台使小鼠从第三象限入水,记录小鼠首次穿越平台时间及穿越平台次数。
1.3.4跳台实验 实验在底部铺有铜栅的设备中进行。在学习阶段,小鼠适应环境3 min后打开电源,铜栅通电。将小鼠放置于绝缘平台上,当小鼠跳下平台会受到电击,正常情况下小鼠会立即跳上平台,若小鼠不上平台则需手动将小鼠放上平台,产生记忆。训练试验结束24 h后,进行回忆实验。记录每只小鼠首次跳下平台的时间和3 min内跳下平台的总次数。
1.3.5ELISA实验 每组小鼠随机选取4只进行检测,称取一定重量的大脑皮层组织,加入9倍体积的PBS后匀浆。组织匀浆离心后收集上清液。根据试剂盒说明书加入相应试剂,在450 nm波长测定每孔A值,用Excel绘制标准曲线,根据曲线方程计算待测样品浓度。
1.3.6Western blot实验 提取各组小鼠皮层与海马组织总蛋白,用BCA试剂盒测定蛋白质浓度,将蛋白质热变性并进行SDS-PAGE凝胶电泳。将蛋白质转移至PVDF膜上,在室温下封闭1 h。PVDF膜与以下抗体在4 °C孵育过夜:Arginase-1兔多克隆抗体(1 ∶1 000); iNOS兔多克隆抗体(1 ∶1 000);小鼠β-actin单克隆抗体(1 ∶1 000);TREM2兔多克隆抗体(1 ∶1 000);TLR4鼠单克隆抗体(1 ∶1 000); p-NF-κB p65兔多克隆抗体(1 ∶1 000);NF-κB p65兔多克隆抗体(1 ∶1 000)。次日,PVDF膜与相应二抗室温孵育1 h,将ECL发光液均匀覆盖于PVDF膜上,并使用UVP化学发光成像系统对条带进行可视化,用ImageJ对条带进行分析。
2 结果
2.1 SY改善不同月龄的APP/PS1转基因小鼠的认知功能障碍通过Morris水迷宫实验以明确SY对3、6、9月龄APP/PS1小鼠的长期学习记忆能力的影响。定位航行实验表明,与3、6、9月龄WT组小鼠相比,同月龄Tg组小鼠逃避潜伏期均明显延长(P<0.01)。3月龄SY组小鼠逃避潜伏期有略微下降的趋势,但差异并无显著性,6月龄与9月龄SY组小鼠的逃避潜伏期则明显缩短(P<0.01,P<0.05),如Fig 1A-C。
在空间探索实验中,与同月龄WT组小鼠相比,3、6、9月龄Tg组小鼠首次穿过平台的时间分别延长了95.7%(P<0.05)、203%(P<0.01)和200%(P<0.01),表明各月龄APP/PS1小鼠的学习记忆能力受损。而3、6、9月龄SY组小鼠首次穿过平台的时间分别减少了33.6%、45.0%(P<0.01)和33.3%。与同月龄WT组小鼠相比,3、6、9月龄Tg组小鼠的穿越平台次数分别减少了50.4%和400%(且与3月龄Tg组相比差异有显著性,P<0.05)和74.5%。经过SY治疗后各月龄SY组小鼠穿越平台均增加,3月龄小鼠增加了19.4%,6月龄小鼠增加了650%(明显高于3月龄SY组小鼠,P<0.01),9月龄小鼠增加了166.7%(Fig 1D,F)。结果表明,SY可以改善不同月龄的APP/PS1转基因小鼠的认知功能障碍,其中对6月龄APP/PS1小鼠的认知障碍改善最好。
2.2 SY提高不同月龄的APP/PS1转基因小鼠的短期学习记忆能力跳台实验明确SY对3、6、9月龄APP/PS1小鼠的短期学习记忆能力的影响。如Fig 2所示,与同月龄WT组小鼠相比,各月龄Tg组小鼠逃避潜伏期分别减少了6.9%,51.7%(P<0.05)和40.1%,错误次数分别增加了73.1%,300%(P<0.01)和260%(P<0.05)。与同月龄Tg组小鼠相比,3月龄SY组小鼠逃避潜伏期仅增加0.043%,错误次数增加54.7%,但差异无显著性,6、9月龄SY组小鼠逃避潜伏期分别增加105.9%和68.9%(均明显高于3月龄SY组小鼠,P<0.01,P<0.05);错误次数分别减少了75.8%(P<0.01)和71.4%(P<0.05)。结果表明,SY可以提高不同月龄的APP/PS1转基因小鼠的短期学习记忆能力,其中对6月龄APP/PS1小鼠的改善作用最好。
2.3 SY调节了不同月龄小鼠大脑皮层中IL-6和TGF-β1表达水平与同月龄WT组小鼠相比,3月龄Tg组小鼠皮层中IL-6的含量呈现升高趋势,6、9月龄Tg组小鼠IL-6的含量明显升高(P<0.05),经给药治疗后6、9月龄SY组小鼠皮层中IL-6的含量明显降低(P<0.05)。与各月龄WT组小鼠相比,3月龄Tg组小鼠TGF-β1的含量仅有下降的趋势,6、9月龄Tg组小鼠TGF-β1的含量明显下降(P<0.05),经SY治疗后,3、9月龄SY组小鼠皮层中TGF-β1的含量有上升的趋势,6月龄SY组小鼠TGF-β1的含量明显上升(P<0.05)(Tab 1)。
Tab 1 Content of IL-6 and TGF-β1 in cortical tissue of mice at different months of
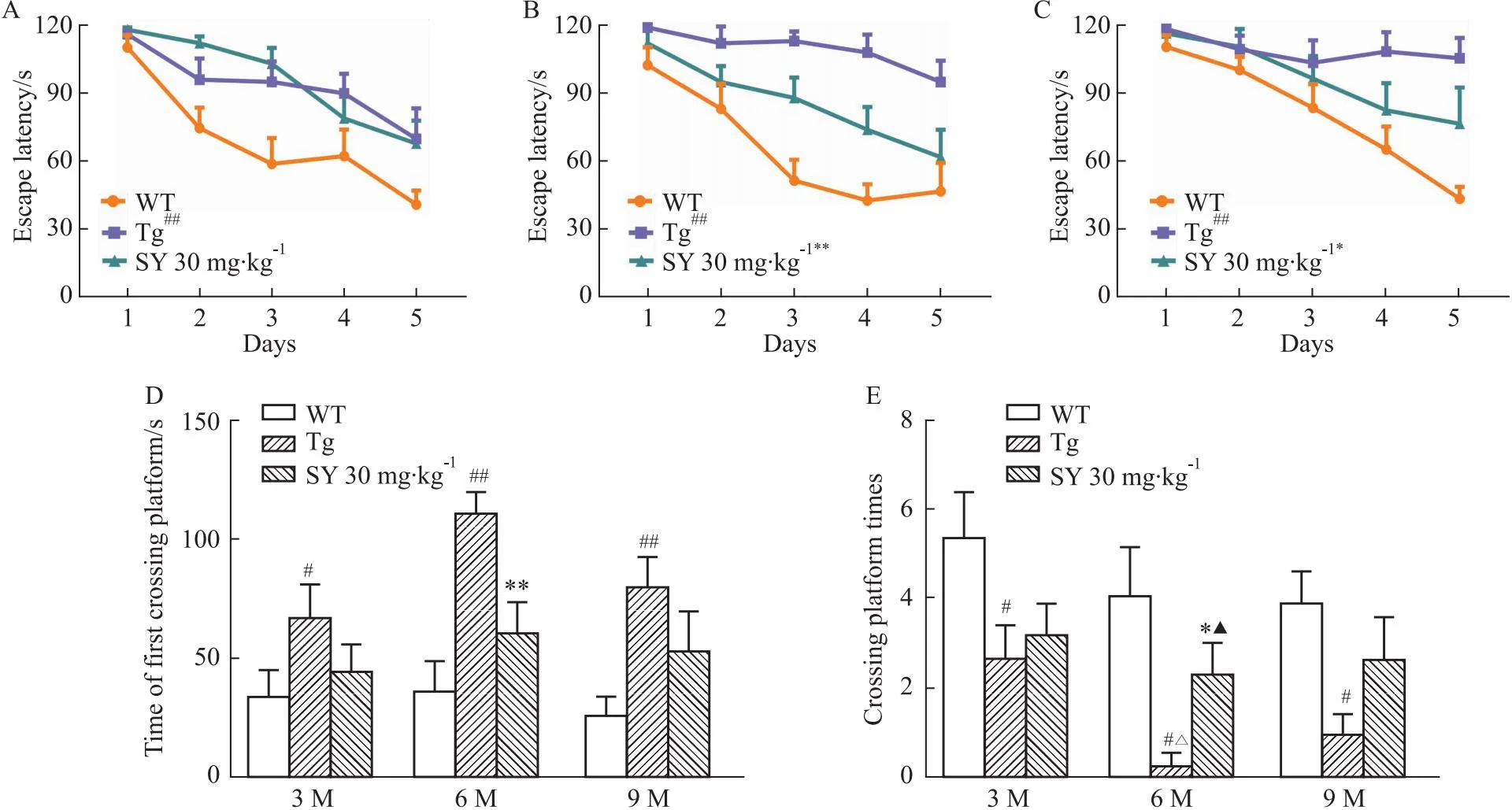
Fig 1 Effects of safflower yellow on learning and memory ability of 3,6,9-month-old APP/PS1 transgenic mice in Morris water maze
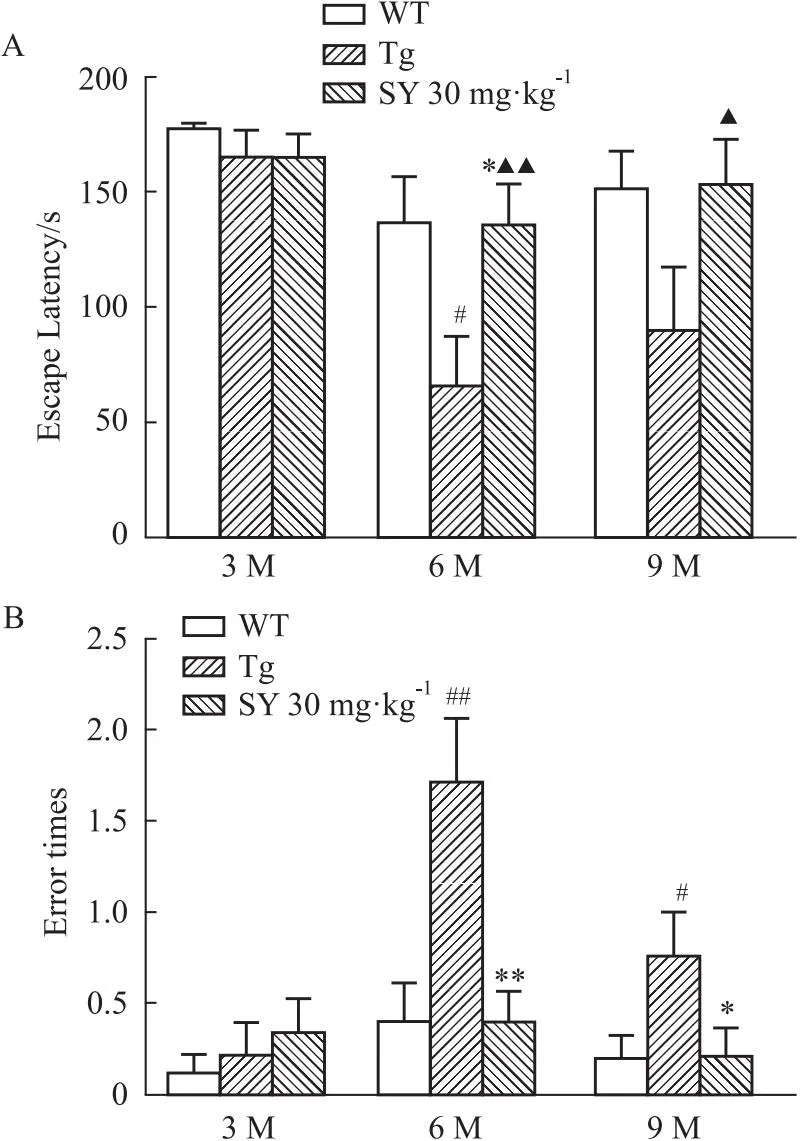
Fig 2 Escape latency and error frequency of mice at different months of age in step-down
2.4 SY诱导了不同月龄小鼠脑组织中TREM2蛋白表达如Fig 3所示,与3、9月龄WT组小鼠比较,同月龄 Tg组小鼠皮层组织中TREM2的表达水平呈现下降的趋势,在6月龄Tg组小鼠皮层组织中TREM2的表达水平明显降低(P<0.05)。3、9月龄SY组小鼠TREM2的蛋白表达水平有升高的趋势,6月龄SY组小鼠TREM2表达明显升高(P<0.05)。同样,与WT组相比,在海马组织中各月龄Tg组小鼠TREM2的表达水平均明显降低(P<0.05)。经SY治疗后,3、9月龄SY组小鼠TREM2的表达水平出现升高趋势,6月龄SY组小鼠TREM2的表达水平则明显升高(P<0.05)。
2.5 SY对不同月龄小鼠脑组织中iNOS/Arg-1蛋白表达水平的影响iNOS和Arg-1通常分别被认为是M1和M2极化的标志性蛋白。如Fig 4所示,与WT组相比,在各月龄Tg组小鼠的皮层组织中,3月龄小鼠iNOS的表达水平有升高的趋势,Arg-1的表达水平有降低的趋势;6、9月龄Tg组的小鼠iNOS的表达水平明显升高,Arg-1的表达水平明显下降(P<0.05)。在海马组织中,各月龄Tg组小鼠iNOS的表达水平明显升高,Arg-1的表达水平明显降低(P<0.05)。SY明显降低了3月龄小鼠海马及6月龄小鼠脑组织中iNOS的蛋白表达,提高了Arg-1蛋白的表达水平(P<0.05)。9月龄SY组小鼠iNOS/Arg-1蛋白的表达水平仅有降低/升高的趋势,差异无统计学意义。
2.6 SY 降低了不同月龄小鼠脑组织中TLR4及p-NF-κB p65/NF-κB p65蛋白的表达水平TLR4信号会激活NF-κB通路并释放炎症介质,导致大脑中的炎症反应,并加快AD疾病进程。如Fig 5所示,与WT组相比,各月龄Tg组的皮层区域TLR4的表达水平有增加的趋势,海马中TLR4的表达水平明显增加(P<0.05)。各月龄SY组小鼠皮层组织中TLR4的表达水平均呈现下降的趋势,海马组织中TLR4蛋白的表达水平明显降低(P<0.05,P<0.01)。在皮层组织中,p-NF-κB p65/NF-κB p65的表达水平在3、9月龄Tg组小鼠中升高,在6月龄Tg组小鼠中明显升高(P<0.05)。在海马组织中,各月龄Tg组小鼠p-NF-κB p65/NF-κB p65的表达水平明显升高(P<0.05),SY有效降低了6月龄APP/PS1小鼠p-NF-κB p65/NF-κB p65蛋白的表达水平(P<0.05)。
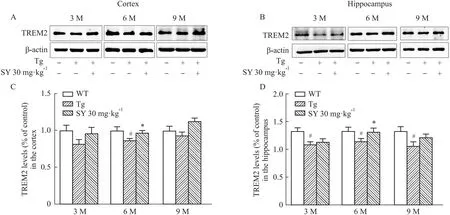
Fig 3 Western blot detection of TREM2 protein expression in brain tissue of mice at different months of #P<0.05 vs WT group; *P<0.05 vs Tg group.
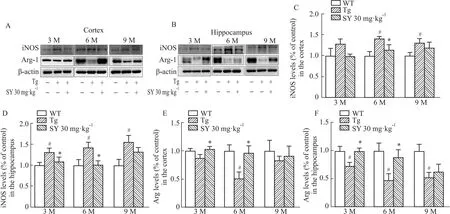
Fig 4 SY reduced expression of iNOS protein and induces Arg protein expression in brain tissue of mice at different months of #P<0.05 vs WT group;*P<0.05 vs Tg group.
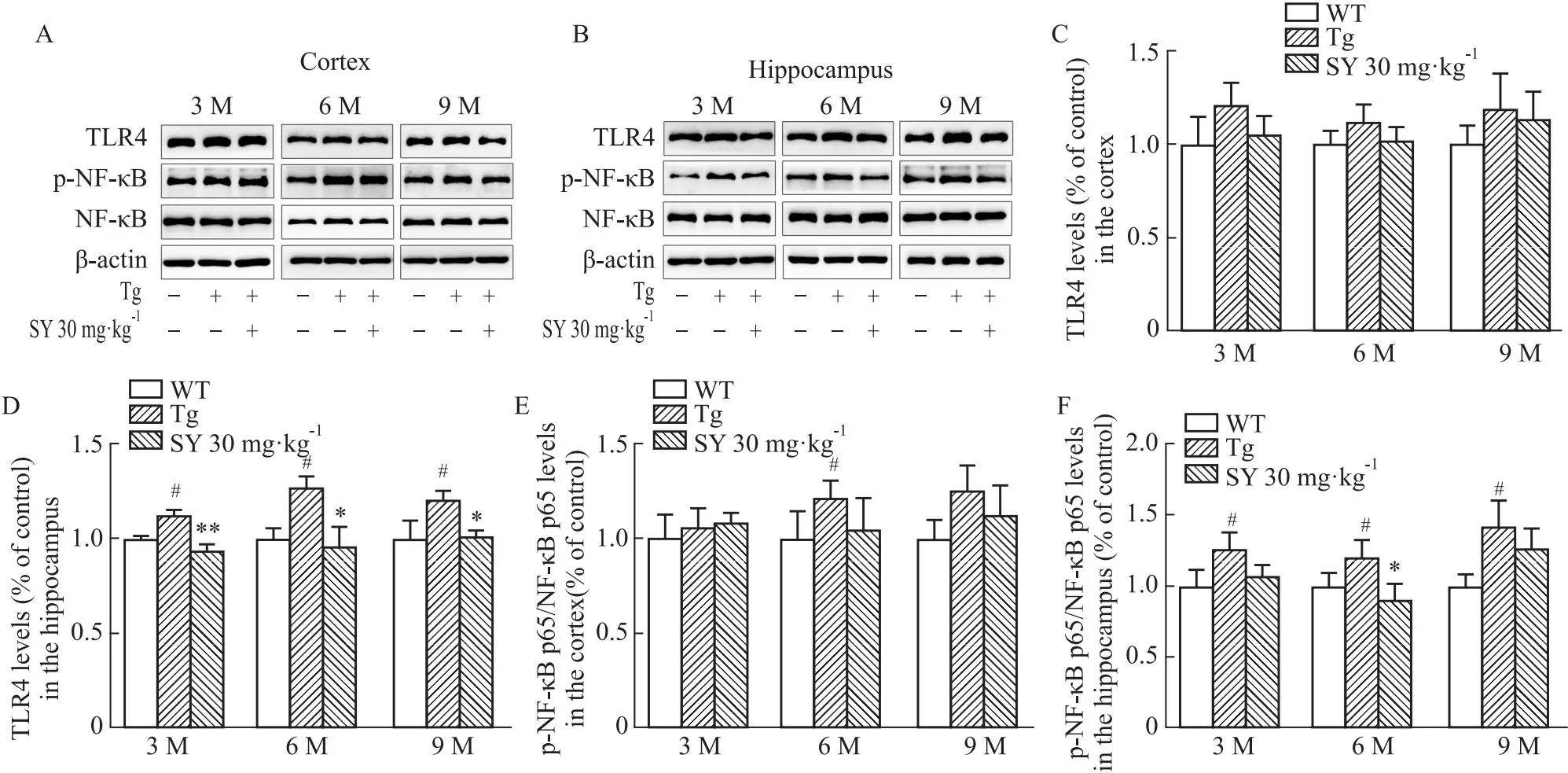
Fig 5 Western blot detection of TLR4/NF-κB pathway-related protein expression in brain tissue of mice at different months of #P<0.05 vs WT group; *P<0.05, **P<0.01 vs Tg group.
3 讨论
AD是常见的中枢神经系统退行性疾病,认知功能伴随着病程的进展而逐渐下降。APP/PS1小鼠能够将AD相关的人类突变基因APPswe和PSEN1de9转移至小鼠体内,使其表现出与AD患者相似的病理特征,很好地模拟AD疾病进展[9]。
研究表明,APP/PS1小鼠在6个月大时出现学习记忆缺陷,并随着年龄的增长逐步加重[10]。在Morris水迷宫实验中,与不同月龄WT组相比,3、6、9月龄Tg组小鼠逃避潜伏期和首次穿越平台的时间均延长,而穿越平台次数减少,说明3月龄APP/PS1小鼠历经3个月后,学习记忆能力出现损伤,并随着月龄增加而加重。SY对3月龄小鼠长期学习记忆有一定的改善效果,但明显提高了6、9月龄小鼠的长期学习记忆能力。在跳台实验中,SY对3月龄小鼠短期学习能力的改善并不理想,对6、9月龄小鼠的短期学习记忆能力有一定的改善作用。行为学实验表明6月龄可能是SY提高APP/PS1转基因小鼠学习记忆能力的最佳时期,可能是由于3月龄小鼠处于疾病早期,而9月龄小鼠已处于AD重度病理阶段。
MG是一种特殊的吞噬细胞,分布于整个中枢神经系统,是神经胶质细胞的主要类型之一[11]。MG对神经炎症的调节作用与其活化表型密切相关。目前将激活的MG分为两种表型:M1型为经典活化状态,介导MG向淀粉样斑块迁移和聚集,同时释放炎性因子,如iNOS、IL-1β、IL-6等,诱导炎症反应;M2型为“交替激活”状态,通过释放抗炎因子如Arg-1、IL-4、TGF-β等,促进组织修复[12-13]。MG的M1/M2表型仅代表炎症反应的两种状态,并非独立存在,而是可以相互转化。研究表明,调节MG从M1型转化为M2型,有助于减少Aβ的产生,促进Aβ的清除,减少炎性因子的释放,从而改善APP/PS1小鼠的认知功能障碍[14]。TREM2在MG中高度表达,同时TREM2 在促进MG表型转化方面起着至关重要的作用。研究表明,敲除BV-2细胞中的TREM2基因会抑制M2型MG的表达,并诱导M1型表达增加,增加炎症反应,而TREM2 的过表达减轻MG炎症[15]。因此,调节MG表型转变有助于减轻炎症反应,延缓AD进展。在本研究中,SY明显下调了6、9月龄小鼠IL-6表达水平,明显增加了6月龄小鼠 TGF-β1的含量。而SY对炎症因子的调节是否与MG的表型转化有关?因此,重点研究SY在调节不同月龄小鼠MG极化中的作用。结果表明各月龄APP/PS1小鼠海马中iNOS的表达水平明显升高,Arg-1和TREM2的表达水平明显下调,表明各月龄APP/PS1小鼠M1型MG表达增加。SY明显降低了6月龄小鼠脑组织和3月龄小鼠海马中iNOS的表达水平,上调了Arg-1和TREM2的表达水平。因此,SY可能通过提高TREM2的表达水平,促进MG表型转化进一步调节炎症因子的水平。
NF-κB在炎症、免疫和细胞增殖中发挥重要作用,TLR4介导的NF-κB激活是引起促炎介质表达的关键因素。TLR4诱导IκB-α的磷酸化和降解,导致NF-κB与IκB解离,释放NF-κB p65易位进入细胞核,进一步与相关炎症因子的DNA结合,刺激各种靶基因的转录,引起炎症反应[16-17]。研究表明,TLR4抑制剂可以通过抑制MyD88/NF-κB/NLRP3激活,逆转MG表型,减少Aβ沉积,减轻APP/PS1转基因小鼠的脑损伤[18]。本研究发现,TLR4在各月龄APP/PS1小鼠海马中的表达水平明显升高,这进一步导致了各月龄小鼠海马中p-NF-κB p65/NF-κB p65的表达水平升高。经SY治疗后,3、6、9月龄APP/PS1小鼠海马中TLR4蛋白表达水平明显降低,p-NF-κB p65/NF-κB p65蛋白水平仅在6月龄小鼠海马中明显下调。因此,SY对各月龄小鼠的学习记忆能力的改善作用与其抑制TLR4/NF-κB通路激活,促进MG活化表型转化以及减轻脑内炎症反应密切相关。
综上所述,SY能提高3、6、9月龄APP/PS1转基因小鼠的学习记忆能力,综合比较发现SY对6月龄 APP/PS1小鼠的整体改善效果最佳。此外,SY可以调节MG由M1型向M2型转化,并通过抑制TLR4-NFκB信号通路的激活和调节炎症因子的水平来减轻慢性神经炎症反应并发挥神经保护作用。