从标准化角度看我国细胞治疗产业发展
2024-01-20李婵杨磊廖延
李婵 杨磊 廖延
摘 要:为了促进我国细胞治疗产业的健康有序发展,本文对近年来我国细胞治疗产业标准化情况进行梳理,通过研究各类标准的分布情况、已发布标准的内容分布和已立项标准的发展趋势三方面产业标准化情况,概括得出我国该领域标准化发展现状。结合我国细胞治疗产业目前规范化程度提升、标准化建设有力地促进了产业规模和盈利能力增长的特点,以及仍存在产业机构在各区域分布不平衡及产业链各环节发展不均衡的弱点,探讨标准化与细胞治疗产业发展间的关系,提出完善产业标准体系、关注配套环节和定向政策法规支持的建议。
关键词:标准化,细胞治疗,干细胞,嵌合抗原受体T细胞,团体标准,产业链,关键物料,体外诊断
DOI编码:10.3969/j.issn.1002-5944.2023.07.006
基金项目:本文受广东省基础与应用基础研究基金项目“基于炎症因子组合体外赋能获得间充质干细胞新功能亚群及其特定免疫治疗机制研究”(项目编号:2021A1515011108)资助。
Analysis of the Development of Chinese Cell Therapy Industry from the Perspective of Standardization
LI Chan YANG Lei LIAO Yan
(Shenzhen Beike Biotechnology Co., Ltd.)
Abstract: In order to promote the orderly development of the cell therapy industry in China, the paper summarizes the standardization of the cell therapy industry in China by studying three aspects of standardization: the distribution of all kinds of standards, the content distribution of existing standards and the development trend of standards projects. Combined with the characteristics of enhanced standardization, standardization construction has greatly promoted the growth of industrial scale and profi tability, as well as the weakness of unbalanced distribution of industrial institutions in various regions and unbalanced development of all links of the industrial chain, the paper then discusses the relationship between standardization and the development of the cell therapy industry, and puts forward suggestions for improving the industrial standards system, paying attention to the supporting links and providing targeted policies and regulations support.
Keywords: standardization, cell therapy (CT), stem cells, CAR-T cells, association standard, industrial chain, key material, IVD
0 引 言
2015年5月20日,国家卫生计生委(现国家卫生健康委员会)和食品药品监管总局(药品监督管理局)共同发布《干细胞临床研究管理办法(试行)》,随后的7月31日,两部门又联合发布了《干细胞制剂质量控制及临床前研究指导原则(试行)》,由此正式开启了我国对细胞治疗产业中的一大分支——干细胞制剂的双轨制管理模式[1]。
2017年9月30日,美国FDA批准诺华研发的全球首款CAR-T(嵌合抗原受体T细胞免疫疗法)药品Kymriah上市,其后的10月18日,吉利德/Kite 研发的Yescarta被批准上市。这两款同样以CD19为靶点,治疗血液系统肿瘤的基因改造免疫细胞治疗产品的相继上市,展现了个性化程度极高的细胞治疗产品的产业化之路。
2017年12月18日,我国食品药品监督管理总局(现国家药品监督管理局)颁布了《细胞治疗用产品的研究与评价技术指导原则(试行)》,这一指导原则针对“按照药品管理相关法规进行研发和注册申报的人体来源的活细胞产品”的研究和评价技术给出了指引,促进了细胞治疗产品的新药注册管理规范化,也是我国对细胞治疗产业两大分支——干细胞和免疫细胞,作为药品统一管理的起点[2]。
以上细胞治疗领域里程碑法规的颁布,对产业的促进作用是巨大的,2021年6月,复星凯特的奕凯达(阿基仑赛注射液)成為国内首个获批上市的CAR-T细胞治疗产品,2022年2月28日,我国传奇生物研发的西达基奥仑赛获得美国FDA批准上市,成为中国首个获得美国FDA批准的CAR-T产品。
然而,行政主管单位所发布的指导原则往往偏重于划定基准线,要求细胞治疗产品达到必要的质量要求,对于达成的过程要求则相对欠缺。但是实现细胞治疗产品过程的标准化,恰恰是达到细胞治疗产品质量要求的必要条件,而细胞治疗产品取材自人体,具有保持活细胞状态,可能进行基因改造,无法终末灭菌等特点,使其标准化制备的难度远大于传统化学药品。幸运的是到2015年时,我国治疗产业已经有了近十年的基础,很多行业内机构都有了标准化的意识,也正是从这一年起,细胞治疗领域开始出现了地方标准,以及后续的团体标准,而相关领域的国家标准、国际标准等各级标准也都随着产业发展不断涌现,使我国细胞治疗产业的发展规范化水平有了整体提升。
1 我国细胞治疗领域标准化发展现状
1.1 目前已经发布的各级标准分类分布情况
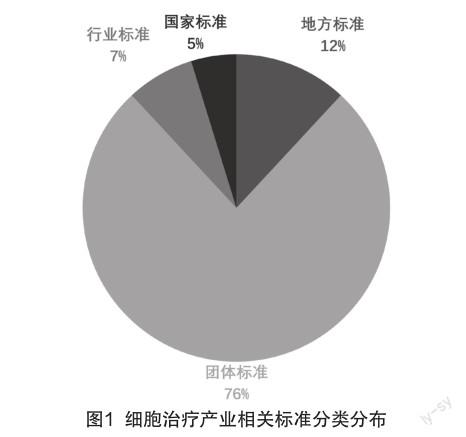
经过对目前已公示的地方标准、行业标准、团体标准、国家标准的搜索,截至2022年8月查询到有关细胞治疗产业的相关各级标准共计84项,其中国家标准4项,地方标准10项,行业标准6项,团体标准64项,依据分类划分,各类型数量占比如图1所示。
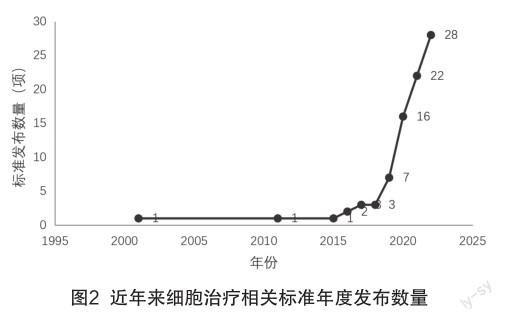
统计已发布标准的发布时间,按照各年份发布数量作图,如图2所示,可见2015年之前相关产业标准仅有2份,2015年至2018年少量稳步上升,2018年之后呈现类直线上升趋势。
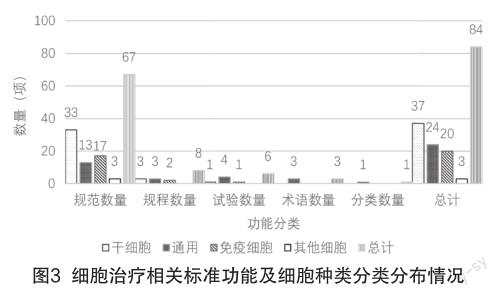
对已发布标准依据功能进行分类标记,再结合其规定对象分别以干细胞、免疫细胞、除干细胞/免疫细胞外的其他细胞及产业通用四类进行分类计数,如图3所示。
从以上整理的统计图表综合行业标准化发展历程得到以下结论:
(1)在行业标准化发展的早期,行政主管单位对细胞治疗行业的规范管理起到了极大的推动作用。以干细胞双轨制管理起步的2015年为里程碑,国内细胞治疗专业领域的第一项标准在细胞治疗产业起步较早,机构较多,发展较成熟的深圳,以地方标准化指导性技术文件的形式出现,当地的产业基础,“深圳标准”的发展战略,以及标准化行政主管单位对相关企业标准化的扶持推动,使得深圳成为我国细胞治疗产业相关标准的发源地,先后发布了SZDB/Z 126-2015《人类间充质干细胞库建设与管理规范》、SZDB/Z 185-2016《人类血液免疫细胞库建设与管理规范》、SZDB/Z 188-2016《细胞制备中心建设与管理规范》、SZDB/Z 266-2017《综合细胞库设置和管理规范》,也带动了国内其他产业较成熟地区,如长三角区域后续发布了一些相关的地方标准如DB33/T 2030—2017《人间充质干细胞库建设与管理规范》,DB32/T 3544-2019《临床级人体组织来源间充质干细胞 质量控制管理规范》。
(2)《标准化法》的修订推动了细胞治疗相关团体标准的发展,行业相关标准由政策导向向市场导向转变。2017年底,《中华人民共和国标准化法》修订通过,并于2018年1月1日實施,其中有一项带来巨大影响的修订内容就是在原有国家、行业、地方、企业四级标准的基础上,增加了团体标准,并对地方标准的主要对象进行了重新规划[3]。于是在2018年6月,深圳市细胞治疗技术协会将原计划以地标立项的四项细胞治疗产品标准以团体标准在国内率先发布,这一系列标准涵盖了当时较为主流的脐带来源间充质干细胞、脂肪组织来源间充质干细胞、外周血来源CIK细胞和外周血来源NK细胞,在国内首次把一类细胞制剂的各项检测指标以产品标准的方式进行呈现,对后来整个产业的规范发展,保障受试者生命安全方面起到了一定的引领作用。随后国内一些生物医药行业团体,区域性行业团体逐步发力,到2020年开始了细胞治疗领域团体标准的井喷式发展,例如中国细胞生物学学会发布的T/ CSCB 0001—2020《干细胞通用要求》以及后续近十项细胞产品标准,中国医药生物技术协会发布的T/CMBA 011-2020《人外周血单个核细胞的采集、分离和保存》。相较于行政主管单位引导下以建设管理规范为主的标准,团体标准体现了更多的实用性和独特性。
(3)随着产业标准化发展的日趋成熟,已发布标准的功能分类也越来越全面,标准对行业技术进步、产品质量提升的促进作用越来越明显。虽然规范仍是占比最大的,但已经开始出现产品、试验、规程、术语等功能类别的标准[4];在细胞的分类上,早期以干细胞居多,CAR-T细胞治疗产品在美、中先后准入上市之后,作为法规的补充,国内一些产业联盟或团体对免疫细胞治疗产品的研究技术、环境、试验方案等的团体标准陆续发布,例如:中关村玖泰药物临床试验技术创新联盟发布的T/CGCPU 017—2021《CAR-T细胞制品临床研究质量控制要求》;江苏省预防医学会发布的T/JPMA 008—2020《药用纳米氧化铁示踪剂标记临床级人脐带间充质干细胞的技术规范》等团体标准,这些团体标准紧跟技术进步,产业风向,快速高效的发布流程有效地减少了团体内机构的探索成本,促进了技术发展,效率提升;更为细分的标准对象或内容,使得产业链配套支持环节、技术更为完善,有助于细胞治疗产品的质量保障。
1.2 已发布细胞治疗相关标准的内容分析
对已发布的细胞治疗相关标准依据其主要内容进行分类,形成类似标准体系表如图4所示。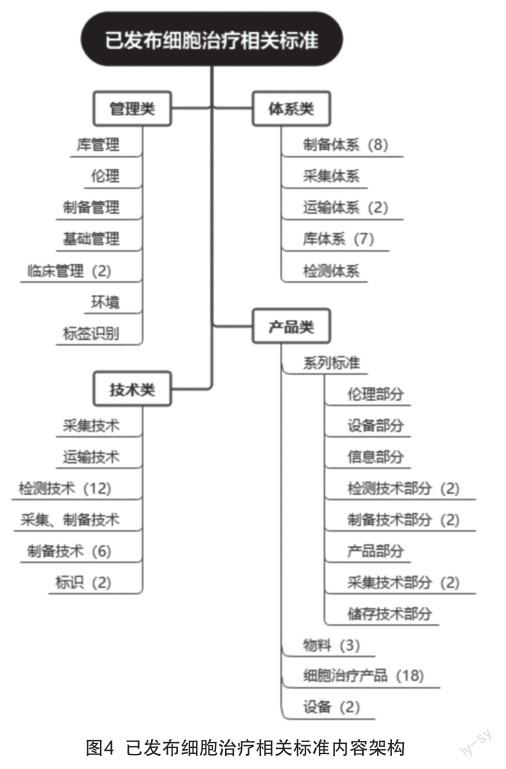
结合细胞治疗产品的实现流程进行分析,呈现以下的特点:
(1)当前已发布的细胞治疗相关的体系类标准,与药物管理法规——即GxP系列规范的模式近似,以细胞治疗产品实现过程的各主体机构划分,覆盖了采集、制备、检测、储存、运输等主要环节。
1)其中与《药品生产质量管理规范》相似的《细胞制备中心建设与管理规范》是对细胞生产制备机构——细胞制备中心进行质量管理体系建设的规范性标准,在细胞治疗产品相关的体系类标准中处于最核心的位置,已发布的标准的结构和内容也多与GMP类似,在我国细胞治疗产业发展的初期,很多是以地方标准的形式发布实施,其基础性概括性的内容对当地产业发展起到了指引作用。
2)以细胞库即储存环节为主要对象的体系标准,与制备中心标准往往配套出现,相辅相成,适用于细胞治疗产品储存环节的管理。但是在细胞治疗产业发展的更早期,人源活体细胞库这种较细分形式的细胞库从血库或生物样本库等机构中分离出来的时候,往往延续原来成熟的管理模式,所以我国最早的几份细胞库的体系管理标准通常包括的环节更全面,细胞库作为主体机构,囊括了采集、制备、信息管理,检测、运输、发放的全部职能。不过随着产业发展,各机构功能细分,管理更为规范化之后,较早的几份细胞库标准已经不再适用。
3)随着产业规模扩大,开始出现专业化机构负责制备原料的采集、运输,细胞产品的运输、过程和终产品检测等环节,相应的以这些机构为主体对象的体系标准也随之出现。
(2)管理类、技术类和产品类的标准,基本是产业发展到一定程度,出现了更精细的规范化需求后陆续制定发布的,这三大类标准的内容相对体系类标准定位更加精准:
1)管理类标准着眼于一些具体问题,对免疫细胞或干细胞产品通用的如环境要求、伦理、标识、编码、分类、名词、定义、临床应用等,也有仅适用于某一种/类产品的细胞库,制备流程管理。这一类标准对具体问题进行详细阐释,或是对具体流程进行验证形成经验总结,对已经建立起管理体系的机构来说,有助于其通过这些有针对性的管理类标准得到启发或引导,可能得以解决一些瓶颈问题,或是发现改进契机。
2)细胞治疗产业相关的产品类标准的内容和范围则更为庞杂,其中有一些是针对某一特定细胞产品的性能特征制定的标准,还有一些是针对与细胞治疗产品实现相关的专有试剂、设备或物料所制定,这两部分都是以描述某一种产品的特性为主,是通常所理解的产品标准。还有几个系列标准,则是按照某一产品实现过程中的各关键环节进行编写,可以说一个系列标准自成体系,形成了广义上的产品标准,其各部分之间内容各有偏重,相互联系而又重点突出。
3)技术类的标准是最具有交叉实用性的,如采集技术,通常在临床操作技术的基础上进行特定组织采集的便利化改良;运输技术则强调了冷链运输中的深低温保存;而制备技术尽管每一种细胞治疗产品可能有其独特的制备工艺,但是所使用的基本生物学技术手段是共通的;检测技术则要分为安全性和有效性两方面来看,安全性检测均为经过行政审批的试剂盒,所使用的方法标准化程度很高,而有效性则因为细胞种类特征的差别和制备技术的独特性,有较多非标方法,就这一方面而言还存在比较大的标准化发展空间。
1.3 已立项标准的内容发展趋势
除了已经发布的标准,查询各类已立项标准,可以看出整个产业即包括了行政主管单位、研发机构、生产制备机构、细胞保存机构、检验机构、物料供应商、服务供应商的一系列相关方,都意识到标准化对产业发展的良性正向推动作用,也在通过建立标准去引导行业发展的方向。例如:
(1)已立项的国家标准中,有等同采用国际标准的《生物技术 细胞计数 第1部分:细胞计数方法通则》,也有国家级标准化技术委员会主导的规范或技术标准,如《细胞培养洁净室设计技术规范》《洁净室及受控环境中细胞培养操作技术规范》《细胞培养过程中苯乙烯单体、2-氯乙醇残留量测定GC-MS法》《实验细胞资源共性描述规范》《生物样本 多能干细胞通用要求》。这些已立项国标的适用范围更广泛,所针对的对象更基础,弥补了团标因市场化导向所欠缺的部分。
(2)近期立项尚未发布的团标中,以区域性专业协会的团标为主,例如新疆维吾尔自治区社会办医疗机构协会立项的有关“细胞库数字化建设”和“细胞库评价”的团体标准,在内容上和之前的团标有相似之处,又存在本协会所涉及的“星级评价”专有内容。又如中关村中慧先进制造产业联盟立项的《CAR-T细胞培养制备中一次性耗材技术标准》,适用对象范围窄,对成员机构专注于CAR-T细胞治疗产品研发生产的该联盟来说则具有很强的实用性。
(3)除了国家标准和团体标准,行业标准在细胞治疗产业相关标准中较少出现,不过医药(YY)和卫生(WS)两大类行业标准中有许多已立项或新发布标准与细胞治疗行业有着密不可分的关系,如有关生物安全管理、检测检验技术、设备物料、实验室管理等内容的标准,也同樣适用于细胞治疗产业的检测和制备环节。需注意的是这两类行业标准一般由行政主管单位主导,与行政法规管理内容和审批事项相关度较高,所以其适用范围往往会限定在目前法规管理比较明确的医疗机构和诊断类试剂/设备,对于业务链条比较长的细胞治疗产业来说,可以在相应的环节选择适用的标准参考使用。
2 我国细胞治疗产业发展现状
分析了我国细胞治疗产业相关的标准化情况,结合影响产业发展的外在环境等因素,总结一下我国细胞治疗产业的发展现状。
(1)我国细胞治疗产业目前已经进入规范化发展阶段。2022年10月31日,国家药品监督管理局食品药品审核查验中心(以下简称CFDI)发布了《细胞治疗产品生产质量管理指南(试行)》[5],这一指南在此前曾经分别于2019年和2022年发出的两版“GMP-细胞治疗产品附录”征求意见稿的基础上,加强了对细胞治疗产品原材料采集和临床应用的关注,还提出,对原材料的采集要结合《生物安全法》和《人类遗传资源管理条例》的要求,并对储存、检测、运输的相关设施或机构也提出了一定要求。整体上来讲,从此前以GMP附录的形式到单列为“细胞治疗产品”的指南,这一部行政主管单位所发布的指南,较好地体现了细胞治疗产业与检测、医疗、生物样本库、生物冷链运输等产业的交叉性,也体现了对这类活细胞制备的药品更具适应性、独立管理的特点。
(2)产业门类划分更清晰,产品种类日趋丰富,盈利能力和规模不断提升。因为国家政策的引导和近年来产业技术的革新,细胞治疗产业从免疫细胞、干细胞两大类的初期分类,到后面延伸出目前已经正式获批上市在肿瘤治疗中发挥重要作用的CAR-T细胞,在再生医学领域有所突破的iPS细胞,以及来源于间充质干细胞的外泌体,经基因修饰的干细胞产品等。整个社会对细胞治疗产品的认知度和接受度较十几年前已经发生了极大的转变,仅就CAR-T疗法一类,根据全球已披露的6款CAR-T疗法营收数据来看,2021年合计17.14亿美元(约109亿人民币),超过百亿人民币。其中诺华的Kymriah营收5.87亿美元,同比增长23.84%,吉利德/Kite的Yescarta营收6.95亿美元,同比增长23.45%。这两款属于上市时间较早,比较成熟的CAR-T疗法,继美国上市后在我国获批,良好的市场前景带动了国内数十家企业开展CAR-T细胞药品的研究和申报。
(3)尽管我国细胞治疗产业在蓬勃发展,却很明显地存在区域发展不均衡,产业链各环节发展不均衡的情况:
1)截止到2022年9月,在我国已获准默许进入临床试验(IND)的36款干细胞药物在各省(直辖市)分布数量如图5所示,通过IND的数量很直观地反映了各地细胞治疗企业分布数量、人才能力、技术水平和相关配套产业完整程度,甚至是当地相关行政主管单位的政策扶持力度。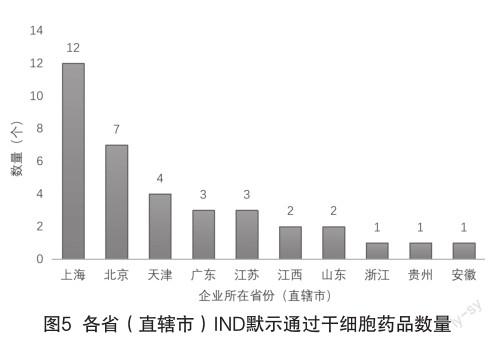
2)细胞治疗产业链中,最关键的自然是中游的细胞制备企业相关的“研发→制备→应用”环节,经过十余年的集中发力,我国细胞制备企业的综合能力和规模都不逊于美国同类企业。但是近三年因为全球性的疫情导致的供应链问题,使得我国细胞治疗产业各环节发展不平衡的隐忧也一并暴露出来,一次性耗材、试剂、培养基、实验及检测设备这些与细胞治疗产品质量息息相关的关键物资,在企业的厂房或实验室里,大多数仍是行业中所熟知的国际品牌,如耗材类的“康宁、NUNC”,试剂类的“赛默飞”,设备类的“罗氏、BD”等,国产品牌如“迈瑞、海尔、威高”等只在生化检测、低温、压力设备方面占据了部分市场份额。
3)尽管许多外企在国内建有生产工厂,但是核心研发生产基地往往仍以其全球总部为主,如流式细胞仪、显微镜等设备存在货期长、价格高等问题。近年因为中美贸易战等因素,一些耗材类生产工厂迁出,新的工厂却出现产品质量问题频发的情况,对国内细胞治疗企业来说,在供应链不稳定的疫情期间,如何避免看似简单的“移液管、培养瓶”等小问题影响细胞产品质量,如何寻找合格稳定的国产替代品,已经成为迫在眉睫的麻烦。
3 建 议
3.1 继续完善标准体系
结合已发布或已立项尚未发布的标准来看,目前我國细胞治疗产业的标准体系仍有很大的可完善空间,企业、协会、联盟等机构之间存在一定的各自为政现象,从实用的角度已经发布了体系、产品等标准,但是对于一些需要达成更广泛共识的标准化对象则还没有涉及。
例如,目前欧美地区细胞类产品使用范围最广的ISBT128编码系统,是由国际血库自动化共性理事会ICCBBA发起的一个标准编码系统,这个系统从血库编码起始[5],目前已经扩展使用在细胞治疗产品、生物样本库等许多涉及捐献人识别的生物样本标准化管理中,并且该协会联合使用机构基于ISBT128系统对不同来源不同制备方法的细胞治疗产品进行了标准命名,制定了名称术语分类标准,使得使用该系统的机构都能够追溯识别产品的全链条各环节[6],有效地保障了细胞治疗产品的应用质量。
目前我国还没有建立细胞治疗产品名称分类标准或编码标准,尤其是以中文名称为标准化对象的基础性标准,同一产品会因为不同的名称造成误解;缺乏共识的编码系统,会造成采集、制备、应用各环节间信息沟通的阻碍。为了产业的健康发展,有必要完善此类基础性标准的制定。用以保障细胞治疗产品的追溯和流通,促进细胞治疗产品从研发到临床应用的转化过程。
3.2 关注配套环节/因素
细胞治疗产品实现所需的配套环节多,涉及的学科技术庞杂,整个链条中可能影响产品质量,影响供者和受者身体健康的因素众多,这些因素中有些是细胞治疗产业所特有的,更多的则与医疗、制药、生物技术等产业存在交叉,其中有一些部分,我国的企业发展时间不足,积累较少,且因为产品使用的惯性,市场长期被一些国际知名品牌占领,现有的很多设备、试剂、耗材相关标准往往都基于已有的这些品牌的产品制定。
以近期引起较多关注的体外诊断(IVD)产业来说,我国大部分IVD厂商仍处于初级阶段,他们最早往往从代理或模仿国际知名品牌起家,在别人制定的标准框架下发展,目前的产品线还在“由易到难”的过渡阶段,如流式细胞仪、血培养仪等仪器品类,还不能与国际知名品牌抗衡。疫情因素带来的核酸检测(NAT)相关设备及物料、试剂的发展机遇以外,因国际形势影响导致供应链问题,使得国内细胞治疗企业转向寻求国产替代,在一些成熟产品品类上有了市场规模突破的更大可能性,比如培养容器、移液计量耗材类产品,使用量大,技术含量低,但对产品质量要求高,若国产企业能够抓住机会,建立行业性标准,确保产品质量满足细胞产品制备需求,有望改变目前行业内国际品牌主导的情况。
除了交叉产业的厂商加大研发力度,抓住发展机遇之外,细胞治疗产业所特有的一些配套环节中,我国企业呈现了一定弯道超车的趋势。例如针对细胞治疗产品的制备,尽管人工操作仍是当前产业的主流生产方式,但是近年来已经有很多细胞制备机构开始自研或联合研制自动化封闭细胞培养及检测设备,在这些与国外厂商站在同一起跑线上的配套环节,我国人口和人才的规模优势得以体现,同时还能扩大影响到专用的试剂、耗材供应商,例如适配特定形状的专用耗材。如果这些企业能够把握技术优势,加强合作,通过申请专利和制定标准,占据市场优势地位,塑造良好品牌,有可能促进整个细胞治疗产业实现跨越式发展。
3.3 定向政策法规支持
近些年针对细胞治疗产业的利好政策及行政法规陆续发布,推动了产业的规范化发展,随着产业发展壮大,更多细分领域、配套环节的资源需求和管理引导需求也在不断呈现。通过集中规划产业园区,因地制宜建设相关配套设施及政策支持,可以带动区域经济,局部试点助力新技术快速转化,如“博鳌乐城国际医疗旅游先行区[7]”和“河套深港科技创新合作区[8]”均是已经在先进生物医疗技术方面做了不少努力的范例。
在分析我国细胞治疗产业发展现状时提到,目前基础性标准建设欠缺,仅靠企业或行业协会自发行动,往往存在一定壁垒,如果通过定向政策引导,资源投入,由行政主管单位牵头,组织行业内机构,需要时与国际标准化组织合作,制定或转化形成适合我国的标准,则能大大提高协作效率,提高产业内资源流通,促进技术发展。
借鉴我国生物样本库行业的发展经验,近几年,如GB/T 37864-2019《生物样本库质量和能力通用要求》、GB/T 39768-2021《人类生物样本分类与编码》及相关样本库国家标准的立项及发布,为我国生物样本资源的标准化保藏和应用提供了很多支持[9],除国家级别的基因库、细胞库等样本库之外,各省市都出现了依托医院等机构建立的标准化样本库,彼此之间可以对病理样本、细胞株等资源共享,标准一方面促进了样本库的普及,一方面通过标准化的管理提高了样本库的管理效率和资源利用效率,也对我国的医学事业进步起到了很好的促进作用。
4 结 语
2022年12月30日,深圳市第七届人大常委会第十四次会议正式表决通过《深圳经济特区细胞和基因产业促进条例》,作为我国首部针对细胞和基因产业的地区性法规,可以说是“天时地利人和”的结果,相信这部法规正式实施后能够促进深圳的细胞和基因产业健康发展,并能起到深圳社会主义先行示范区的示范作用,带动我国细胞治疗产业规范有序的发展,继而优势领域带动薄弱环节,促进产业间配合,为我国“大健康”事业添砖加瓦[10]。
参考文献
[1]YIN C, GAO J, LI G, et al. Gene and cell therapies in China: booming landscape under dual-track regulation[J]. J Hematol Oncol. 2022;15(1):139.
[2]佚名. 食药监总局药品审评中心发布细胞治疗产品申请临床试验药学研究和申报资料的考虑要点[J]. 中国医药生物技术, 2018,13(2):188.
[3]李毅“.团体标准”舆情与政策供给的大数据分析——兼论广东科技服务业团体标准发展策略[J].标准科学,2018(3):21-26.
[4]白殿一,刘慎斋,王益谊,等,标准化文件的起草[M].北京:中国标准出版社,2020.
[5]励修楣. 采供血系统的编码标准ISBT-128[J]. 中国输血杂志, 2007,20(5):2.
[6]BOLTON W,ASHFORD P,BARNETT D,et al. ISBT 128 STANDARD Technical Specification, Version 6.1.0[M]. San Bernardino, USA: ICCBBA, 2021.
[7]晋菲斐,姚晨,马军,等.高效可行的临床真实世界数据采集模式探索——海南博鳌乐城国际医疗旅游先行区的实践[J].中国食品药品监管,2020(11):21-31.
[8]佚名. 小地盘孕育大未来——福田加快河套深港科技创新合作区建设[J]. 特区经济, 2021(10):2.
[9]翟培军,李军燕,胡冬梅,等.生物样本库国际认可和标准化发展与前景[J].中华临床实验室管理电子杂志,2017,5(1):6-8.
[10]深圳市发展和改革委员会.政策观察:深圳市培育发展生物医药产业集群行动计划(2022-2025年)[EB/OL].(2022.06.30)[2023.01.16].http://fgw.sz.gov.cn/zwgk/zcfgjzcjd/zcjd/content/ post_9924938.html.
作者簡介
李婵,硕士,工程师,主要从事细胞治疗质量和标准化管理。
杨磊,本科,工程师,主要从事生物制药质量和标准化管理。
廖延,博士,高级工程师,主要从事干细胞转化应用研究。
(责任编辑:袁文静)
