紫梗籽银桂种子发育过程中内源激素含量的动态变化研究
2024-01-20朱永莉沈永宝
朱永莉,沈永宝
(1.上海商学院艺术设计学院, 上海 201400;2.南京林业大学风景园林学院,江苏 南京 210037;3.南京林业大学林学院,江苏 南京210037;4.国家林业局南方林木种子检验中心,江苏 南京 210037;5.南京林业大学南方现代林业协同创新中心,江苏 南京 210037)
激素作为植物自身代谢过程中产生的一类特殊的微量小分子,在植物生长发育的各个阶段起着重要的信号调节作用[1-2]。许多研究表明,生长素(IAA)[3]、细胞分裂素(CTK)[4]、赤霉素(GA)[5]、脱落酸(ABA)[6]、乙烯[7]、油菜素内酯(BR)[8]等植物激素对种子发育具有重要作用。种子发育过程不仅与植物内源激素的绝对含量有关,而且还与各类激素之间的比值密切相关,各激素间的动态平衡可能对种子的发育影响更大[9],特别是促进生长与抑制生长的激素之间的动态平衡关系[10]。
桂花(Osmanthus fragransLour.)作为著名的庭院观赏树木,在我国已有2 500 多年的栽培历史,相关研究及推广应用非常广泛,但与桂花繁殖生物学相关的研究仅限于胚胎学[11-13]、传粉生物学[14-15]及少量的种子生物学(种子休眠及解除)[16-19],目前尚未见桂花种子发育过程中内源激素含量变化的相关研究。本研究选取种子结实量大且具有休眠特性的重要桂花品种紫梗籽银桂为研究材料,通过对桂花种子发育过程中生长素、细胞分裂素、赤霉素和脱落酸等激素含量变化的分析,揭示内源激素在桂花种子发育过程的调控作用,分析桂花种子不同发育期内源激素的动态变化及其对种子发育的影响,旨在为了解内源激素对桂花种子发育的调控规律提供科学参考。
1 材料与方法
1.1 材料
紫 梗 籽 银 桂 (Osmanthus fragrans‘Zigengziyin’)种子采于南京市八卦洲街道院内。紫梗籽银桂花期9—10 月,果实成熟于次年4—5 月。胚乳于花后80 d 开始取样,胚自花后180 d 开始大量形成并进行取样,至翌年果实成熟每隔15~20 d 进行取样,胚乳共取样10 次,胚4 次(如图1 所示)。采集的材料用冰盒带回实验室后立即去除果皮取出种子,分别剥离胚和胚乳,放入-76 ℃超低温冰箱保存备用。

图1 紫梗籽银桂种实发育过程的形态变化Fig.1 The change during fruit development of Osmanthus fragrans ‘Zigengziyin’
1.2 试验方法
采用酶联免疫吸附法(ELISA)分别对胚和胚乳进行内源激素含量的测定,激素含量使用鲜质量表示,单位为ng·g-1,3 次重复[20]。
1.3 数据分析
采用MicrosoftExcel 2013 软件进行试验数据分析处理和图表制作,方差分析采用SPSS20.0。
2 结果与分析
2.1 紫梗籽银桂种子发育过程中胚的内源激素含量变化
2.1.1 生长素(IAA)含量变化 胚中IAA 的含量呈先上升后下降再快速上升的趋势(图2A)。花后180 d,胚中IAA 含量为31.34 ng·g-1,至花后195 d,随着种子的发育IAA 含量上升,达到37.62 ng·g-1,之后至花后210 d,随着种子逐渐成熟,胚中IAA 含量有所下降,为33.16 ng·g-1,之后随着种子发育成熟IAA 含量快速上升,至花后225 d,胚中IAA 含量达到59.26 ng·g-1,上升了26.11 ng·g-1。

图2 紫梗籽银桂种子发育过程中胚的IAA、ZR、GA3、ABA 含量变化Fig.2 The change of IAA、ZR、GA3、ABA content in the embryo during seed development of O.fragrans‘Zigengziyin’
2.1.2 玉米素核苷(ZR)含量变化 胚中ZR 的含量在种子发育过程中呈先上升后下降再快速上升的趋势(图2B),变化趋势同IAA。花后180 d胚中ZR 含量为3.17 ng·g-1,至花后195 d 达到4.56 ng·g-1,之后随着种子发育的进一步成熟,胚中ZR 含量有所下降,为3.75 ng·g-1(花后210 d),至花后225 d,胚中ZR 含量达到7.81 ng·g-1,上升了4.06 ng·g-1。
2.1.3 赤霉素(GA3)含量变化 胚中GA3的含量表现出先略有上升后逐渐下降并保持平稳(图2C)。花后180 d 胚中GA3含量为6.14 ng·g-1,至花后195 d,GA3含量略有上升(6.25 ng·g-1),之后随着种子发育的进一步成熟,胚中GA3含量有所下降,至花后210 d 为4.86 ng·g-1,花后225 d GA3含量基本保持平稳为4.93 ng·g-1,比花后180 d 仅下降了1.21 ng·g-1,总体上看,GA3呈下降的趋势。
2.1.4 脱落酸(ABA)含量变化 胚中ABA 的含量呈持续上升趋势(图2D)。花后180 d 胚中ABA 含量为43.93 ng·g-1,至胚大量形成并进入快速发育阶段(花后195 d),其内ABA 含量快速上升(上升了41.15 ng·g-1,达85.08 ng·g-1),之后ABA 含量持续上升,种子发育成熟(花后225 d),胚中ABA 含量达到111.73 ng·g-1,比花后180 d 上升了67.80 ng·g-1。
2.1.5 GA3/ABA、IAA/ABA、ZR/ABA 比值变化
随着紫梗籽银桂种子的不断发育,胚中GA3/ABA的比值呈持续下降趋势,由花后180 d 的0.14 至花后225 d 种子发育成熟下降至0.04,下降了0.10,下降幅度达71.43%;IAA/ABA、ZR/ABA的比值则呈现先下降、自花后210 d 开始上升的趋势,IAA/ABA 的比值在花后180 d 为0.71,至花后210 d 下降到0.36,比值下降了0.35,之后开始上升,至花后225 d 种子发育成熟IAA/ABA 的比值上升至0.53,比花后210 d 上升了0.17;ZR/ABA 的比值由花后180 d 的0.07 至花后210 d 下降到0.04,比值下降了0.03,之后开始上升,至花后225 d 种子发育成熟ZR/ABA 的比值上升至0.07,比花后210 d 上升了0.03。由此可以看出,随着紫梗籽银桂种子的发育成熟,胚中GA3/ABA 比值的变化幅度大于IAA/ABA、ZR/ABA的比值变化(图3)。
2.2 紫梗籽银桂种子发育过程中胚乳的内源激素含量变化
2.2.1 生长素(IAA)含量变化 胚乳中IAA 的含量整体呈现下降趋势(图4A)。花后80 d,胚乳中IAA 含量为99.33 ng·g-1,至花后180 d,随着胚陆续出现,种子发育趋于成熟,IAA 含量下降至40.49 ng·g-1,至花后195 d 略有上升,之后随着种子发育成熟IAA 含量继续下降,至花后225 d,胚乳中IAA 含量达到43.96 ng·g-1,比花后80 d 下降了55.37 ng·g-1,下降幅度达55.74%。

图4 紫梗籽银桂种子发育过程中胚乳的IAA、ZR、GA3、ABA 含量变化Fig.4 The change of IAA、ZR、GA3、ABA content in the endosperm during seed development of O.fragrans ‘Zigengziyin’
2.2.2 玉米素核苷(ZR)含量变化 胚乳中ZR 的含量在种子发育过程中总体呈现下降趋势(图4B)。花后80 d,胚乳中ZR 含量为19.36 ng·g-1,至花后150 d, 随着种子的发育ZR 含量下降至8.24 ng·g-1,花后165 d,胚乳中ZR 含量略有上升,花后195 d,随着种子发育的逐渐成熟,胚大量出现,胚乳中ZR 含量有所下降,至花后225 d 种子发育成熟,胚乳中ZR 含量基本保持平稳状态为8.30 ng·g-1。
2.2.3 赤霉素(GA3)含量变化 胚乳中GA3的含量整体呈现下降的趋势(图4C)。花后80 d,胚乳中GA3含量为18.25 ng·g-1,之后随着种子的发育GA3含量快速下降,花后120 d,胚乳中GA3含量下降至6.86 ng·g-1,至花后195 d,随着种子的发育不断成熟,胚乳中GA3含量一直保持比较平稳的状态,至花后225 d 种子发育成熟GA3含量为5.66 ng·g-1,基本保持平稳,比花后80 d 下降了12.59 ng·g-1。
2.2.4 脱落酸(ABA)含量变化 胚乳中ABA 的含量总体呈先下降后上升的趋势(图4D)。花后80 d,胚乳中ABA 含量为88.83 ng·g-1,之后随着种子的发育,至花后120 d,胚乳中ABA 含量下降至56.43 ng·g-1,随着种子不断发育成熟,胚乳中ABA 含量不断上升,至花后150 d,胚开始出现,胚乳中ABA 含量上升至83.77 ng·g-1,之后至花后225 d 种子发育成熟,胚乳中ABA 含量基本保持平稳为88.02 ng·g-1。
2.2.5 GA3/ABA、IAA/ABA、ZR/ABA 比值变化
如图5 所示,紫梗籽银桂种子发育过程中胚乳的GA3/ABA、IAA/ABA、ZR/ABA3 个比值总体均呈现下降趋势。GA3/ABA 的比值呈持续下降趋势,由花后80 d 的0.21 至花后225 d 种子发育成熟下降至0.06,下降了0.15,下降幅度达71.43%;IAA/ABA 的比值自花后80 d 至花后180 d 不断下降,由花后80 d 的1.12 至花后180 d 下降至0.47,之后略有小幅波动,至花后225 d 种子发育成熟时为0.50,整体下降了0.62,下降幅度达55.36%;ZR/ABA 由花后80 d 的0.22 至花后225 d 种子发育成熟时降至0.09,下降了0.13,下降幅度达59.09%,胚乳中GA3/ABA 比值的变化幅度大于IAA/ABA、ZR/ABA 的比值变化。
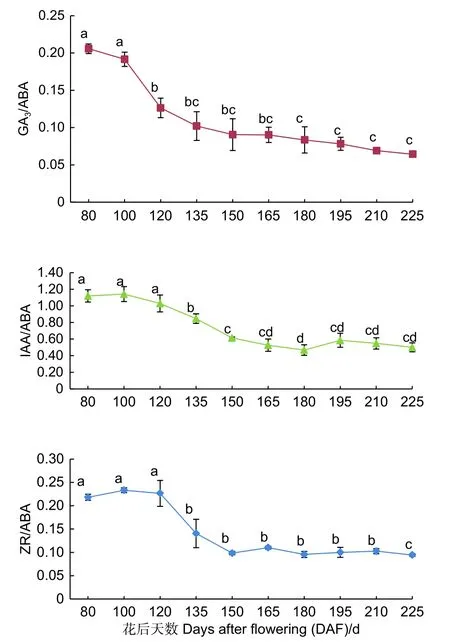
图5 紫梗籽银桂种子发育过程中胚乳的GA3/ABA、IAA/ABA、ZR/ABA 比值变化Fig.5 The change of GA3/ABA、IAA/ABA、ZR/ABA in the endosperm during seed development of O.fragrans ‘Zigengziyin’
3 讨论
生长素(IAA)、赤霉素(GA)、细胞分裂素(CTK)和脱落酸(ABA)等植物激素在种子的发育和萌发过程中起着重要的信号调节作用[21]。通常高水平的IAA 通过细胞伸长实现种子的膨大[22-24],且在种子发育过程中IAA 在前期的作用强于发育后期[20,25-26]。CTK 能促进细胞分裂与膨大、诱导芽的增殖、促进果实生长、延缓植物衰老过程[27],其中高等植物中存在的细胞分裂素大多是玉米素(Z)或其衍生物玉米素核苷(ZR)。玉米素核苷(ZR)在种子发育过程中对调节细胞分裂和促进蛋白质的合成起着重要的作用[28],调节种子的营养物质代谢,同时促进同化物质运至果实以利于幼果的发育。赤霉素(GA)在种子发育过程中可通过促进生长素的合成而促进种子的生长发育[29]。通常ABA 在植物种子成熟过程中含量明显提高[20,30],但有研究表明ABA 在植物胚发育过程中具有双重性,在胚形成早期可促进胚生长[31],而在胚胎发育晚期通过拮抗GA 来阻止胚继续生长,促进种子休眠[32],如拟南芥和水稻在种子发育中期和后期出现两个峰值,第二个峰值只有第一个的1/3[33]。
本研究的结果表明:在紫梗籽银桂种子发育的整个阶段,胚中IAA 和ZR 含量均呈先上升、后下降和再上升的 “波浪型”变化,说明IAA 和ZR 的含量与胚的发育没有很强的对应关系,这也从另一方面表明IAA 和ZR 可能和其它激素共同作用调节种子的发育进程,这一结果与北细辛(Asarum heterotropoidesvar.mandshuricum)种子发育基本一致[34]。紫梗籽银桂种子发育过程中,胚中GA3含量整体呈下降趋势,ABA 含量不断上升;胚乳中GA3含量呈下降趋势,ABA 含量呈先下降后上升并保持平稳的趋势,表明ABA 在前期有促进种胚发育,而在后期促进紫梗籽银桂种子的休眠,这与陈在新[35]、闫晓娜[36]和刘欢[37]等人的研究结果基本一致,同时也进一步验证了GA 与ABA 在调节种子发育过程中二者具有拮抗作用。
种子的发育过程不仅与各激素的含量有关,还与各类激素之间的比例平衡有关[38-39]。本研究结果表明,紫梗籽银桂种子发育过程胚中GA3/ABA 比值不断下降,IAA/ABA、ZR/ABA 的比值先下降后上升,胚中GA3/ABA 比值的变化幅度大于IAA/ABA、ZR/ABA 的比值变化;胚乳中GA3/ABA、IAA/ABA、ZR/ABA3 个比值总体均呈现下降趋势,与激素变化的趋势相一致,进一步验证了种子发育进程是受各激素含量变化及其比值共同调控的。
4 结论
紫梗籽银桂种子发育过程中胚和胚乳的内源激素含量及其比值呈现一定的动态变化:其中GA3和ABA 含量的变化趋势相反,IAA 和ZR 的含量与胚的发育没有很强的对应关系;GA3/ABA 比值呈下降趋势,变化幅度大于IAA/ABA、ZR/ABA 的比值,GA3和ABA 的含量及其比值变化共同调控种子的发育进程,进一步说明种子发育过程不仅与植物内源激素的绝对含量有关,还与各类激素之间的平衡有关,尤其是促进生长与抑制生长的激素之间的平衡可能在种子发育过程中具有关键作用。
