酒精性肝炎自噬关键基因的筛选及生物信息学分析
2024-01-19袁超练庆海尼贝贝许燕张彤张剑
袁超 练庆海 尼贝贝 许燕 张彤 张剑
酒精性肝炎(alcoholic hepatitis,AH)是酒精性肝病的急性临床表现[1],其发病机制由多种因素造成,除遗传因素外,也与酒精诱导的肝损伤、活性氧、脂肪变性、炎症等有关[2-5]。持续的慢性肝损伤会导致肝纤维化、肝硬化和肝衰竭[6-8],最终可能发展为肝细胞癌[9]。戒酒是AH 的最佳治疗方法[10],如继续进展至肝硬化或肝细胞癌等晚期疾病,可能需要肝移植[11]。早期肝移植可以提高药物治疗无效的重度AH 患者的生存率,但高昂的手术费用及术后很可能恢复饮酒习惯使得患者施行肝移植手术的意愿低[12]。因此,迫切需要探索新的AH 治疗方法。
自噬在维持细胞内稳态、清除老化或异常细胞成分等方面发挥着重要的作用[13-17],从而影响细胞代谢、免疫调节、细胞凋亡和疾病的发生与发展[18]。自噬在清除肝细胞中的脂滴方面起着关键作用[19],长期饮酒会抑制自噬,从而降低脂质清除率[20]。而急性酒精摄入可能会激活自噬,进而去除受损的线粒体和积累的脂肪酸[21]。这意味着对AH 患者来说,自噬对减少酒精带来的肝损伤至关重要[22],增强自噬可能是AH 的治疗策略[23]。然而自噬与酒精性肝炎之间的具体调控机制尚未明确。本研究拟通过生物信息学的方法,将酒精性肝炎和自噬进行交叉分析,筛选出与AH 自噬相关的基因[24],探讨能预测AH 患者预后的生物标志物及治疗靶点[25],旨在为改进AH 的诊断、疾病风险预测以及个性化治疗方案制定提供了新的视角及解决方案。
1 材料与方法
1.1 AH 芯片数据源
笔者从基因表达综合(Gene Expression Omnibus,GEO)数据库官方网站(https://www.ncbi.nlm.nih.gov/geo/)下载了AH 芯片数据集(GSE28619、GSE142530)及其对应的临床数据文件。GSE28619 包含22 个样本的基因表达谱,包括15 个AH 样本和7 个正常肝脏样本,GSE142530 包含28 个样本,包括10 个AH 样和12 个正常肝脏样本,以及6 个肝硬化样本。
1.2 生物信息学分析方法
1.2.1 基因表达差异分析 通过GEO2R 工具进行分析。将|log2FC|>1 且P<0.05 的基因被视为差异表达基因(differentially expressed gene,DEG)。从GeneCards(https://www.genecards.org/)和MSigDB(https://www.gsea-msigdb.org/gsea/msigdb)数据库下载分别得到1 0 3 9 2 个和6 4 6 个自噬相关基因(autophagy-related gene,ARG)。DEG 和ARG 之间一致的基因被鉴定为差异性表达的自噬相关基因(differentially expressed autophagy-related gene,DEARG)。使用R 软件(版本3.6.3)创建热图、火山图。
1.2.2 加权基因共表达网络分析 利用R 软件构建AH 的加权基因共表达网络分析(weighted gene coexpression network analysis,WGCNA)表达矩阵。为综合考虑W G C N A 筛选的与A H 相关的基因、DEG 和ARG,使用韦恩图分析这三者之间的共同基因。最终获取了与AH 显著相关的11 个关键自噬相关基因(hub 基因)。
1.2.3 关键基因蛋白质相互作用网络的构建 为了深入研究这11 个自噬基因的功能网络,采用TRING 数据库(https://string-db.org/),借助R 软件包构建了自噬基因的蛋白质相互作用(p r o t e i n-p r o t e i n interaction,PPI)网络。
1.2.4 基因本体和京都基因与基因组百科全书通路富集分析 使用R 软件进行基因本体(gene ontology,G O)和京都基因与基因组百科全书(K y o t o Encyclopedia of Genes and Genomes,KEGG)通路富集分析。校正后的P<0.05 为差异有统计学意义。
1.2.5 免疫浸润分析 通过使用CIBERSORT 算法来计算每个样本中T 细胞亚群、B 细胞、巨噬细胞等免疫细胞类型的比例。通过使用ssGSEA 算法来计算每个样本中免疫相关基因集的富集得分,从而了解免疫细胞在样本中的整体活性。在完成CIBERSORT 和ssGSEA 计算后,进行了相关性分析、差异分析等,以探究免疫浸润与自噬基因之间的关联。
1.2.6 自噬相关基因的验证以及AH 不同进展程度的分析 通过使用两个公共基因表达数据集GSE155907和GSE143318 来验证本研究筛选的11 个自噬基因的差异表达情况,用于探究自噬基因在AH 中的变化。通过使用GSE103580 数据集来对11 个自噬基因在AH 不同进展程度中的表达进行分期,研究11 个自噬基因在不同分期中的表达变化。使用M a n n-WhitneyU检验和可视化工具来分析GSE155907、GSE143318 和GSE103580 的数据,并进一步探究11 个自噬基因在AH 中的表达特征和与进展程度的关联。
1.2.7 mRNA-miRNA 调控网络的构建 使用miRNet 2.0(https://www.mirnet.ca/)预测免疫相关基因与其靶微小RNA(microRNA,miRNA,miR)和转录因子(transcription factor,TF)之间的相互作用。然后建立信使RNA(messenger RNA,mRNA)-miRNA和mRNA-TF 调控网络来描述mRNA、miRNA 和TF 之间的相互作用,作为AH 细胞的潜在靶点。最后使用mirPathv.3 数据库对这些预测得到的miRNA进行富集分析。
1.2.8 实时荧光定量逆转录聚合酶链反应 提取总R N A 并使用逆转录试剂盒逆转录成互补D N A(complementary DNA,cDNA)。根据实时荧光定量逆转录聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RT-qPCR)试剂盒说明书进行RT-qPCR。采用2-△△Ct计算mRNA的相对表达水平。
1.3 样本来源及主要试剂
1.3.1 样本来源 选取5 例AH 患者病肝和6 例健康供肝标本。入选标准:2022年1月1日至2023年6月30日在中山大学附属第三医院肝移植科进行非活体肝移植手术的受者及对应供者,受者年龄18~75 岁。排除标准:供者≥75 岁、重度脂肪变性供肝肝移植以及亲属活体肝移植。采样已获得中山大学附属第三医院伦理审查委员会的批准(伦理号:中大附三医伦[2022]02-122-01)。所有参与研究的患者签署了知情同意书。
无特定病原体(specific pathogen free,SPF)级6~8 周龄C57BL/6J 雌性小鼠购买自广东药康生物科技有限公司。AH 模型小鼠构建参考文献[26],通过检测各项指标(肝脏指数、肝功能指标、肝组织脂质代谢指标、肝组织病理学观察等)确认造模成功[26],选取8 例AH 模型小鼠和8 例正常小鼠的肝脏样本。动物实验已获得中山大学附属第三医院伦理审查委员会的批准(批准号:IACVC-F3-20-6 517)。
1.3.2 主要试剂 逆转录试剂盒(湖南艾科瑞生物工程有限公司,AG11711);RT-qPCR 试剂盒(南京诺唯赞生物科技股份有限公司,Q711-02)。
1.4 统计学方法
采用R 软件(版本4.1.3)进行统计学分析。符合正态分布的计量资料采用均数±标准差表示,组间比较采用t检验;不符合正态分布的计量资料采用中位数(下四分位数,上四分位数)表示,组间比较采用Mann-WhitneyU检验。P<0.05 为差异有统计学意义。
2 结果
2.1 DEARG 的鉴定
为了评估组内数据的重复性,对GSE28619、GSE142530 数据集进行主成分分析(principal component analysis,PCA),结果显示数据的重复性良好(图1 A、B)。差异表达分析显示,在GSE28619 中AH 组与对照组共有1 569 个DEG,其中856 个基因上调,713 个基因下调(图1C);在GSE142530 中AH 组与对照组共有3 242 个DEG,其中1 756 个基因上调,1 486 个基因下调(图1D)。同时,对这两个数据集进行WGCNA,图1 E、F 和图1G、H 分别为基因的聚类树状图和基因模块与临床特征相关热图。动态树切割算法分别识别出11 个和14 个基因模块(图1G、H),在图1G 中黄绿色和红色模块与AH 高度相关(|R|>0.6,P<0.01),在图1H 中赭色和浅黄色模块与AH 高度相关(|R|>0.6,P<0.001),因此将这4 个模块中的基因视为AH 相关基因。
2.2 AH 中ARG 的鉴定和富集分析
从GeneCards 和MSigDB 数据库分别下载10 392 个和646 个ARG,与DEG 和WGCNA 结果取交集,分析鉴定了11 个表达一致上调的DEARG(EEF1A2、CFTR、SOX4、TREM2、CTHRC1、HSPB8、TUBB3、PRKAA2、RNASE1、MTCL1、HGF),绘制了韦恩图(图2A)。11 个DEARG 在GSE28619 和GSE142530 中的表达热图分别见图2B、C,11 个DEARG 在染色体上的位置见图2D。获得11 个DEARG 后,在STRING 数据库中构建一个包含这11 个基因的PPI 网络以探索它们之中潜在的相互作用(图2E)。KEGG 通路富集分析结果显示,主要涉及的信号通路是叉头盒蛋白O(forkhead box protein O,FoxO)信号通路、Apelin 信号通路、磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路、腺苷酸活化蛋白激酶(adenosine monphosphate activated protein kinase,AMPK)信号通路、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、酒精性肝病、非酒精性脂肪肝、Rap1 信号通路和钙离子信号通路(图2F)。在GO 生物过程类别中,大多数DEARG 主要参与自噬调节、细胞对氧化应激的反应、蛋白折叠等(图2G)。在GO 细胞组分类别中,大多数DEARG 富集在膜微域和膜筏中(图2H)。在GO 分子功能类别中,多数DEARG 富集在蛋白质丝氨酸/苏氨酸激酶活性、热休克蛋白结合、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性等(图2I)。

图2 AH 中ARG 的筛选及功能分析Figure 2 Screening and functional analysis of ARG associated with AH
2.3 免疫浸润分析
通过计算每个样本中免疫相关基因集的富集得分,可以充分了解到免疫细胞在样品中的整体活性。样品的24 个免疫细胞的比例见图3A,各免疫细胞之间的相关性见图3B,其中辅助性T 细胞(helper T cell,Th)17、CD8+T 细胞与Th 高度相关,嗜酸性粒细胞与B 细胞高度相关,细胞毒性T 细胞、T 细胞与γδT 细胞高度相关,中性粒细胞与Th1 高度相关。在AH 组中,有较高比例的未成熟树突状细胞,而CD8+T 细胞、细胞毒性T 细胞、嗜酸性粒细胞、γ δ T 细胞和T h 1 7 比例较低(图3 C)。通过Spearman 相关系数揭示了免疫细胞的丰度和hub 基因表达之间的关系,结果表明B 细胞、CD8+T 细胞、细胞毒性T 细胞、嗜酸性粒细胞、γδT 细胞和Th17 与hub 基因呈负相关,未成熟树突状细胞与hub 基因呈正相关(图3D)。

图3 免疫浸润分析-ssGSEA 算法Figure 3 Immune infiltration analysis-ssGSEA algorithm
与此同时,本研究也通过CIBERSORT 算法计算AH 中各种免疫细胞类型的相对丰度,以期得到更完善的结果。样品的22 个免疫细胞的比例见图4A。各免疫细胞之间的相关性见图4B,其中活化肥大细胞与静息肥大细胞高度相关,M1 型巨噬细胞与γδT 细胞高度相关。在AH 组中,有较高比例的静息肥大细胞和M0 型巨噬细胞,并且γδT 细胞比例较低(图4C)。通过Spearman 相关系数揭示了免疫细胞的丰度和hub 基因表达之间的关系(图4D),结果表明CFTR、HSPB8、TUBB3、HGF 基因与γδ T 细胞呈负相关,EEF1A2、CFTR、SOX4、TREM2、CTHRC1、HSPB8、TUBB3、PRKAA2、RNASE1、HGF、MTCL1 基因与M0 型巨噬细胞呈正相关,静息树突状细胞与EEF1A2、PRKAA2 基因呈正相关,静息肥大细胞与TUBB3 基因呈正相关,活化肥大细胞与EEF1A2、TREM2、TUBB3 基因呈负相关。

图4 免疫浸润分析-CIBERSORT 算法Figure 4 Immune infiltration analysis-CIBERSORT algorithm
2.4 数据集验证
用GSE155907 和GSE143318 作为验证集,为了评估组内数据的重复性,在本研究中对2 个数据集进行PCA,结果显示数据的重复性良好(图5A、D)。11 个关键基因均为上调基因(图5B、E),且在AH 组中表达量高于对照组(图5C、F)。
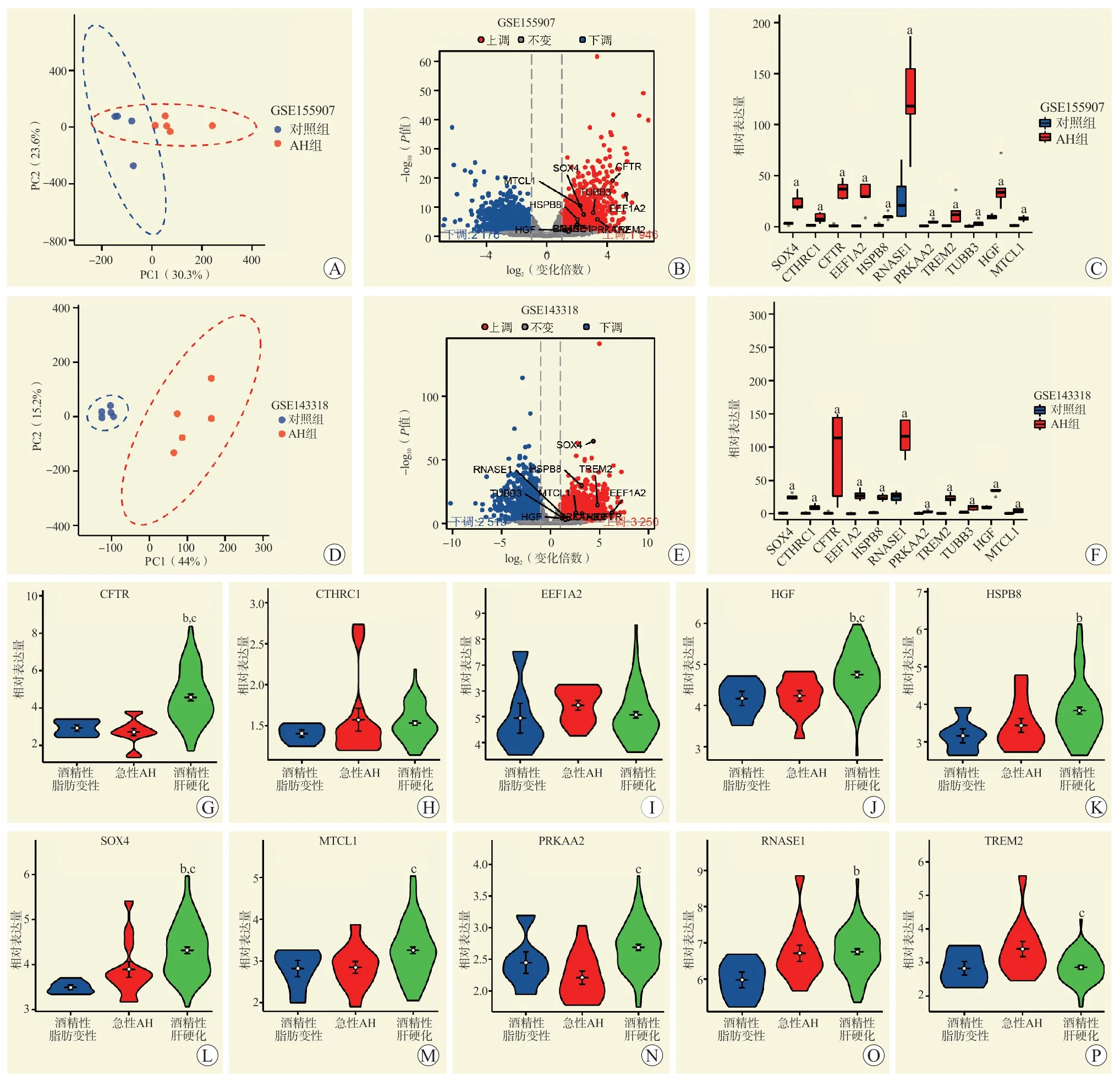
图5 GSE155907、GSE143318 数据集验证和AH 不同分期的基因表达Figure 5 Datasets validation of GSE155907 and GSE143318 and gene expression of AH at different stages
2.5 临床相关性分析
为了探究hub 基因在不同进展阶段的酒精性肝病中的表达关系,用GSE103580 数据集(不包含TUBB3 基因)进行验证,数据集中包含了不同进展阶段的酒精性脂肪肝、急性AH 和酒精性肝硬化的患者样本。分析发现CFTR、HGF、HSPB8、SOX4、MTCL1、PRKAA2、RNASE1、TREM2 基因在酒精性肝病的不同进展阶段有不同的表达水平,除TREM2 基因外,其余的基因在酒精性肝硬化阶段的表达量最高,且CFTR 和PPKAA2 基因在酒精性肝硬化比在AH 阶段的表达大幅度增高,提示其在酒精性肝硬化的发展中发挥着重要作用(图5G~P)。
2.6 mRNA-miRNA、mRNA-TF 网络的构建
采用miRNet 2.0 数据库对肝脏中的11 个基因进行了miRNA 和TF 的预测。mRNA-miRNA 和mRNA-TF 网络分析表明这11 个基因共调控了56 个m i R N A 和2 4 个T F(图6 A),且H S P B 8、CTHRC1、PRKAA2、EEFIA2、MTCL1、SOX4 等基因都可能与hsa-miR-124-3p(又称hsa-let-7b-5p)存在调控关系。使用mirPath v.3 数据库对这些预测得到的miRNA 进行富集分析,以进一步深入了解这些miRNA 在调控网络中的功能作用(图6B),结果表明,这些miRNA 在多个信号通路中富集,其中包括FoxO 信号通路、PI3K-Akt 信号通路、转化生长因子(transforming growth factor,TGF)-β 信号通路以及与脂肪酸代谢相关的通路。

图6 mRNA-miRNA 和mRNA-TF 网络图Figure 6 mRNA-miRNA and mRNA-TF network diagram
2.7 RT-qPCR 验证
为了进一步验证以上分析结果,本研究收集5 例AH 患者病肝和6 例健康供肝的肝脏组织,通过RT-qPCR 检测EEF1A2、CFTR、SOX4、TREM2、CTHRC1、HSPB8、TUBB3、PRKAA2、RNASE1、MTCL1、HGF 基因的相对表达量,图7A 结果显示SOX4、TREM2、CTHRC1、HSPB8、TUBB3、PRKAA2、RNASE1 与生物信息学分析结果一致,在AH 患者肝脏组织中的相对表达量高于健康对照组。同时,本研究也利用AH 小鼠来验证上述7 个基因的表达趋势,结果显示SOX4、TREM2、HSPB8、PPKAA2 基因在AH 小鼠中的相对表达量高于健康对照小鼠(图7B)。
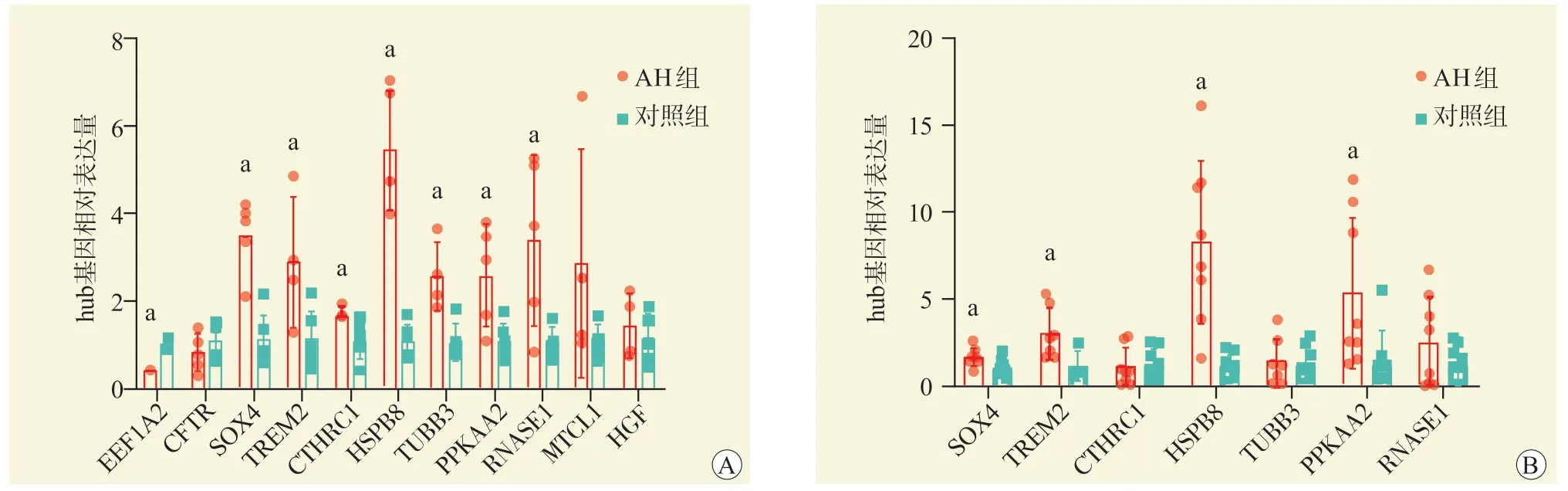
图7 RT-qPCR 验证结果Figure 7 Results of RT-qPCR validation
3 讨论
自噬在酒精性肝损伤中发挥着重要作用,可能成为治疗AH 的一个潜在靶点。本文从自噬相关基因的角度,通过生物信息学的方法,鉴定和验证了AH 潜在的关键生物标志物。
在本研究中,将ARG 与DEG 和WGCNA 结果取交集,识别出11 个上调基因。根据KEGG 结果,DEARG 主要涉及的途径是PI3K-Akt 信号通路、FoxO 信号通路和Apelin 受体信号通路[27]。PI3KAkt 信号传导途径参与急性酒精性脂肪肝的发生发展过程,PI3K-Akt 抑制剂可能具有治疗酒精性脂肪肝的潜力。FoxO 不仅通过激活自噬基因的转录来诱导自噬,还通过与自噬蛋白相互作用和通过表观遗传机制(如通过组蛋白修饰和miRNA)来调节自噬活性[28]。自噬也可以直接或间接地调节FoxO 的降解[29-30]。FoxO 转录因子可调节Atg14 基因的表达[31],并对肝脏自噬和脂质代谢有着显著影响。Apelin信号通路通过PI3K 途径激活AMPK 和诱导PPARα生成来防止肝脏中的脂质积累[32-33]。PPI 网络和模块分析显示,11 个关键基因与其下游基因形成紧密的相互作用,共同调控AH 的发生发展。为充分探讨AH 炎症细胞失调的情况,本文进行了免疫浸润分析,发现AH 组中未成熟树突状细胞、静息肥大细胞和M0 型巨噬细胞比例较高,而CD8+T 细胞、细胞毒性T 细胞、嗜酸性粒细胞、γδT 细胞和Th17 比例相对较低。这几项指标都代表AH 患者处于疾病初期,尚未发生明显的感染或炎症过敏反应,没有受体与抗原结合,尚未参与到吞噬和抗原处理的阶段,免疫应答不足。这充分说明AH 阶段尚不严重,积极干预将会取得较好的成果。
用GSE155907 和GSE143318 作为验证集发现,11 个关键基因均为上调基因,且在酒精组中表达量高于对照组,与上述研究结果相同。临床相关性分析发现,CFTR 和PPKAA2 这两个基因在酒精性肝硬化比在AH 阶段的表达显著增高。在酒精性肝硬化中,肝细胞受到长期酒精摄入和炎症反应的刺激,导致细胞的功能和结构严重受损。为了应对这种严重的细胞损伤,细胞会通过增加自噬途径来清除受损的细胞器和蛋白质,以维持细胞的稳态。因此,在酒精性肝硬化中,自噬的活性最高。
miRNA、lncRNA 预测发现hsa-miR-124-3p 可能是酒精性脂肪肝自噬的潜在靶点,有研究表明在肺癌的发生发展中,miR124-3p-STAT3-PRKAA 途径诱导自噬的发生[34]。在帕金森病的发病机制中,miR-124 可调节p62/p38 的表达,进而促进自噬[35]。本研究中miRNA-mRNA 调控网络分析结果提示,hsamiR-124-3p 可能是酒精性脂肪肝自噬的潜在靶点。
随后,本研究对AH 患者和小鼠样本进行RTqPCR 验证,结果显示4 个关键基因SOX4、TREM2、HSPB8、PPKAA2 在AH 组中的表达量显著增高。根据已有研究,SOX4 在肥胖患者的肝脏中显著上调,可促进肝脏脂肪变性,是肝脂肪代谢的重要组成部分,可能与AH 的发生发展有着密切的联系[36],而SOX4 与自噬相关联系尚无文献报道。HSPB8 与ATG3(自噬相关蛋白3)相互作用,可促进自噬体-溶酶体融合[37],进而影响肝脏脂质代谢,从而可能参与AH 的发生发展。PPKAA2 可以显著减少酒精引起的肝损伤并增强肝细胞的线粒体自噬水平[38]。TREM2 通过调节肥胖及其并发症(如非酒精性脂肪性肝病)的发生和进展来影响脂质代谢[39],且TREM2可调节巨噬细胞自噬水平,进而影响动脉粥样硬化的进展[40],而TREM2 与AH 和自噬的关系还需进一步研究。这也许预示了这4 个关键基因可能在AH 与自噬的发生发展中起关键性作用,并可作为AH 与自噬的潜在靶点。
综上所述,本文通过生物信息学分析识别出11 个AH 自噬关键上调基因(EEF1A2、CFTR、SOX4、TREM2、CTHRC1、HSPB8、TUBB3、PRKAA2、RNASE1、MTCL1、HGF),其中,SOX4、TREM2、HSPB8、PPKAA2 在AH 患者和小鼠样本中都显著升高,可能是AH 中自噬的关键基因。AH 与自噬的具体作用机制仍需进一步深入探究。
