转基因猪骨髓间充质干细胞的分离及与猪胰岛的共培养研究
2024-01-19朱淑芳曲泽澎陆赢潘登科牟丽莎
朱淑芳 曲泽澎 陆赢 潘登科 牟丽莎
胰岛移植被认为是治疗1 型糖尿病(type 1 diabetes mellitus,T1DM)的一种潜在方法[1-3]。然而,广泛应用胰岛移植来治疗T1DM 面临着一系列巨大挑战,包括供器官短缺、胰岛培养过程中β 细胞死亡、移植后即刻经血液介导的炎症反应,以及与宿主免疫细胞攻击或免疫抑制药毒性有关的炎症相关免疫排斥反应等[3-7]。间充质干细胞(mesenchymal stem cell,MSC)具有出色的免疫调节和血管生成等特性,已经在异种胰岛移植中表现出令人满意的效果[8-10]。但人类来源的MSC 需要从有限的人体组织(如脐带、骨髓、脂肪)中获取,供者相对短缺,且MSC质量受供者年龄影响,以及可能引发排斥反应[11-13]。另外,人类MSC 还涉及伦理问题[14]。猪MSC 来源广泛,适合大规模研究和生产,且猪MSC 获取和培养成本相对较低,不涉及伦理和法律争议;猪MSC具有跨物种适应性,可在不同宿主动物中移植,有利于跨物种研究和治疗模型的建立[15-17]。
通过多年的研究和实验,猪被认为是最适合作为异种移植的供体动物[18-20]。猪器官的构造、大小和生理特征与人类相似,而且猪的供应充足[21-22]。然而,猪体内存在可引起外源性排斥反应的α-1,3-半乳糖(α-1,3-galactose,αGal)、N-羟乙酰神经氨酸(Nglycolylneuraminic acid,Neu5Gc)和Sd 血型抗原,分别由α-1,3-半乳糖基转移酶(α-1,3-galactosyltransferase,GGTA1)、单磷酸胞嘧啶-N-乙酰神经氨酸羟化酶(cytidine monophospho-N-acetylneuraminic acid hydroxylase,CMAH)和β-1,4-N-乙酰半乳糖氨基转移酶2(β-1,4-N-acetyl-galactosaminyltransferase 2,β4GALNT2)基因编码的酶催化生成,在人体内能够被人类抗异种活性抗体识别[23-25]。通过CRISPRCas9 基因编辑技术来有针对性地敲除GGTA1、CMAH 和β4GALNT2 基因,可以最大限度地减少或完全消除异种移植引起的排斥反应,提高异种移植的疗效[25]。此外,作为人体补体调节蛋白的一员,人补体调节蛋白hCD46 能够保护异种移植物免受系统补体激活引起的排斥反应[26-28]。
为了评估猪MSC 中与异种抗原相关的基因对异种移植的应用效果,需要建立猪MSC 的分离方法以及与猪胰岛的共培养体系。本研究通过建立绿色荧光蛋白(green fluorescent protein,GFP)标记的GGTA1 基因敲除(GTKO)、GGTA1 基因敲除并hCD46 插入(GTKO/hCD46)以及CMAH 和G G T A 1 双基因敲除(N e u 5 G C/G a l)猪骨髓MSC(bone MSC,BMSC),进行猪BMSC 与胰岛细胞的共培养实验,以评估其对胰岛细胞的保护作用。
1 材料与方法
1.1 实验材料
GTKO、GTKO/hCD46 以及Neu5GC/Gal 基因修饰猪由潘登科教授团队构建。DMEM 培养基、胎牛血清、胰蛋白酶以及链霉素购自美国Gibco 公司;多聚甲醛采购自美国Sigma 公司,藻红蛋白(phycoerythrin,P E)-C D 2 9、异硫氰酸荧光素(f l u o r e s c e i n isothiocyanate,FITC)-CD44、PE-CD105、PE-CD166和PE-CD73 抗体购自美国BD 公司。油红O、茜素红以及阿利新蓝均购自美国Sigma 公司。本研究经深圳市第二人民医院伦理委员会批准同意(伦理编号:2 017 070 607)
1.2 实验方法
1.2.1 BMSC 的分离和培养 GTKO 巴马猪经麻醉后于无菌条件下穿刺猪股骨上端,抽取骨髓液5 mL。将骨髓液置于离心管中,加入15 mL 红细胞裂解液,轻轻吹打混匀并作用10 min,200×g离心5 min,弃去上层红色清液,磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤离心去上清液,重复3 次。用含体积分数10%胎牛血清的DMEM/F12 培养液重悬沉淀细胞接种于T25 培养瓶中,水平放入37℃ 5% CO2培养箱内静置培养。48 h 后用MEMα+10% 胎牛血清培养液进行首次换液,并在倒置显微镜下观察细胞形态及生长状况,以后每隔2 d 换液、观察。待贴壁细胞达到80%~90%融合或出现生长抑制细胞不再有明显扩增时,按1∶2 进行传代,第3 代冻存备用。
采用同样的方法分离培养野生型外三元猪、野生型巴马猪、野生型五指山猪、野生型藏猪、GTKO/hCD46 五指山猪、GTKO 五指山猪、Neu5GC/Gal 五指山猪的BMSC。
1.2.2 BMSC 形态学观察 于倒置生物显微镜下观察并拍照记录原代及多次传代细胞的形态、贴壁、密度、融合度及融合时间等生长状况。
1.2.3 BMSC 表面标志物鉴定 取第3 代GTKO 五指山猪BMSC,0.25%胰蛋白酶消化,PBS 洗涤2 次,4 ℃200×g离心5 min,弃上清,PBS 重悬。再以200×g离心 5 min,弃上清, PBS 洗涤 3 次后重悬,调整细胞浓度为1×106/mL,以100 μL 分装于流式管中,向各管中加入相应抗体,于冰上或4 ℃避光条件下孵育30 min 后离心弃上清,用500 μL PBS 重悬细胞后进行流式鉴定。
1.2.4 BMSC 诱导分化 当第3 代GTKO 五指山猪BMSC 融合度达80%~90%时,将传代培养液更换为相应BMSC 成骨诱导分化培养基,培养基每3 d 更换1 次。成骨诱导分化分别于4、8 d 进行碱性磷酸酶染色和茜素红染色,染色均按试剂盒说明书进行操作,然后使用倒置显微镜观察细胞成骨分化情况。
当第3 代GTKO 五指山猪BMSC 融合度达80%~90%时,将传代培养液更换为相应BMSC 成脂诱导分化培养基,培养基每3 d 更换1 次。诱导10 d后,按试剂盒说明书进行油红O 染液染色,并使用倒置显微镜观察细胞成脂分化情况。
当第3 代GTKO 五指山猪BMSC 融合度达80%~90%时,将传代培养液更换为相应BMSC 成软骨诱导分化培养基,培养基每3 d 更换1 次。诱导10 d后,按试剂盒说明书进行阿利新蓝染色,然后使用倒置显微镜观察细胞成软骨分化情况。
1.2.5 BMSC 标记示踪 取生长状态良好第3 代GTKO 五指山猪BMSC,0.25% 胰蛋白酶消化,200×g离心5 min,弃上清,PBS 重悬,制成单细胞悬液,稀释至5×104/mL 后接种于24 孔板中,每孔200 μL,静置培养24 h,待细胞达到30%~50%融合后,以感染复数(multiplicity of infection,MOI)为50 的剂量加入携带GFP 的慢病毒载体液。共培养72 h后,用PBS 进行冲洗3 遍,换为不含慢病毒的完全培养基继续培养,此后每3 d 换液1 次,并在荧光显微镜下进行观察GFP 表达情况,拍照记录。
1.2.6 胰岛细胞的分离 野生型外三元猪经麻醉后开腹,采用外科手术方法经主动脉放血至接近完全时,经4 ℃预冷生理盐水冲淋胰腺使其快速降温,使用无菌手术剪剥离胰腺周围组织取出完整胰腺,置于预冷的 Hank’s 平衡盐溶液中,应保证热缺血时间不超过10 min 和冷缺血时间不超过30 min。在无菌超净工作台低温条件下左手持无齿镊、右手持无菌手术剪将胰腺表面脂肪及结缔组织等修剪干净后进行称重。将胶原酶经胰管灌注进猪胰腺直至充盈,然后将灌注充盈的猪胰腺剪成大小一致体积进行消化,消化期间间隔相同时间进行取样,双硫腙(dithizone,DTZ)染色(胰岛β 细胞可被DTZ 染为猩红色),当在显微镜下看到较为完整的猩红色胰岛β 细胞时终止消化。使用含10%胎牛血清的1 640 培养基对收集的消化后组织进行洗涤,通过不连续密度梯度法纯化组织,从而得到离心管底部沉淀的胰岛细胞。将纯化得到的胰岛细胞按1×104胰岛当量(islet equivalent quantity,IEQ)/30 mL 的接种密度到Ham’s F10 培养基进行后续培养。
1.2.7 胰岛细胞与BMSC 共培养 取第3 代GFP 转染标记的GTKO 五指山猪BMSC,将BMSC 与胰岛进行共培养,24 h 后观察胰岛形态变化。分别用MSC 条件培养基(HamCDM)和非条件培养基(Ham)培养胰岛48 h,然后进行活细胞(CalceinAM)和死细胞(PI)染色。
1.3 研究内容
观察猪BMSC 原代细胞及多次传代细胞的形态与生长特点,鉴定GTKO 五指山猪BMSC 表面标志物,分析GTKO 五指山猪BMSC 成骨、成脂及成软骨细胞分化效果。分析GFP 转染标记GTKO 五指山猪BMSC 的生物学特性,观察猪胰岛与GTKO 五指山猪BMSC 共培养时的形态及生长特点。
2 结果
2.1 猪BMSC 的分离、鉴定和标记
体外培养的BMSC 呈梭形,在细胞生长的对数期,BMSC 的倍增时间约为30 h。细胞特性稳定,扩增1 代和2 代后的细胞同质性均达到95% 以上。BMSC 连续传代培养和冷冻保存后仍能具有多向分化潜能。不同猪BMSC 形态见图1。
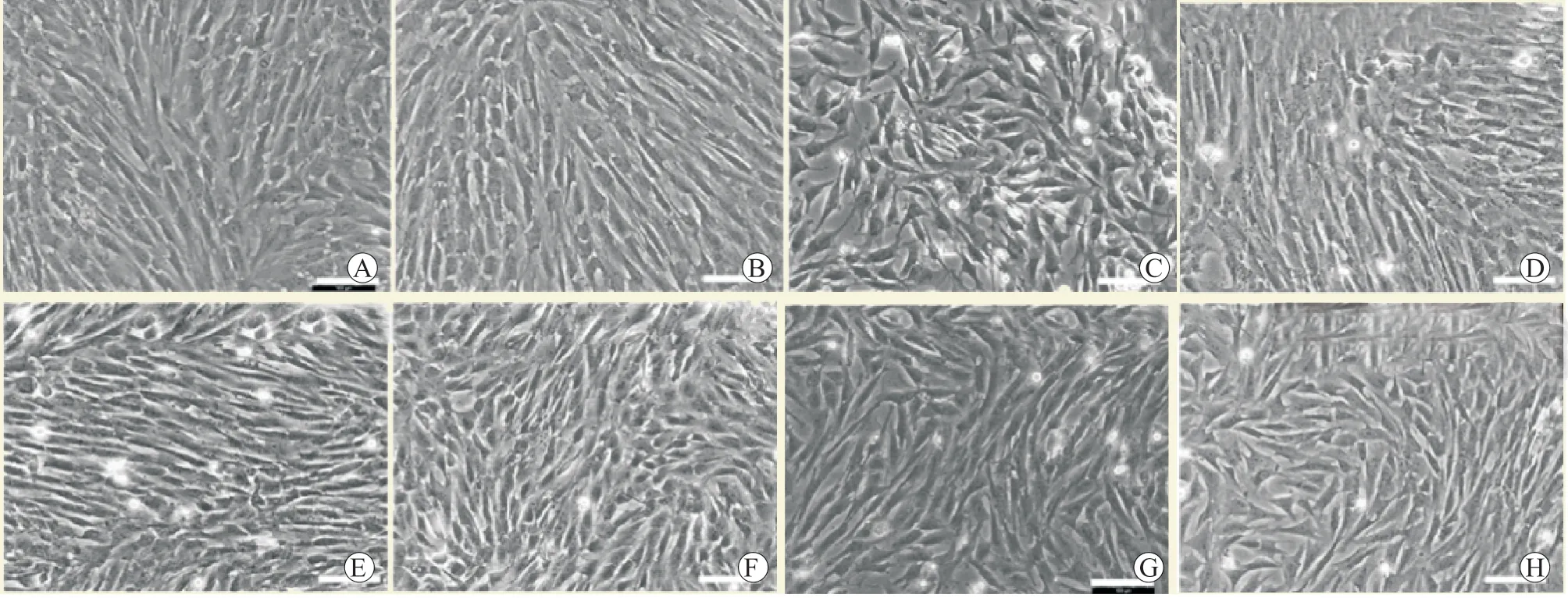
图1 猪BMSC 形态学表现(×100)Figure 1 Morphological findings of BMSC of pig
分离培养的GTKO 五指山猪BMSC 具有成脂、成骨、成软骨分化能力(图2)。流式细胞术结果显示,猪BMSC 表达CD29、CD44、CD73、CD90、CD105 及CD166(阳性率>85%),不表达CD34、CD45(阳性率<15%)(图3)。标记示踪后的GTKO 五指山猪BMSC 培养36、48 h 后表达特异性GFP(图4)。
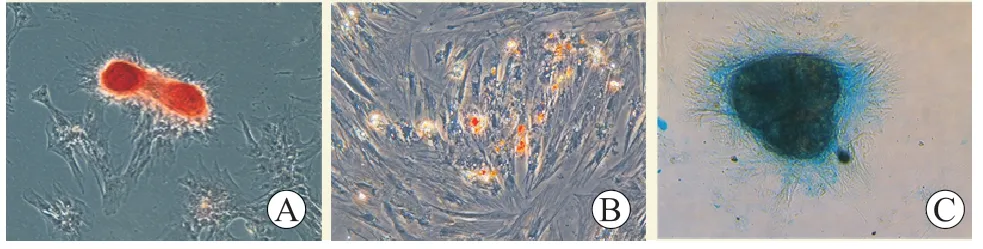
图2 GTKO 五指山猪BMSC 的三系分化结果(×100)Figure 2 The trilineage differentiation results of BMSC of GTKO Wuzhishan pig

图3 GTKO 五指山猪BMSC 表面标志物表达情况Figure 3 Expression of cell surface markers of BMSC of GTKO Wuzhishan pig

图4 GTKO 五指山猪BMSC 标记示踪结果(×100)Figure 4 Labeling and tracing results of BMSC of GTKO Wuzhishan pig
2.2 BMSC 对胰岛细胞的保护能力
胰岛细胞与GTKO 五指山猪BMSC 共培养3 d后,细胞生长良好,形成细胞聚集体,共培养条件下的胰岛聚集体比仅胰岛培养条件下的增大(图5)。用MSC 条件培养基培养的猪胰岛细胞比非条件培养基培养的猪胰岛细胞活力更强,细胞死亡较少(图6)。
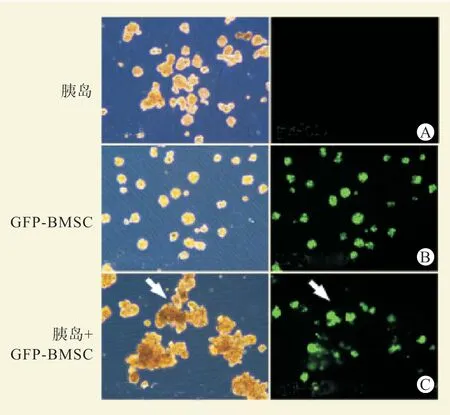
图5 猪胰岛与GTKO 五指山猪BMSC 的共培养结果(×100)Figure 5 Co-culture results of porcine pancreatic islets and BMSC of GTKO Wuzhishan pig
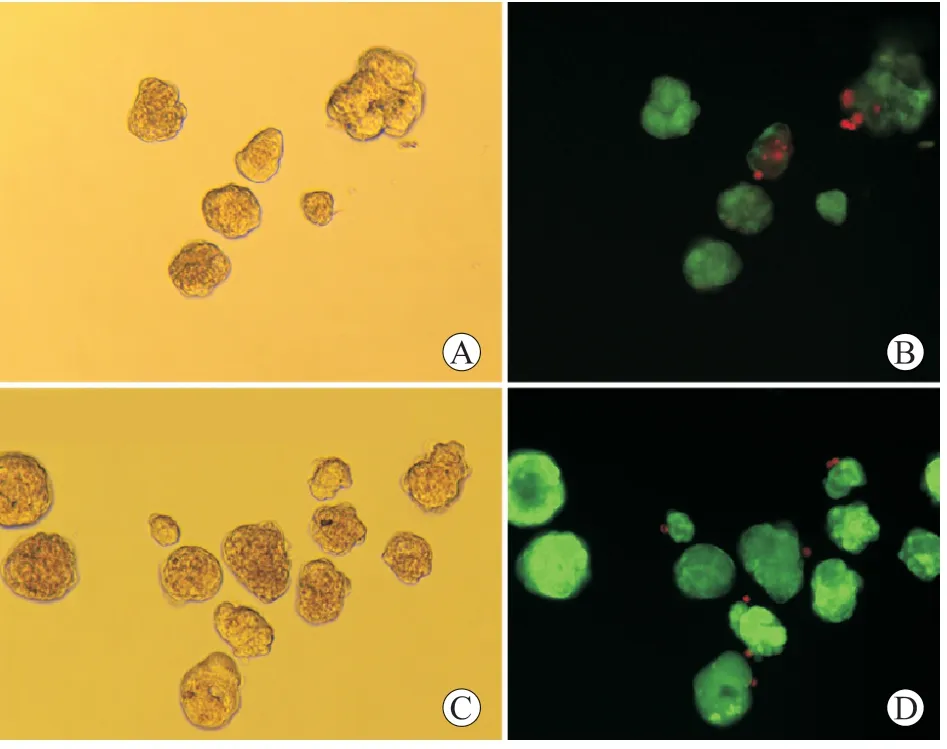
图6 不同培养条件下猪胰岛细胞活力Figure 6 Viability of porcine pancreatic islet cells under different culture conditions
3 讨论
在异种移植中,猪具有供应充足的优势,被认为是最合适异种移植的供体动物。然而,猪细胞表面存在的αGal、Neu5GC 和Sd 血型抗原能被人抗异种活性抗体识别,在猪异种移植中引起排斥反应[29-31]。通过对猪异种抗原基因进行敲除,如使用CRISPR/Cas9技术产生的GTKO 猪BMSC,可以减轻异种移植排斥反应,提高猪BMSC 在T1DM 胰岛移植治疗中的效果[32]。
既往研究表明,使用CRISPR/Cas9 基因编辑技术产生的GTKO 猪BMSC 不表达与异种移植排斥反应有关的αGal 抗原,并可以表现出与野生型猪BMSC 相似的特征[29]。此外,hCD46 在敲除了Gal 抗原基因GGTA1 的猪主动脉内皮细胞上的表达可保护细胞免受排斥反应损伤[26]。通过转基因修饰在GTKO/hCD46 猪中继续敲除CMAH,可以显著减轻异种灌注猪肺中抗体介导的排斥反应[33]。这为在利用转基因猪预防排斥反应的临床应用中提供了新的启示。
本研究对GTKO、GTKO/hCD46 和Neu5GC/Gal三种不同转基因修饰猪的BMSC 进行了分离培养,并将GTKO 猪BMSC 与猪胰岛细胞共培养。结果显示这些BMSC 在体外诱导时能够分化为脂肪细胞、骨细胞和软骨细胞。虽然在培养条件方面与之前的研究存在差异,但猪BMSC 的生长特性仍与人BMSC相似,且倍增时间约为人BMSC 的一半。
由于胰岛移植后的免疫排斥反应,胰岛移植在T1DM 治疗中面临挑战[34-36]。近年来,MSC 被广泛应用于自身免疫性疾病的治疗,如T1DM[37-38]。本研究通过对野生型外三元猪胰岛和不同转基因修饰猪的BMSC 共培养,评估了猪BMSC 对胰岛的保护作用,发现共培养条件下,猪BMSC 能够通过分泌因子保护胰岛免受炎症免疫排斥反应的损害,这对胰岛的功能和活力的保持至关重要。
综上所述,本研究建立的方法对解决胰岛短缺和猪体内抗原引起的免疫排斥反应问题具有一定参考意义,为未来基因修饰猪BMSC 在异种胰岛移植研究中的应用提供了实验基础,也为异种胰岛移植策略在治疗T1DM 中的应用提供了有益的启示。但本研究存在一定的局限性:(1)初步实验性质,本研究是初步实验,尚未全面探讨不同来源MSC 的潜在差异;(2)数据量化不足,在某些实验中,未能提供足够的量化数据,仅提供了代表性图表,导致结论代表性不足;(3)资源限制,由于资源、时间和技术限制,我们未能进行更广泛的实验或考虑更多的变量,这可能会影响研究的全面性和深度。未来将进行更广泛、深入的研究,进一步探索异种胰岛移植策略在治疗T1DM 中的应用。
