下调XBP1s通过Sirt3/SOD2/mtROS轴减轻缺氧/复氧诱导的肾小管上皮细胞衰老
2024-01-19彭宣倪海强顾世琦宫念樵
彭宣 倪海强 顾世琦 宫念樵
肾移植术后可发生急性肾损伤和移植肾功能延迟恢复,而缺血-再灌注损伤(ischemia-reperfusion injury,IRI)是其发生的重要因素[1-3]。近年研究表明,IRI 过程中由于线粒体失功产生的大量活性氧簇(reactive oxygen species,ROS)能诱导细胞衰老[4]。衰老的肾小管上皮细胞一方面由于细胞周期阻滞而停止增殖,另一方面由于衰老相关分泌表型促进炎症和纤维化,加速急性肾损伤向慢性肾病进展[5-6]。因此,探索细胞衰老发生的分子机制及寻求干预策略,具有重要意义。
IRI 过程中会发生严重的内质网应激(endoplasmic reticulum stress,ERS),ERS 主要由肌醇需求激酶1(inositol-requiring enzyme 1,IRE1)、转录激活因子6(activating transcription factor 6,ATF6)、蛋白激酶R 样内质网激酶(p r o t e i n k i n a s e R-l i k e endoplasmic reticulum kinase,PERK)介导[7-8]。其中,非剪接型X-盒结合蛋白1(unspliced X-box binding protein 1,XBP1u)被激活的IRE1 剪接一个内含子重编码生成剪接型X-盒结合蛋白1(spliced X-box binding protein 1,XBP1s),而XBP1s 作为转录因子能通过调控一系列下游ERS 相关蛋白调节内质网稳态[9-10]。笔者团队前期研究表明下调XBP1s 能减少IRI 过程中ROS 产生[11],但下调XBP1s 能否减轻ROS 诱导的细胞衰老及其可能机制尚不清楚。研究报道,沉默信息调节因子3(sirtuin 3,Sirt3)作为最重要的线粒体去乙酰化酶,通过使超氧化物歧化酶(superoxide dismutase,SOD)2 去乙酰化,增强SOD2 活性,从而抑制线粒体ROS(mitochondrial ROS,mtROS)产生[12-13],Sirt3/SOD2/mtROS 信号轴在IRI 过程中调控氧化应激及细胞衰老至关重要[14-15]。本研究通过建立体外缺氧-复氧(hypoxia/reoxygenation,H/R)模型,探讨XBP1s 调控Sirt3/SOD2/mtROS 信号轴对H/R 诱导的细胞衰老影响及其作用机制。
1 材料与方法
1.1 实验材料与试剂
1.1.1 实验材料 用于提取原代肾小管上皮细胞的健康无特定病原体(specific pathogen free,SPF)级C57BL/6 雄性小鼠(6~8 周龄)购自江苏集萃药康生物科技股份有限公司。小鼠饲养在华中科技大学同济医学院附属同济医院SPF 级动物中心,饲养环境为22 ℃,55%湿度和12 h 昼夜循环。所有动物实验均经同济医院实验动物福利与伦理委员会批准(批号:TJH-202 207 003),并遵守中华人民共和国科学技术委员会颁布的《实验动物管理条例》。
1.1.2 试 剂 EpiCM-a 培养基购自美国ScienCell 公司,胎牛血清购自上海翌圣生物科技股份有限公司;总RNA 提取试剂购自上海飞捷生物技术有限公司,逆转录试剂盒购自日本Takara 公司,腺病毒由上海和元生物技术股份有限公司合成,聚合酶链反应(polymerase chain reaction,PCR)引物由武汉奥科鼎盛生物科技有限公司合成;Sirt3、p53、p21、γ H 2 A X、S O D 2、β-a c t i n、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔二抗、染色质免疫沉淀试剂盒购于武汉爱博泰克生物科技有限公司,XBP1s 抗体购自美国CST 生物公司、Ac-SOD2 抗体购于英国Abcam 公司;RIPA 裂解液、BCA 蛋白浓度测定试剂盒、ROS 检测试剂盒、SOD 活性检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、细胞衰老β-半乳糖苷酶染色试剂盒均购自上海碧云天生物技术有限公司;线粒体超氧化物指示剂mitoSOX 购自美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 原代肾小管上皮细胞提取和培养 选用6~8 周C57BL/6 雄性小鼠,在无菌条件下取出肾脏,剥离肾包膜后,剪碎肾皮质组织,再使用组织分离器打碎肾脏,加入胶原酶/复合酶和DNA 酶消化获得单细胞悬液。用70 μm 滤器过滤,滤液经离心、洗涤、裂红后,用EpiCM-a 完全培养基重悬细胞,转至细胞培养瓶内,置于37 ℃、5% CO2、饱和湿度条件下培养,48 h 后,可见部分细胞贴壁并换液,后续每隔2~3 d 更换培养基,并根据细胞生长情况进行传代。
1.2.2 细胞分组与转染 将细胞随机分为空白对照组(NC 组)、H/R 组、转染空载腺病毒的阴性对照组(Ad-shNC 组)、转染靶向沉默XBP1s 的腺病毒组(Ad-shXBP1s 组)、转染空载腺病毒+H/R 处理组(Ad-shNC+H/R 组)、转染靶向沉默XBP1s 的腺病毒+H/R 处理组(Ad-shXBP1s+H/R 组)。以感染复数50 为参考进行原代细胞转染,48 h 后即可检测转染效率和干扰效果,XBP1s 干扰序列为5'-CAGCGCAG ACTGCTCGAGATAGAAA-3'。
1.2.3 建立H/R 模型 参考前期研究者经验建立H/R 模型[16],将培养基更换为预先缺氧的无血清培养基,然后将细胞置于含有5% CO2、1% O2、94% N2的37 ℃三气培养箱中培养24 h 进行缺氧,缺氧结束后更换为正常完全培养基,并移至常氧培养箱继续培养2 h 进行复氧。整个过程常氧组予以正常完全培养基培养,并于常氧培养箱中培养。
1.2.4 β-半乳糖苷酶染色 弃除12 孔板中的细胞培养液,用磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤1 次,然后每孔加入500 μL β-半乳糖苷酶染色固定液,室温下固定15 min。再弃除固定液,用PBS 洗涤3 次,每次3 min。最后每孔加入500 μL 含有X-Gal 的染色工作液,于37 ℃孵育过夜,次日于普通光学显微镜下观察。
1.2.5 蛋白质印迹法检测蛋白表达 使用RIPA 裂解液提取细胞总蛋白,然后进行蛋白定量。经SDSPAGE 凝胶电泳后转移至聚偏二氟乙烯(polyvinyidene fluoride,PVDF)膜,室温用5%脱脂奶粉封闭1 h。洗膜后加入相应一抗,4 ℃孵育过夜,洗膜后加入二抗室温孵育1 h,洗膜后进行显影。
1.2.6 ROS 水平测定 用DCFH-DA 荧光探针检测细胞内的ROS 水平。用无血清培养基按1∶1 000 将DCFH-DA 稀释成终浓度为10 μmol/L 的工作液。培养细胞结束后,弃除培养基,用PBS 洗3 遍,加入适当体积工作液充分覆盖细胞。于细胞培养箱内避光孵育20 min 后,用无血清细胞培养基洗涤3 次。在荧光显微镜下随机选取不同视野拍照观察。
1.2.7 MDA 和SOD 检测 细胞培养结束后,用SOD 活性检测试剂盒、MDA 检测试剂盒按照说明书分别检测SOD 活性及MDA 含量。
1.2.8 染色质免疫共沉淀检测XBP1s 与Sirt3 结合将细胞与1%甲醛交联,然后裂解,用蛋白A/G 磁性琼脂糖将提取液预清除,4 ℃下过夜。接着用抗XBP1s 或抗IgG 抗体进行免疫沉淀后,按说明书洗涤蛋白质复合物。洗涤之后解除蛋白质/DNA 复合物之间的交联,然后纯化DNA 进行染色质免疫共沉淀-测序(chromatin immunoprecipitation followed by sequencing,ChIP-seq)与定量聚合酶链反应(chromatin immunoprecipitation followed by quantitative polymerase chain reaction, ChIP-qPCR)分析。根据Sirt3 基因启动子上预测的XBP1s 结合的motif 所设计引物1-5 的序列见表1。

表1 引物序列Table 1 Primer sequences
1.2.9 实时荧光定量聚合酶链反应检测mRNA 表达采用实时荧光定量聚合酶链反应(r e a l-t i m e fluorescent quantitative polymerase chain reaction,RTqPCR)检测细胞中XBP1s、Sirt3 表达水平。提取细胞总RNA,测定浓度后配成反应体系,用逆转录试剂盒逆转录为cDNA,再进行扩增。以β-actin 作为内参基因,用2-△△Ct法计算基因的相对表达量。引物序列见表1。
1.2.10 流式细胞术检测mtROS 将线粒体超氧化物指示剂MitoSOX 溶于二甲基亚砜中,制成5 mmol/L的储存液,再用含钙、镁的Hank's 平衡盐溶液(Hank's balanced salt solution,HBSS)稀释成浓度为1 μmol/L 的工作液。弃除培养基后,加入适量工作液覆盖细胞,于培养箱中孵育30 min,最后用HBSS 洗涤3 次,胰酶消化后收集细胞进行流式细胞仪分析。
1.3 研究内容
检测N C 组、H/R 组、A d-s h N C 组、A d-shXBP1s 组XBP1s 信使RNA(messenger RNA,mRNA)和蛋白表达情况,验证沉默效率及H/R 对细胞XBP1s 表达的影响。检测Ad-shNC 组、AdshNC+H/R 组、Ad-shXBP1s+H/R 组β-半乳糖苷酶染色情况,细胞衰老标志物p53、p21、γH2AX 表达情况,ROS、MDA 和SOD 水平。验证XBP1s 转录调控Sirt3,检测下调XBP1s 后Sirt3 及下游SOD2 表达,并检测mtROS。
1.4 统计学方法
实验数据用软件GraphPad Prism 9.0 进行统计分析,数据符合正态分布以均数 ± 标准差表示,采用独立样本t检验或单因素方差分析进行比较分析,P<0.05 为差异有统计学意义。
2 结果
2.1 H/R 处理原代肾小管上皮细胞后XBP1s 表达上升
与NC 组比较,H/R 组XBP1s mRNA 相对表达量升高(P<0.001,图1A),XBP1s 蛋白表达增多(图1B)。与Ad-shNC 组比较,Ad-shXBP1s 组XBP1s mRNA 相对表达量下降(P<0.001,图1C),XBP1s 蛋白表达减少(图1D)。
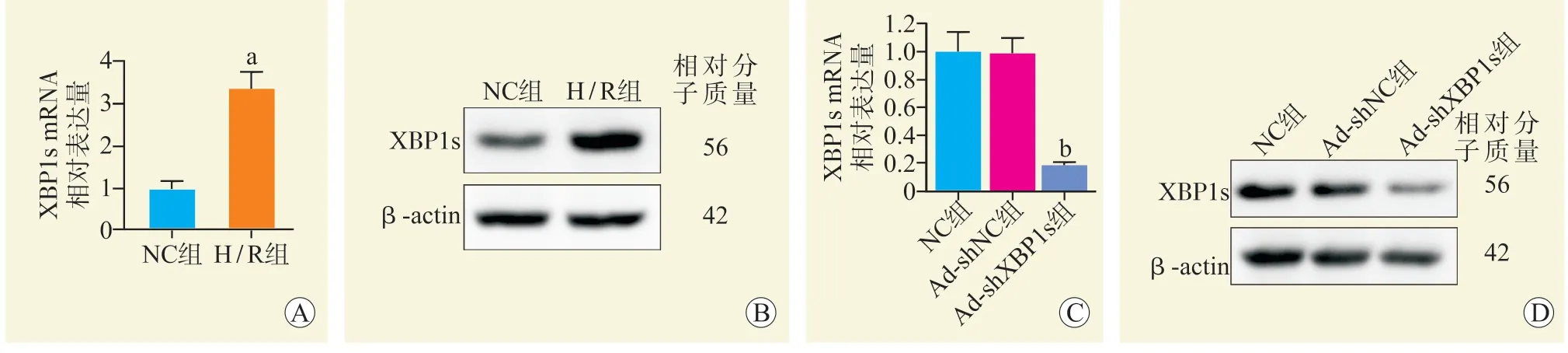
图1 H/R 对肾小管上皮细胞XBP1s 表达的影响Figure 1 The effect of H/R on XBP1s expression in renal tubular epithelial cells
2.2 下调XBP1s 减轻H/R 诱导的肾小管上皮细胞衰老
与Ad-shNC 组相比,Ad-shNC+H/R 组β-半乳糖苷酶染色阳性细胞数增加,衰老标志蛋白p53、p21、γH2AX 表达增多;与Ad-shNC+H/R 组比较,Ad-shXBP1s+H/R 组β-半乳糖苷酶染色阳性细胞数减少,p53、p21、γH2AX 表达减少(图2)。
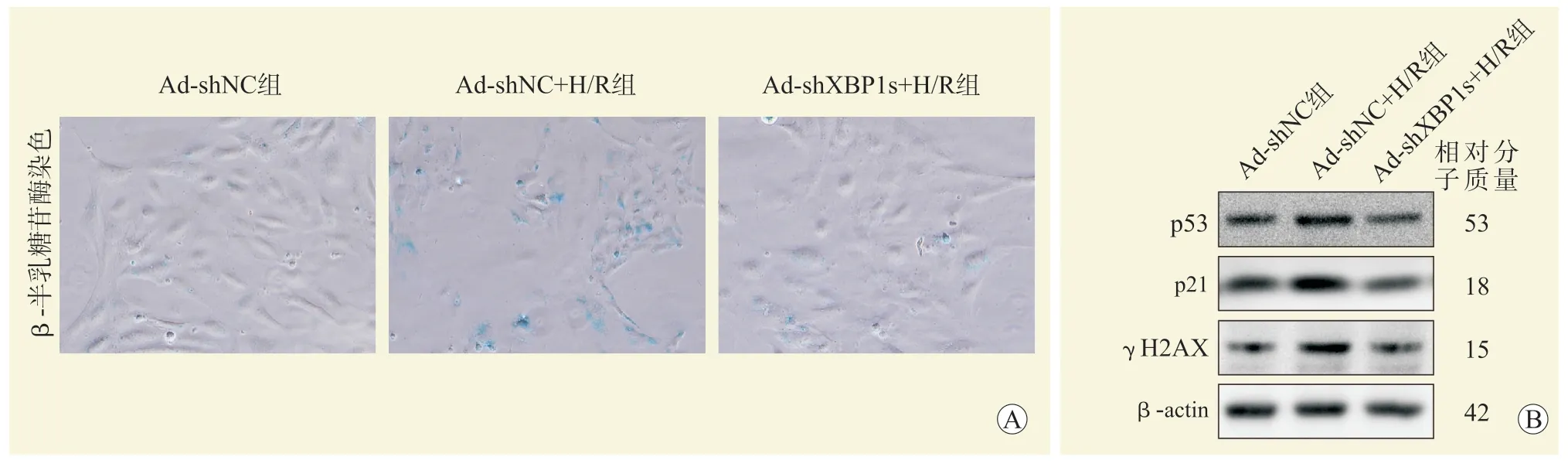
图2 下调XBP1s 减轻H/R 诱导的细胞衰老Figure 2 Downregulation of XBP1s mitigates cell senescence induced by H/R
2.3 下调XBP1s 减轻H/R 诱发的氧化应激
与Ad-shNC 组比较,Ad-shNC+H/R 组ROS、MDA 水平较高,SOD 活性下降;与Ad-shNC+H/R组比较,Ad-shXBP1s+H/R 组ROS、MDA 水平较低,SOD 活性升高(均为P<0.05,图3)。

图3 下调XBP1s 减轻H/R 诱发的氧化应激Figure 3 Downregulation of XBP1s alleviates oxidative stress induced by H/R
2.4 XBP1s 调控Sirt3/SOD2/mtROS 通路
通过ChIP-seq 筛选出XBP1s 转录调控的且与细胞衰老和氧化应激密切相关的分子Sirt3,XBP1s 可能与Sirt3 基因启动子区域结合(图4A)。ChIPqPCR 证明XBP1s 与Sirt3 基因启动子序列中的引物5 对应的扩增序列结合,与IgG 组相比,XBP1s 组富集倍率增高(P<0.01,图4B)。

图4 下调XBP1s 对Sirt3/SOD2/mtROS 信号轴的影响Figure 4 The impact of downregulating XBP1s on the Sirt3/SOD2/mtROS signaling axis
RT-qPCR 结果显示,Ad-shNC+H/R 组Sirt3 mRNA 相对表达量较Ad-shNC 组下降,Ad-shXBP1s+H/R 组Sirt3 mRNA 相对表达量较Ad-shNC+H/R 组升高(均为P<0.01,图4C)。
蛋白质印迹结果显示,Ad-shNC+H/R 组Sirt3 蛋白表达较Ad-shNC 组减少,Ad-shXBP1s+H/R 组Sirt3 蛋白表达较Ad-shNC+H/R 组增多(图4D)。与Ad-shNC 组比较,Ad-shNC+H/R 组Ac-SOD2/SOD2 比值升高;与Ad-shNC+H/R 组比较,AdshXBP1s+H/R 组Ac-SOD2/SOD2 比值下降(均为P<0.01,图4D、E)。
流式细胞术结果显示,A d-s h N C+H/R 组mtROS 产生较Ad-shNC 组增多,Ad-shXBP1s+H/R组mtROS 产生较Ad-shNC+H/R 组减少(均为P<0.01,图4F、G)。
3 讨论
近年来,细胞衰老在IRI 中的作用越来越受到关注[3,17-19],研究表明,在小鼠单侧肾IRI 模型中,诱导衰老肾小管上皮细胞凋亡能减轻肾纤维化[20]。故探索细胞衰老发生机制从而开发新型干预策略至关重要。
笔者团队前期发现下调XBP1s 能减少H/R 后mtROS 的产生及p53 表达[11,21],但尚不清楚XBP1s能否调控ROS 诱导的细胞衰老。有研究报道,线粒体相关的Sirt3 可减少SOD2 乙酰化程度,增强SOD2 活性,抑制mtROS 产生[22-24]。本研究采用原代肾小管上皮细胞建立H/R 模型,证明下调XBP1s 能减轻H/R 诱导的细胞衰老,其机制可能是减少了XBP1s 对Sirt3 的转录抑制,使Sirt3 表达上调,促进SOD2 的去乙酰化水平,从而增强SOD2 活性,抑制mtROS 产生,减轻氧化应激。
研究表明H/R 可通过氧化应激使细胞过早发生衰老[4,16,25-26]。为探讨XBP1s 对H/R 诱导的细胞衰老的影响,本研究通过腺病毒靶向沉默XBP1s,结果显示下调XBP1s 减少了衰老细胞,同时抑制了氧化应激水平。然而,XBP1 与细胞衰老的关系尚存争议。在自然衰老小鼠中,过表达XBP1 能防止甚至恢复认知功能衰退,保持突触传递的完整性并减少衰老细胞的自然积累[27]。在结肠癌中,XBP1u 可通过增强p53 泛素化负向调控与细胞衰老密切相关的p53/p21轴[28]。由此可见,XBP1 与细胞衰老的关系需放在具体疾病模型、组织细胞类型及衰老类型中探讨。
本研究通过ChIP-seq 筛选XBP1s 转录调控的下游分子并通过ChIP-qPCR 验证其与启动子序列的结合,Sirt3 作为Sirtuins 家族中最重要的线粒体去乙酰化酶[29-30],可通过位于线粒体的抗衰老分子SOD2 起到抗氧化应激作用,并且S i r t 3 可以直接结合SOD2 使其去乙酰化[14,31-35]。本研究结果证明XBP1s 可对Sirt3 起到转录抑制作用,下调XBP1s 减少其对Sirt3 的转录抑制,促进SOD2 去乙酰化,从而增强其抗氧化应激活性。近年研究表明,Sirt3/SOD2/mtROS通路除了在氧化应激和细胞衰老中起作用,在炎症、自噬性细胞死亡、铁死亡、线粒体稳态中也起到重要调控作用[12,36-38]。这为拓宽XBP1s 的调控作用提供了可能的探索路径。
综上所述,本研究通过构建肾小管上皮细胞H/R 模型,证实下调XBP1s 可减轻细胞衰老,其可能是通过Sirt3/SOD2/mtROS 信号轴发挥作用。这一研究结果可能为延缓急性肾损伤向慢性肾病进展提供新的理论基础和研究方向。但本研究未探索上调XBP1s 后产生的效应,且细胞实验不能完全模拟体内病理生理过程,缺乏临床标本数据加以验证,后续仍需要进一步探索。
