肝移植术后严重门静脉狭窄的三维可视化成像与门静脉支架植入术疗效分析
2024-01-19赵洪强刘影马建明李昂于里涵童翾吴广东卢倩张跃伟汤睿
赵洪强 刘影 马建明 李昂 于里涵 童翾 吴广东 卢倩 张跃伟 汤睿
术后门静脉狭窄是肝移植主要的血管并发症之一,尽管发生率低,但可能造成移植物丢失、患者死亡等严重后果[1]。介入治疗是肝移植术后门静脉狭窄的重要治疗方式,而支架植入相较于单纯球囊扩张更具有优势[2-3]。较正常门静脉狭窄50%以上,存在门静脉高压表现,彩色多普勒超声(彩超)提示门静脉无血流或狭窄处血流加速、狭窄后喷射血流,均为需要介入干预的严重狭窄情况[4-5]。目前三维可视化技术已应用于介入手术,有研究认为基于患者个体化三维模型的术前模拟能较准确地指导包括经颈静脉肝内门体分流术和经导管心血管介入手术等操作[6-7]。本文结合三维可视化技术对肝移植术后严重门静脉狭窄进行三维成像,分析特征并指导介入治疗,探讨三维可视化技术在肝移植术后严重门静脉狭窄临床诊治中的价值。
1 资料与方法
1.1 一般资料
本研究回顾性分析2018年6月至2023年6月在清华大学附属北京清华长庚医院因肝移植术后门静脉狭窄接受介入治疗的10 例患者的临床资料,其中男6 例,女4 例,年龄42(38,51)岁。10 例患者中接受经典原位肝移植5 例、改良背驮式肝移植3 例、亲体右半肝移植1 例、体外肝切除+自体肝移植1 例。原发病包括肝包虫病1 例、乙型病毒性肝炎(乙肝)肝硬化2 例、原发性肝细胞癌4 例、原发性胆汁性肝硬化1 例、不明原因肝硬化1 例、血管周围上皮样细胞肿瘤1 例。术前门静脉内无血栓2 例,Yerdel Ⅰ级血栓3 例,Yerdel Ⅱ级血栓4 例,YerdelⅢ级血栓1 例。本研究经清华大学附属北京清华长庚医院伦理委员会批准(批准号:23 602-6-01)。
1.2 门静脉狭窄三维可视化成像及介入治疗
将患者的增强CT 数据通过IQQA®-3D Liver 系统处理,构建出真实的门静脉-肠系膜上静脉-脾静脉等主要相关属支的数字化三维模型,基于三维模型测量狭窄处直径与正常血管区域管径,狭窄处距门静脉左右分叉、肠系膜上静脉-脾静脉汇合点距离。由1 名肝移植科医师、1 名放射科医师和1 名介入科医师对狭窄的特征进行形态学分析和讨论,并制定治疗方案。门静脉狭窄处血管直径<5 mm,较正常门静脉狭窄50% 以上,门静脉高压表现,门静脉主干流速<20 cm/s 为本研究判定肝移植术后门静脉狭窄介入治疗指征。
门静脉支架植入术步骤见图1。患者取仰卧位,彩超定位门静脉右支远端分支,局麻满意后采用22 G Chiba 针经皮经肝穿刺门静脉右支,透视下造影明确穿刺成功后置入6 F 血管鞘,置入5 F 单弯导管至脾静脉及肠系膜上静脉造影,结合术前影像学明确狭窄程度及范围,并给予3 000 U 肝素钠。部分门静脉严重狭窄患者先行球囊扩张,支架直径选择10 mm 或12 mm,长度选择4~8 cm,10 例患者共置入自膨式支架12 枚,造影明确支架开放良好后予以4 mm×14 cm 弹簧圈封闭穿刺道,术后继续予以低分子肝素钠抗凝治疗并监测凝血功能。

图1 经皮经肝穿刺介入支架植入治疗肝移植术后门静脉狭窄Figure 1 Percutaneous transhepatic puncture and stent implantation for the treatment of portal vein stenosis after liver transplantation
1.3 研究内容
收集患者一般资料,包括性别、年龄、原发病情况、肝移植手术方式、介入治疗距肝移植手术时间、介入治疗前后影像学(彩超和增强CT)特征,介入治疗前及治疗后2 周肝功能、白细胞和血小板情况,介入治疗相关并发症,介入治疗效果及后续随访情况等。总结10 例肝移植术后严重门静脉狭窄患者的狭窄情况及介入治疗效果。
1.4 统计学方法
采用SPSS 21.0 软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,比较采用配对t检验;不符合正态分布的计量资料以中位数(下四分位数,上四分位数)表示,比较采用符号秩和检验。P< 0.05 为差异有统计学意义。
2 结果
2.1 三维可视化成像显示狭窄情况
对二维、三维图像分析发现,10 例患者中狭窄类型包括向心性缩窄3 例,曲折成角致狭窄2 例,受压狭窄2 例,长段狭窄和(或)血管闭塞3 例(图2)。对介入治疗前增强CT 的门静脉期最大/最小密度投影(maximum/minimum intensity projection,MIP)重建图像和三维重建图像进行比照分析,发现尽管MIP 图像可以较好显示门静脉及其主要属支系统,但在空间结构显示方面,较三维重建图像存在一定不足。其主要表现为:(1)二维图像在狭窄处显示不清晰,可能造成误判和漏诊;(2)对曲折成角狭窄的显示效果欠佳,无法呈现空间血管行走形态;(3)对狭窄累及长度判断不准,不便于介入治疗方案的规划(图3)。结合二维、三维图像显示可以更好地判断狭窄部位、类型和累及长度并协助介入治疗。

图2 三维重建显示肝移植术后门静脉、肠系膜上静脉、脾静脉重建图像及相应狭窄情况Figure 2 3D reconstruction images of portal vein,superior mesenteric vein,splenic vein and corresponding stenosis after liver transplantation
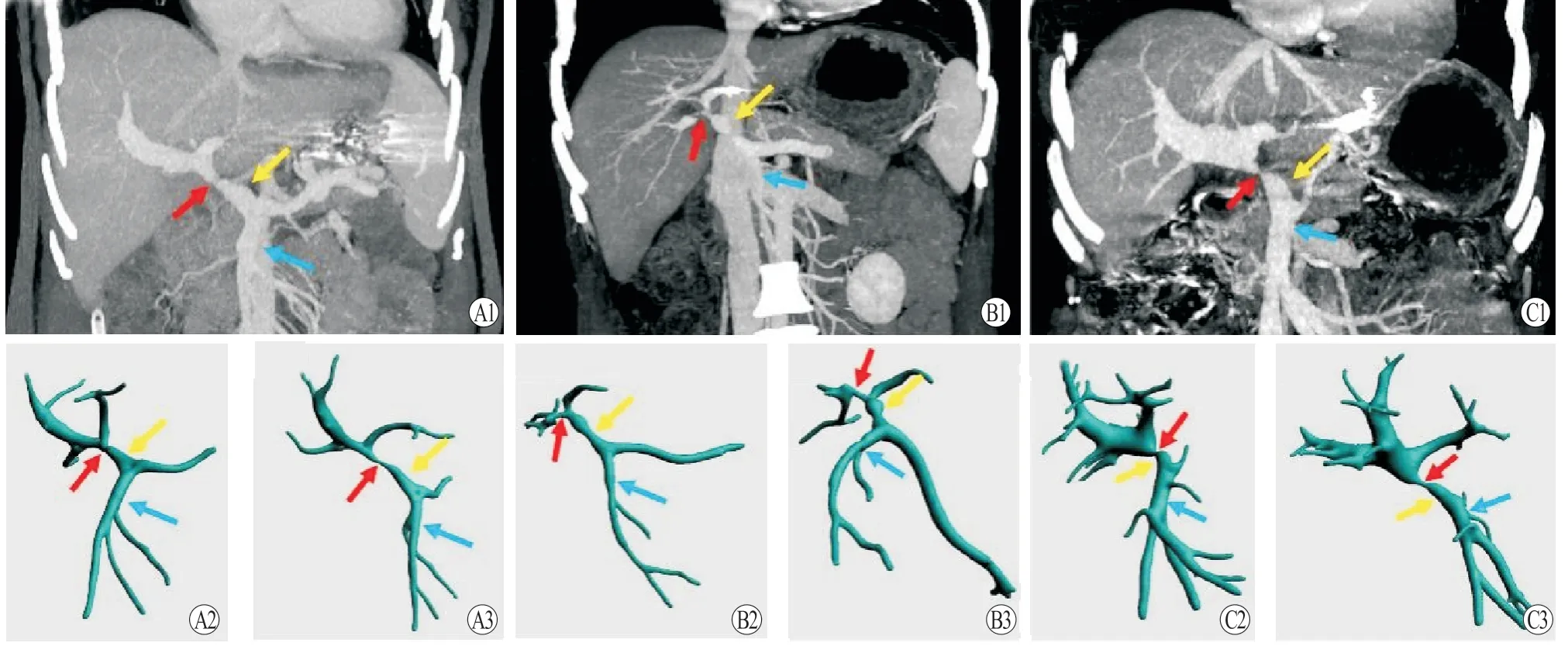
图3 增强CT 的冠状位MIP 图像与三维重建显示门静脉、肠系膜上静脉及相应狭窄情况Figure 3 Coronal MIP and 3D reconstruction images of enhanced CT showing conditions of portal vein,superior mesenteric vein and corresponding stenosis
2.2 介入治疗的疗效分析
所有患者均成功接受门静脉支架植入术。10 例肝移植术后门静脉狭窄接受介入治疗患者的临床资料见表1、2。介入治疗时间距离肝移植时间间隔为132(74,185)d。与肝移植术后首次门静脉最狭窄处直径比较,介入治疗前门静脉最狭窄处直径差异有统计学意义[(5.7±2.4)mm 比(2.6±1.7)mm,P<0.05)]。与介入治疗前比较,介入治疗后门静脉最狭窄处直径[(2.6±1.7)mm 比(6.2±0.9)mm]、吻合口流速[(128±27)cm/s 比(57±19)cm/s]和近肝处门静脉主干流速[(18±6)cm/s 比(41±6)cm/s]差异均有统计学意义(均为P<0.05)。

表1 10 例肝移植术后门静脉狭窄接受介入治疗患者的临床资料Table 1 Clinical data of 10 patients with portal vein stenosis undergoing interventional treatment after liver transplantation
与介入治疗前比较,介入治疗后患者丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TB)、碱性磷酸酶(alkaline phosphatase,ALP)水平呈下降趋势,白细胞和血小板呈上升趋势,但差异均无统计学意义(表2,均为P>0.05)。排除介入治疗前白细胞水平正常的例3 后,与介入治疗前比较,介入治疗后患者白细胞水平升高,差异有统计学意义[(2.9±0.7)×109/L 比(3.9±1.0)×109/L,P<0.05)]。
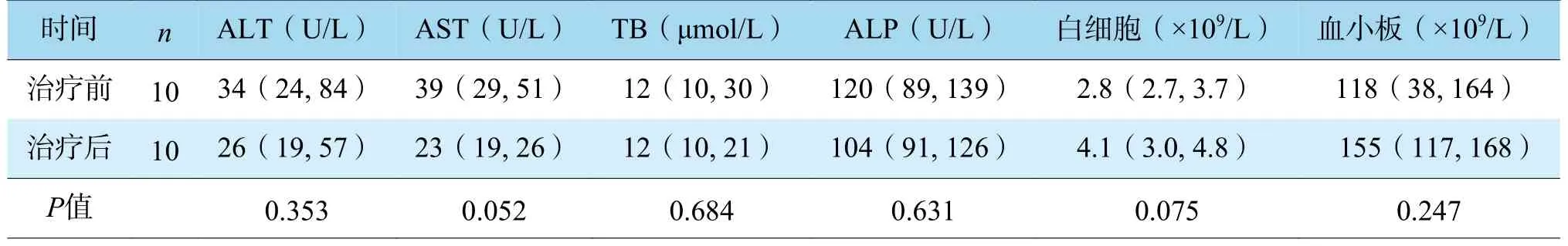
表2 10 例肝移植术后门静脉狭窄患者介入治疗前后指标变化[M(P25,P75)]Table 2 The index changes of 10 patients with portal vein stenosis after liver transplantation before and after interventional therapy
介入治疗后随访时间为17.3(12.7,35.5)个月,所有患者最后一次影像学检查提示门静脉血流通畅,治疗有效率100%。1 例患者因介入穿刺引起肝内血肿,经保守观察治疗后好转,其余患者均未出现相关并发症。
3 讨论
肝移植术后门静脉并发症发生率在3%以下,包括门静脉血栓或狭窄。门静脉并发症严重影响移植物和受者存活率[8-9],术前门静脉系统病变、手术技术和解剖异常是其主要诱因[10-11]。本研究提示术后门静脉周围组织粘连、门静脉受压、血管整形后的成角畸形、血管冗长是造成肝移植术后门静脉严重狭窄的主要原因。
早期轻微的门静脉并发症没有明显临床表现,但严重的门静脉狭窄可能引起移植物功能受损和门静脉高压症状[12-13]。本研究中,介入治疗前门静脉最狭窄处直径狭窄明显,提示肝移植术后门静脉狭窄进行性加重,因此及时诊治对维持移植物功能和改善患者长期预后至关重要。
肝移植术后门静脉狭窄主要通过彩超、增强CT 监测与诊断[14-15]。因彩超具有无创、灵敏、准确、廉价、方便、可重复性强的优势,因此常作为术后门静脉血流检测的主要手段。当发现吻合口狭窄、门静脉血流不足、吻合口流速异常增快时,可进一步进行增强CT 检查明确门静脉血管形态。而增强CT 因价格相对昂贵且存在辐射,故仅在特定时间节点进行规律复查,存在明确门静脉狭窄时可考虑增加复查频率。数字减影血管造影虽为金标准,但因其为有创性检查且存在一定并发症风险,故不推荐作为常规诊断方式,可在进行介入治疗的同时应用[16-17]。
术后门静脉并发症可分为早期(<30 d)和晚期(≥30 d)并发症[18]。依据不同时期采取相应临床治疗决策。除全身抗凝治疗与术后72 h 内可采取急诊手术取栓重新吻合外,介入治疗进行溶栓、球囊扩张和支架植入是主要的治疗方式[19]。由于门静脉狭窄单纯抗凝效果不好,往往需要接受支架植入。对于本文中各类严重的狭窄病变,单纯球囊扩张和溶栓可能难以长期维持门静脉的形态,可能因血管受压曲折等原因再次发病,反复治疗或可增加并发症风险。既往的研究也提示支架植入比单纯球囊扩张的技术成功率更高,而再狭窄率更低[20]。本研究中2 例早期支架植入患者,由于其术前有严重的门静脉病变,因此无法接受再次手术吻合。同时术后早期患者凝血功能尚未完全恢复,额外的抗凝治疗除存在风险外,预期效果不佳,故选择积极介入治疗[21]。经支架植入后成功恢复门静脉血流,狭窄得到显著改善。而晚期并发症患者,可以经过一段时间的全身抗凝和严密监测。由于狭窄渐进性发展,其余8 例患者均接受支架植入。本研究中所有患者均获得了满意的治疗效果。
支架植入可通过经皮经肝穿刺和经颈内静脉入路,本研究采取前者,由于其可直接经超声引导,也是目前报道较为常见的方法[22]。目前经脾脏入路也被认为是安全易行的方法,且不需要穿刺移植肝,降低了移植物风险[23-25]。但由于部分患者接受过脾切除手术、且术前血管病变常自门静脉主干发展至肠系膜上静脉、术中直接自肠系膜上静脉的架桥吻合等客观因素,此类患者可能不适合经脾脏入路。安全性方面,仅1 例出现穿刺相关并发症——肝内血肿,并存在一过性肝损伤表现,其余患者均未发生相关并发症。支架植入前后各项肝功能指标差异无统计学意义,但指标有所下降,呈正常恢复趋势。所有患者经介入治疗后门静脉狭窄均得到有效缓解,肝门处门静脉血流速度恢复,狭窄造成的吻合口喷射血流速度下降。同时狭窄带来的门静脉高压表现得到改善,支架植入后,原有的脾功能亢进造成的白细胞下降有所逆转。支架植入后的抗凝治疗是必要的,建议维持至少1年以上的抗凝治疗,以避免新生门静脉血栓,此后再评估是否需要维持长期抗凝治疗,但停药应慎重[26-28]。对于支架植入的患者,更加严密和规律的超声随访是必要的[29-31]。
综上所述,三维可视化及其衍生技术目前已常规应用于各种介入治疗[32-33]。本研究结果提示三维可视化技术比传统二维影像更加直观地展示门静脉系统的空间立体解剖构象,对判断门静脉狭窄部位、狭窄程度有直观辅助效果,并有利于制定介入干预策略。二维横断面影像虽然可以清晰显示狭窄部位的严重程度并测量门静脉狭窄处直径,但难以判断狭窄部位距肝门左右门静脉分叉和肠系膜上静脉与脾静脉汇合部位的长度。二维冠状位重建及MIP 图像中可能受到不同狭窄形态特点的干扰,尤其是当门静脉前后径显著受压变小,而左右横径尚可时,狭窄程度难以呈现。因此在门静脉系统病变治疗中采用三维可视化技术具有一定优势[34-38]。
总之,肝移植术后严重门静脉狭窄显著影响门静脉血流速度,并带来门静脉高压相关表现。及时的介入干预并植入支架可以有效逆转病变进程并改善门静脉血流。三维可视化技术可以立体直观展示狭窄部位,特征与严重程度,有利于临床医师进行治疗决策和辅助介入操作。
