端侧吻合与侧侧吻合的自体动静脉内瘘的数值模拟分析*
2024-01-18张嘉惠齐天成张怀新
张嘉惠,齐天成,张怀新△
(1.上海交通大学医学院附属仁济医院,上海交通大学医学院临床研究中心,上海 200127;2.上海交通大学 船舶海洋与建筑工程学院,上海交通大学海洋工程国家重点实验室,上海 200240)
0 引言
慢性肾脏病发展至终末期的患者需要使用血液透析手段进行治疗,动静脉内瘘(arteriovenous fistula, AVF)是血液透析手术中所建立血管通路的一种。AVF的稳定性直接关系到患者的生命健康,因此,在早期对血管通路进行诊断及干预,对延长其使用寿命具有重要意义[1]。
血透患者 AVF 的失功原因一般为静脉内膜增生导致吻合口或静脉出口狭窄[2-4]。Roca-Tey等[5]通过对患者内瘘血流量测定,发现AVF 出现狭窄的主要部位是静脉出口,其次是吻合口部位。动静脉内瘘建立后,其局部血流动力学有明显改变:静脉管腔内局部压力升高、血流方向及速度改变、涡流及湍流形成[6]。动静脉内瘘局部流场和血流动力学的改变与静脉内膜增生有密切关系。研究表明,导致内膜增生的一个重要血流动力学因素是壁面剪切应力,一定的高切应力为血管内膜的保护因素,血小板沉积和血脂质沉积更易发生在同一血管段中剪切应力较低、湍流涡流严重的部位,进而导致血管壁内膜增厚,引发动脉粥样硬化等病变[7-8]。但高切应力只在一定范围内保护内皮细胞抗增殖,切应力过高意味着血管内壁在流动过程中受到更大的血液摩擦力,可引起血管内皮细胞机械性损伤[9]。Hofstra等[10]对维持性血液透析患者随访中发现,动静脉内瘘吻合口血液流速与静脉内膜增生肥厚呈正相关。这提示血流切应力在一定范围内有抑制内膜增生的作用,高于或低于此范围都可能引发内膜增生。目前临床上主要通过核磁共振及多普勒超声来获取AVF的血流动力学参数,但以上两种方法对复杂区域的血流测量存在较大误差,难以获取精细的血流速度分布、壁面切应力等关键血流动力学参数。
自体动静脉内瘘属于永久性的血管通路,其手术选择的吻合血管通常为人体前臂手腕部位的桡动脉和头静脉,血管间的吻合是建立透析通路的关键环节,目前临床上采用的吻合方式主要为端-侧与侧-侧吻合,前者是指将静脉端与动脉侧面的血管相吻合,后者是指将动脉与静脉的血管侧面相吻合。不同的吻合方式及吻合质量直接关系到术后AVF的使用功能与寿命。随着计算流体力学的发展,Van Canneyt 等[11]应用计算机模拟了端-侧吻合AVF血流动力学,探讨了不同长度、不同角度吻合方式的影响。而Hull等[12]计算模拟了侧-侧吻合AVF的血流动力学特征,并与文献[11]的45°、90°端-侧吻合进行了比较。但以上研究将血管流动设为定常均流速度,而真实血管流是随时间的脉动流,为此,本研究采用实际的血液脉动速度,对端-侧及侧-侧两种不同吻合方式的AVF进行建模,通过Fluent计算流体力学软件分析和比较两者的血流动力学特征,以及有可能对AVF的使用所造成的影响。
1 模型与方法
1.1 模型构建
本研究在Solidworks中建立AVF模型,见图1。参照相关研究[11]对结构参数的选取如下:动脉内径为4 mm,静脉内径为6 mm。吻合口形状为一个长轴为6 mm,短轴为4 mm的椭圆。端-侧AVF的吻合角度为55°,侧-侧吻合AVF的结扎长度取为15 mm。由于AVF发生狭窄的部位一般为静脉端及瘘口吻合处,为此,本研究在瘘口及临近瘘口的部位,分别截取距瘘口中心位置4、7、9 mm的三个横截面作为研究域;选取的计算域是在此基础上进行扩大,以减小边界条件与实际情况之间误差所造成的影响。
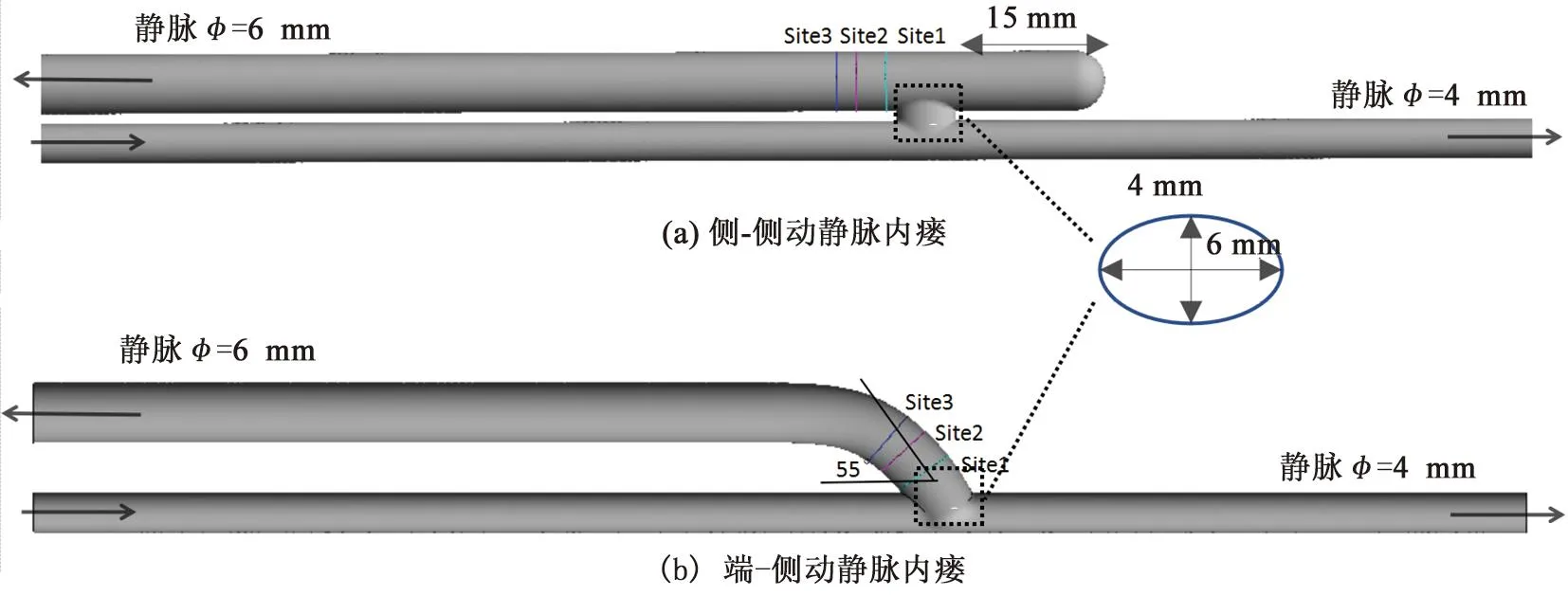
图1 动静脉内瘘模型
1.2 研究方法
1.2.1材料属性 使用Ansys-Fluent计算流体力学分析软件对AVF模型进行瞬态数值模拟。采用多面体网格单元对模型进行网格划分。动脉和静脉血管在周围组织及血流作用下,实际发生的变形很小,可视作固壁。血液设为牛顿流体,黏度为0.003 45 Pa·s,密度为1 050 kg/m3,血管壁面设定为无滑移条件,即壁面处的速度为0。
1.2.2边界条件与计算参数 给定动脉在近心端入口和远心端出口的血液流速,见图2[13],74.1%的动脉血都将通过内瘘直接进入静脉,剩余25.9%的血液通过动脉流出,静脉端出口为自由流出边界。根据血液流速峰值和血管直径算得最大雷诺数约为1 552(<2×103),故采用层流模型。根据以上设定条件,血流的运动遵循质量守恒定律与动量守恒定律,即遵守连续性方程与Navier-Stokes方程。迭代时间步长为0.005 s,计算时长为两个心动周期,选取第二个心动周期内的计算结果进行分析。由图2可得速度入口波形的几个特征时点:主波波峰0.2 s;重搏前波波峰0.35 s;重搏前波波谷0.5 s;重搏波波峰0.6 s,下文将择取这四个时间点的数据对数值模拟结果进行分析。
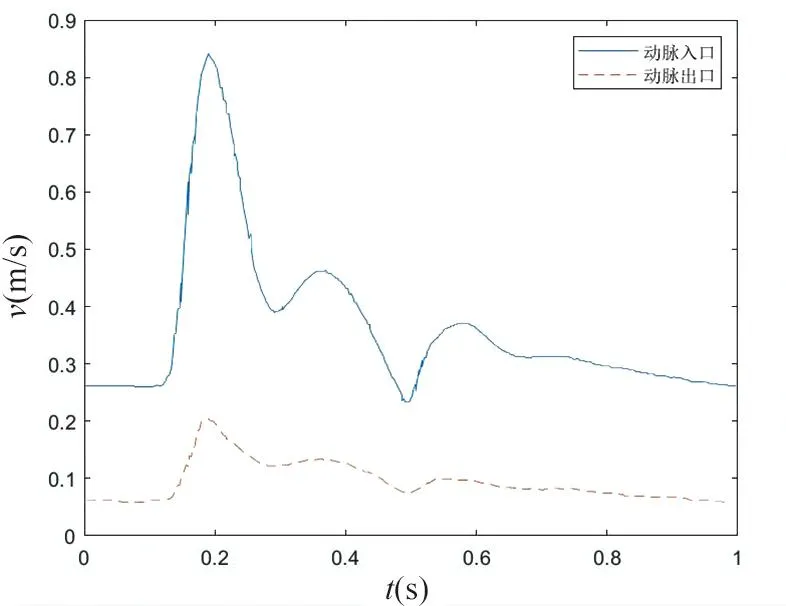
图2 动脉近心端及动脉远心端血流速度曲线
2 结果与讨论
2.1 血流速度
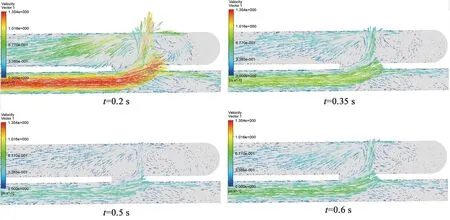
四个特征时点下的速度分布见图3。可见,在整个心动周期内,侧-侧AVF和端-侧AVF在血管壁的瘘口处均出现了最大的速度梯度,即速度变化最剧烈,并且瘘口附近部位在不同时刻下均出现回流现象,形成了明显的涡流。同时,心动收缩期相较于心动舒张期血液流速的变化幅度更大,对血流特性的影响也更加显著。此外,由于从动脉分流而来的血液以一定角度进入静脉,产生了垂直于血管轴向的附加流,因此,在瘘口及瘘口附近,两种内瘘模型均出现了流场紊乱及涡流现象。血流的涡流是致使血管通路及血管壁内皮细胞各类成分分布不均匀的重要诱因,该处易发生脂质浓度极化,严重时可导致血小板沉积,进而引发粥样硬化斑块等病变,这也是动静脉内瘘在临床上的使用寿命要小于人体正常血管的重要原因之一[12-14]。因此,在瘘口及瘘口附近的部位最易发生粥样硬化斑块。而端-侧AVF相较于侧-侧AVF,涡流的程度明显有所缓和。
为探究瘘口及静脉出口处易发生病变的具体位置和血液流速特征,本研究对距离瘘口中心4、7、9 mm的三个横截面处的血流速度分布进行分析。
图4(a)、(b)依次描述了端-侧AVF和侧-侧AVF在四个特征时点下三个截面上的速度分布。可见,随着与瘘口的距离增大,血流速度呈减小趋势。在端-侧AVF与侧-侧AVF中,血液流速的分布都不均匀,局部低速区域主要集中于静脉内侧,而局部高速区域集中于静脉外侧;从距离瘘口中心7~9 mm的截面,局部血流动力学环境发生变化的现象明显变轻,这是因为血液在流经瘘口后发展的愈加充分,因此速度分布趋于均匀。据此推测,壁面切应力的分布也随之趋于均匀。因此,无论是侧-侧吻合还是端-侧吻合,在距离瘘口非常近的部位,静脉端尤其是内侧区域存在发生斑块硬化的高风险。相关研究[15]也表明静脉内膜增生的部位主要在瘘口附近的内侧壁,而外侧壁处则不明显,与本研究的计算结果一致。
2.2 壁面切应力
图5为端-侧AVF和侧-侧AVF在四个特征时刻的血管壁面切应力分布。可见,壁面切应力大小的变化与入口速度呈相同的变化趋势,这是因为血流速度越大,壁面处的速度梯度越大,在心动收缩峰值期t=0.2 s时,壁面切应力达到最大值。两种吻合方式的AVF在瘘口附近的部位均出现了剪切力的不均匀分布。近心端静脉距离瘘口越近,壁面切应力越大,在瘘口的中间位置达到最大值,并且静脉内侧的壁面剪切力明显小于外侧,形成局部低壁面切应力区。相关研究表明[16-17],在瘘口附近的静脉壁内侧区域出现的低流速和低壁面切应力等现象对血管壁的结构和功能具有关键性影响,其会使壁面内皮细胞的形态功能发生改变,导致内皮细胞活性分子的分泌降低,血小板激活黏附,进而形成粥样硬化斑块。

(a)端-侧AVF
(b)侧-侧AVF
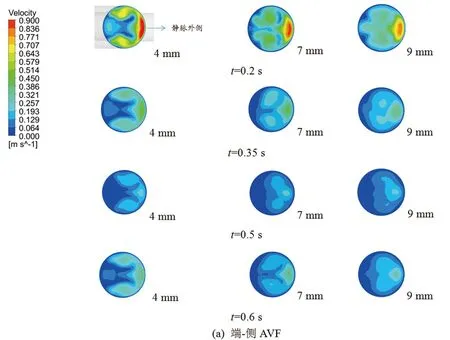

图4 不同时刻下两种AVF模型在三个截面上的流速分布
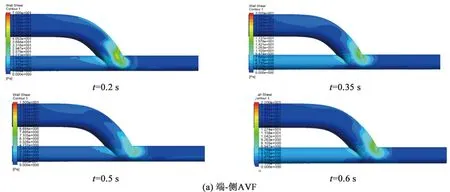
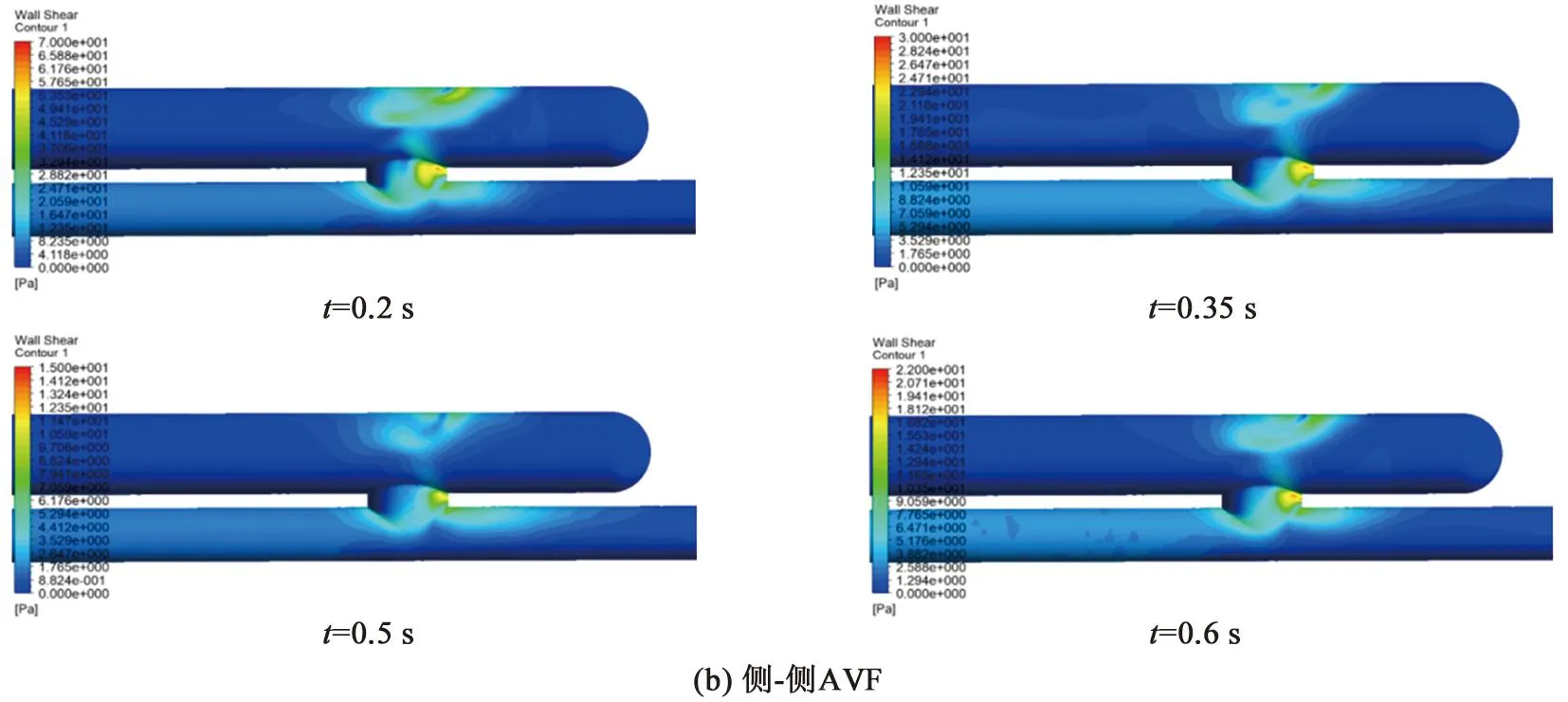
图5 不同时刻下两种AVF模型的WSS分布
为定量探究两种内瘘模型的壁面切应力特性,本研究分别对距离瘘口中心4、7、9 mm的三个横截面site1、site2、site3的壁面剪应力进行统计分析。
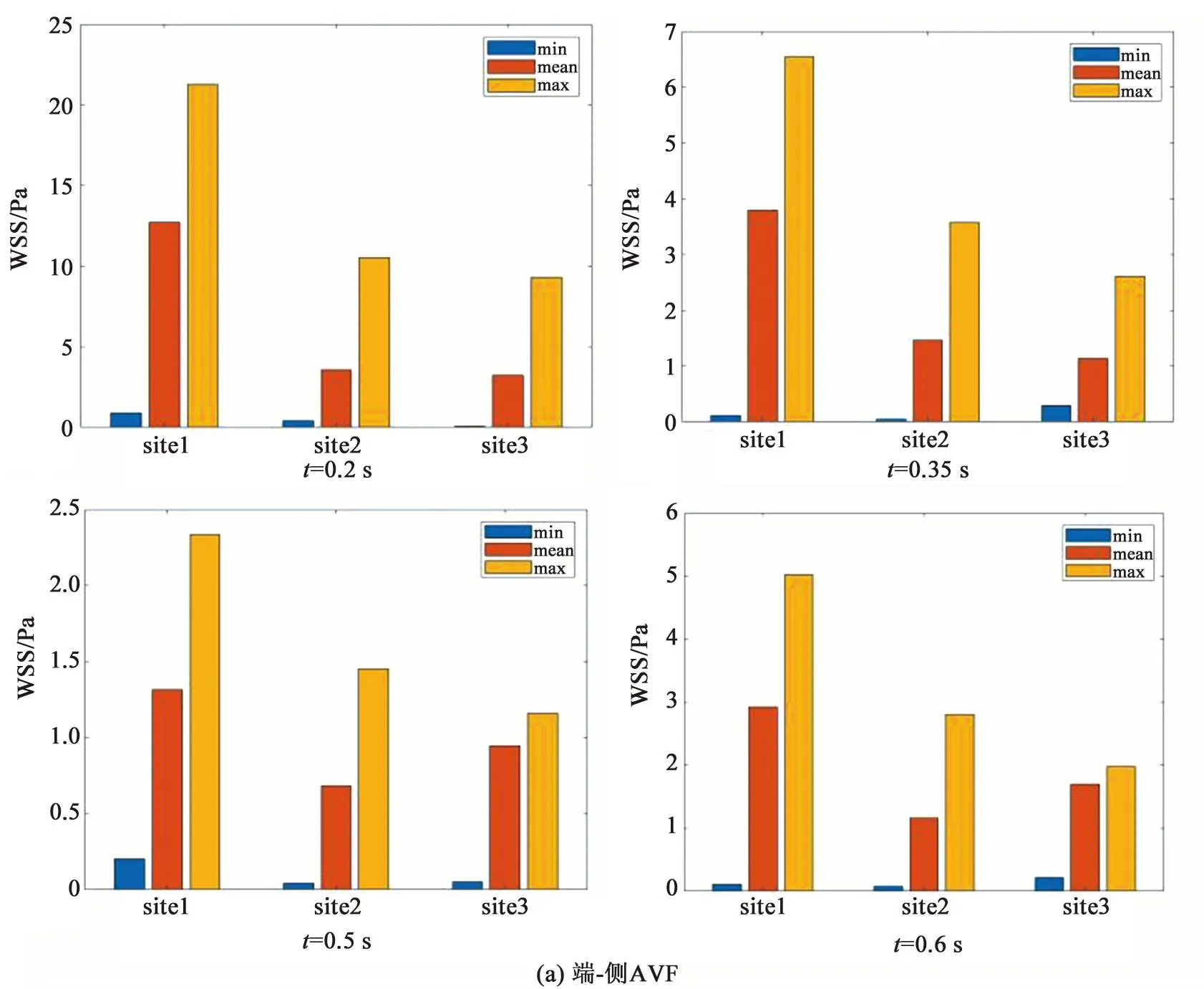
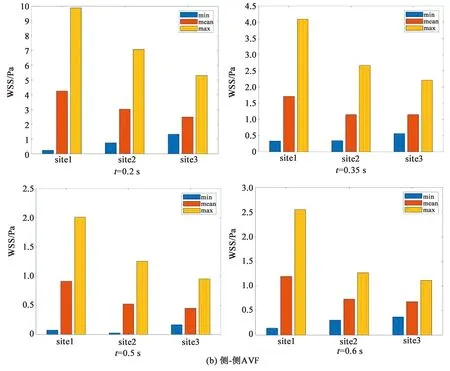
图6 两种AVF模型的壁面切应力特征值Fig.6 WSS characteristics of two AVF models
对比图6(a)、(b)可知,两种模型在三个截面上的壁面切应力最小值比较接近,基本在0~8 dyn/cm2(1 dyn/cm2=0.1 Pa)范围内。端-侧AVF在近瘘口处的壁面切应力水平整体上高于侧-侧AVF,特别在收缩期内,壁面切应力的最大值为66~213 dyn/cm2。大量研究证实[18-19],过高的壁面切应力(>70 dyn/cm2)环境会令血小板活化、释放生物活性分子并参与炎症,进而加快粥样硬化斑块的形成进程。因此,端-侧AVF在收缩期内过高的壁面切应力,可能存在发生粥样硬化的风险。
由图6(b)可知,侧-侧AVF在三个截面上的壁面切应力在不同时刻反映出的规律一致。随着与瘘口距离的增大,壁面切应力的最小值随之升高,而平均值和最大值则呈降低趋势。这表明壁面切应力的分布随着与瘘口距离的增大而趋于均匀。由图6(a)可知,端-侧AVF表现出与侧-侧AVF相似的规律,即壁面切应力的最大值随着与瘘口距离的增大而显著降低,切应力的分布趋于均匀,但壁面切应力的最小值与平均值的变化规律并不明显。
单个时间点的壁面切应力无法反映其随时间变化的规律,因此,本研究在以上瞬时壁面切应力研究的基础上提出其他参数以描述WSS特性,如时均切应力(time-averaged wall shear stress,TAWSS)、振荡切应力指数(oscillatory shear index,OSI)。TAWSS计算了WSS在一个心动周期内的平均值,OSI则描述了WSS在一个心动周期内的瞬时变化,计算见式(1)、(2)[20]:
(1)
(2)
其中τw为上述计算得到的瞬时壁面切应力,T为心动周期。OSI的取值范围0~0.5,表示了流动从稳定到高度振荡的变化。图7为两种AVF模型的TAWSS和OSI分布。
由图7可知,两种AVF模型的TAWSS分布都较为均匀,血液在流经瘘口至动脉远心端和静脉近心端后,TAWSS出现降低。两种AVF模型的高OSI区域均发生在瘘口及近瘘口部位,对比可见明显差异,见图7(b)、(d):端-侧AVF的高OSI区域面积明显大于侧-侧AVF,并且在静脉的内侧血管壁上更为集中。高OSI是预测血管壁发生粥样硬化的重要因素,因为,在高OSI区域更有可能发生血流的停滞和倒流[21]。这表明在瘘口附近,端-侧吻合下AVF的血液流动具有更高的震荡性,更易形成粥样硬化和易损斑块。
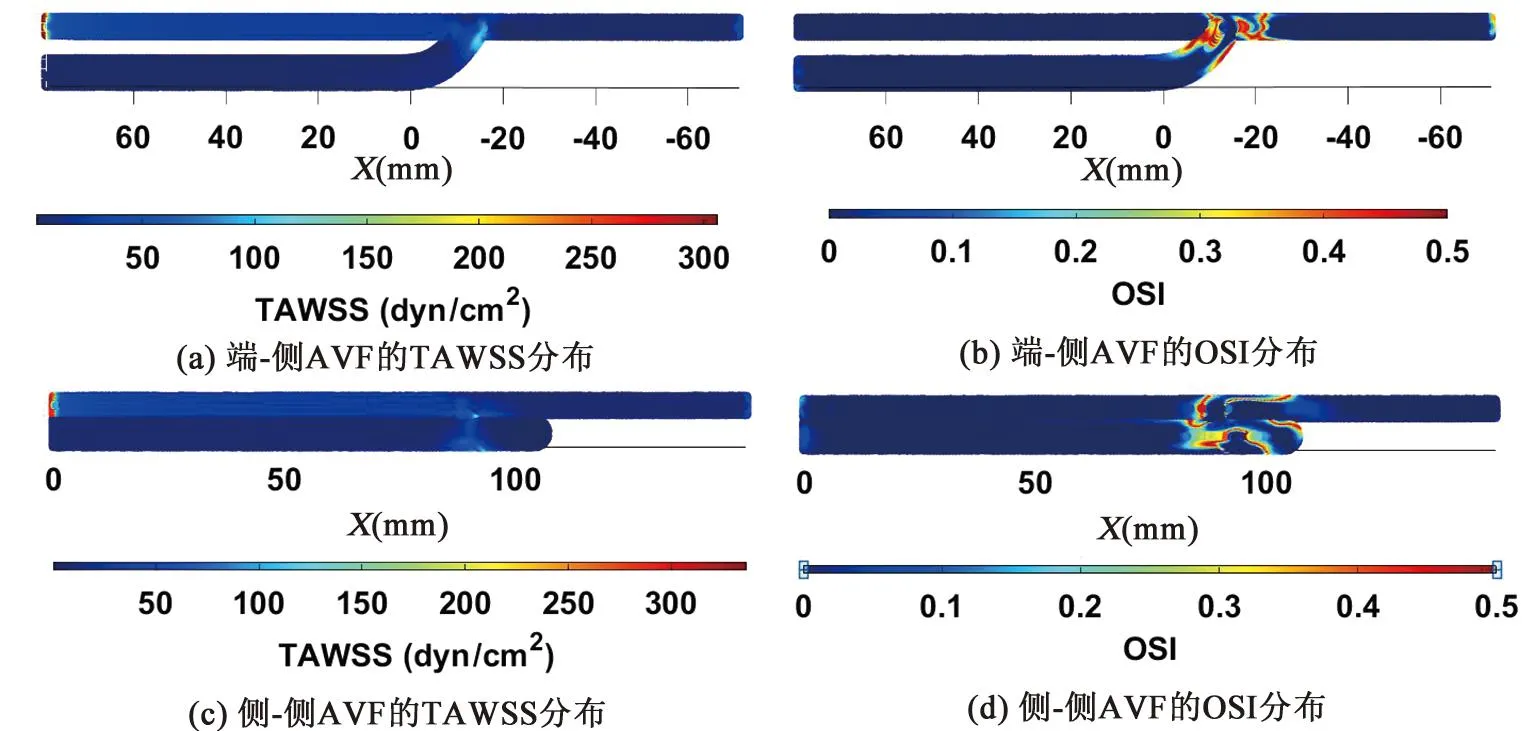
图7 两种AVF模型的TAWSS与OSI分布
3 结语
对于终末期肾病患者,自体动静脉内瘘是进行血液透析治疗的理想通路。本研究通过计算流体力学方法,对两种动静脉内瘘模型的血流动力学特性进行了分析。结果表明,对于端-侧AVF与侧-侧AVF,血流特性最不稳定的部位均为瘘口近心端,特别是吻合口附近的静脉内侧壁,由于低速涡流区域和低壁面切应力的集中,最容易发生血管病变。端-侧AVF相较于侧-侧AVF在近瘘口处的涡流现象有所缓和,但在心动收缩期存在过高的壁面切应力,并且高OSI区域面积也更大。在对动静脉内瘘的吻合方案进行选择和设计时,可考虑以上的计算流体力学分析结果,结合血流动力学因素的特征及差异,为动静脉内瘘的临床应用提供参考。
端-侧AVF与侧-侧AVF都是将一个高压的动脉与低压的静脉相吻合,压力梯度使得本应到远端动脉的血流改变原来的方向,进入静脉,迅速增加的血流撞击吻合口与静脉壁,造成血管壁面剪切应力迅速增加,导致动静脉内瘘血管通路出现少见的高振荡剪切应力状态,同时由于吻合口处的血管弯曲造成流动紊乱,形成低速涡流区域,这些血流动力学的改变可能是引发动静脉内瘘病变与失功的关键因素。因此,应用计算流体力学手段,进一步详细分析,将有助于今后临床上保证血透患者血管通路的畅通。
