冷却射频消融仪器及其控制算法的设计
2024-01-18钱瑞燕辜丹丹刘棣芳姚海涛毛琳周宇
钱瑞燕,辜丹丹,刘棣芳,姚海涛,毛琳,周宇
(上海理工大学 健康科学与工程学院,上海 200093)
0 引言
随着技术的不断发展与创新,射频消融因安全有效[1-2],被广泛应用于肿瘤的治疗,并已成为治疗肝脏肿瘤的重要手段之一。射频消融利用高频交流电流,其单极电极具有单个有源电极施加器,电流在一个或多个负极板处耗散[3]。射频电极产生交变电场,交变电场引起目标组织中离子的振动并产生热量,导致细胞中蛋白质失活[4-6]。
研究表明,温度对肿瘤细胞的伤害取决于温度的高低和持续时间,癌细胞比正常细胞对温度更加敏感。当细胞暴露在高于42 ℃的温度下,细胞的生化反应和代谢过程将受到破坏;在46 ℃下,仅需8 min细胞就会凋亡,在51 ℃下仅需2 min;温度大于60 ℃时,细胞内的蛋白质迅速凝固坏死;当温度大于100 ℃,细胞内的水分会沸腾,造成组织气化或者碳化[7-9]。
在大多数中小型肝脏肿瘤治疗中,采用多极射频消融会导致消融组织因过热而产生碳化现象,射频能量很难传递到距离电极针更远的病变组织,而采用单极消融需采取重叠技术进行多次消融。在此过程中,射频消融产生的微气泡导致重新定位存在技术难度,使得重叠区域不准确,发生健康组织热损伤严重或者消融区域不完全的情况[10]。
冷却射频消融的安全性与传统射频消融相当,且相比于传统射频消融,冷却射频消融可有效降低电极接触组织的温度,减少组织碳化或气化的风险、扩大消融范围,提高治疗效果[11- 13]。为此,本研究设计了一款冷却射频消融仪器,对射频能量采取占空比输出,并设计基于阻抗控制功率的算法,使该算法可预测和控制消融范围,实现更有效的治疗效果。
1 方法与实验
1.1 射频消融仪的研制
图1(a)为自制射频消融仪的结构框图,包括人机交互界面、电源模块、主控模块、射频功率放大器模块以及接口模块。图1(b)为自制射频消融系统的实际外观图。人机交互界面采用医用串口屏幕设置消融模式、开启时间;电源模块主要为其它模块提供电源;并为射频功率放大器模块提供可线性调控的直流电源;射频功率放大模块主要产生频率为450 kHz的射频能量;接口模块包含背极板贴合程度监测电路、温度检测电路;主控板接收来自各模块的反馈量进行控制输出,监测各模块的运行状况并进行对应的保护机制。

图1 射频消融设备
1.2 冷却设备的设计
图2(a)为冷却设备的结构示意图,包括水泵、制冷装置、水排和控制模块。图2(b)为水冷装置的实际外观图。控制模块控制水泵的转速和方向。调整水泵的转速和方向后,开启水泵将冷却液先泵入制冷装置,通过水排后,泵入电极针内部,再排出返回至水泵。

图2 射频冷却设备
1.3 控制算法设计及其机理
研究表明,在5~90 ℃的温度范围内,组织的导热率随温度的升高而增加。由于水分的汽化与导热率呈负相关[14],当牛肝温度超过90 ℃时,热导率和电导率将发生不可逆变化,因此,应控制好功率输出,确保射频电流产生的温度在足以破坏肿瘤细胞的同时,尽量减少因温度过高而导致的过度加热和碳化风险。
采取冷却设备冷却电极针,可以延迟过热和组织碳化[15]。本研究通过优化射频能量输出方式,以实现更有效的冷却效果和均匀的组织消融。通过控制射频能量进行重复的占空比输出,在每个持续1 s的周期内,一半时间用于输出能量,另一半时间则停止输出。在停止输出期间,电极周围的组织因组织液回流而被冷却,射频能量也能利用回流的组织液继续往距离电极更远端进行能量输出[16]。射频能量大小通过算法进行调节,功率输出的控制公式见式(1),基于阻抗调整功率输出的流程图见图3。初始细胞是由细胞膜和细胞内液组成,细胞外面存在细胞外液和细胞间质,当激励电流进入生物组织时,电流以任意方式绕过细胞,在频率f≤1 MHz时,细胞膜可视为开路状态,电流主要在细胞外液中流动,部分电流穿过细胞膜进入细胞内液[17]。此时选取一个较高的固定功率水平(25 W),进行局部组织消融。在此过程中,随着局部温度的上升,细胞结构逐渐受损,导致组织内部液体逐渐释放。图4为阻抗变化趋势[16, 18]。组织阻抗会从一个较大值降低到最小值,并稳定一段时间,实验中,大约从90 Ω左右降至55 Ω左右,在此时间内输出较大的功率能量不会造成组织过热。因此,在阻抗降低期间,本研究每分钟阶跃式增加5 W的能量输出,以确保射频能量进行治疗时足够有效。随后组织的温度持续增加,组织水分开始汽化,阻抗值迅速增加。当检测到阻抗过高时(>300 Ω),将射频输出功率降低为原来的一半,继续每分钟射频功率增加5 W输出。此时通过热传递和低功率射频输出,距离电极针更远处的细胞也受到破坏,组织液增加并回流到电极附近,组织阻抗降低。上述功率和阻抗设定值均为本研究在离体牛肝实验过程中探索所得。
(1)
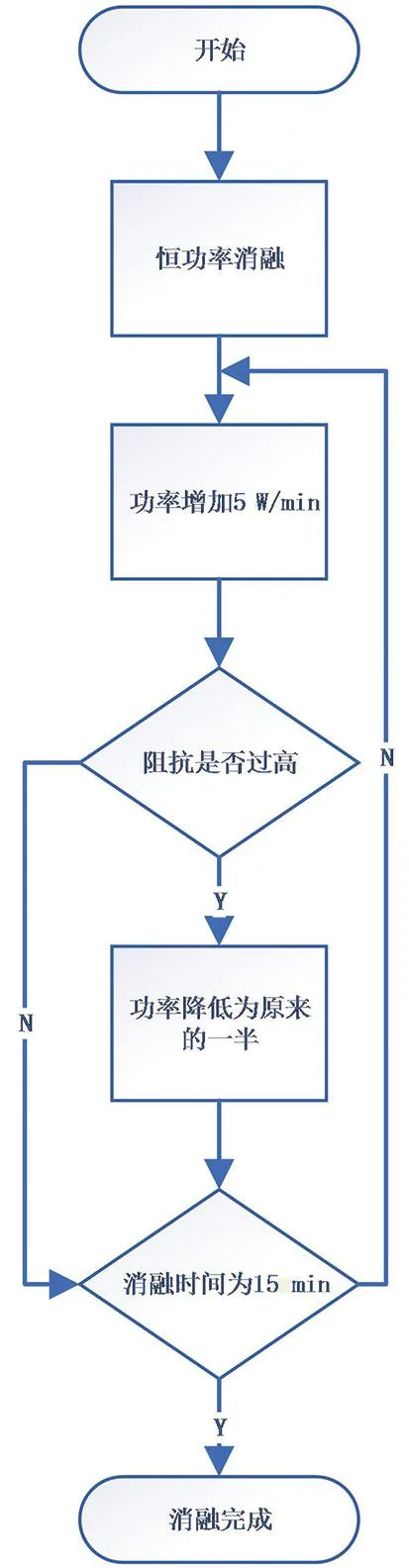
图3 控制算法流程图
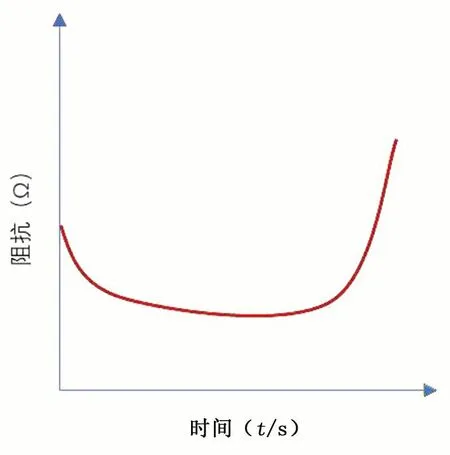
图4 阻抗变化趋势图
1.4 实验材料和方案
本实验使用的冷却针电极直径为2 mm,长度为250 mm,电极未绝缘部分长度为10 mm。本研究采用新鲜的牛肝进行离体实验,对比传统恒功率、冷却恒功率和算法控制三种模式下射频消融实验效果。
1.5 单级射频消融离体实验效果评估方法
单极RFA 用于肝脏、肾脏、心脏、前列腺和其它器官中消融肿瘤时,消融病变处的组织为白色区域,实现了完全和均匀的细胞破坏,周围正常组织的颜色为暗红色[19]。一些研究总结了射频消融离体实验效果的评估指数为椭圆度指数(ellipticity index, EI)和规则性指数(regularity index, RI)。标准球形的EI和RI值都为1。
(2)
(3)
这些参数从消融区域的不同平面测得,轴向平面定义为沿电极轴的平面(见图5(b)),横向平面定义为垂直于电极且拥有最大横向直径的面(见图5(c))。其中,最大横向直径TDmax为横向平面凝固带的两个相对边缘之间的最大距离;最小横向直径TDmin为横向平面中凝固带的两个相对边缘之间的最小距离,在与最大横向直径线相交的一半处的线上测量,单位为mm。轴向直径(AD)定义为轴向平面在电极轴线上凝血区的近端和远端边缘之间的距离。最大半径rmax为电极轴与横向平面中凝固区边缘之间的最大距离;最小半径rmin为电极轴与横向平面中凝固区边缘之间的最小距离(图4(d))[15, 20-22]。
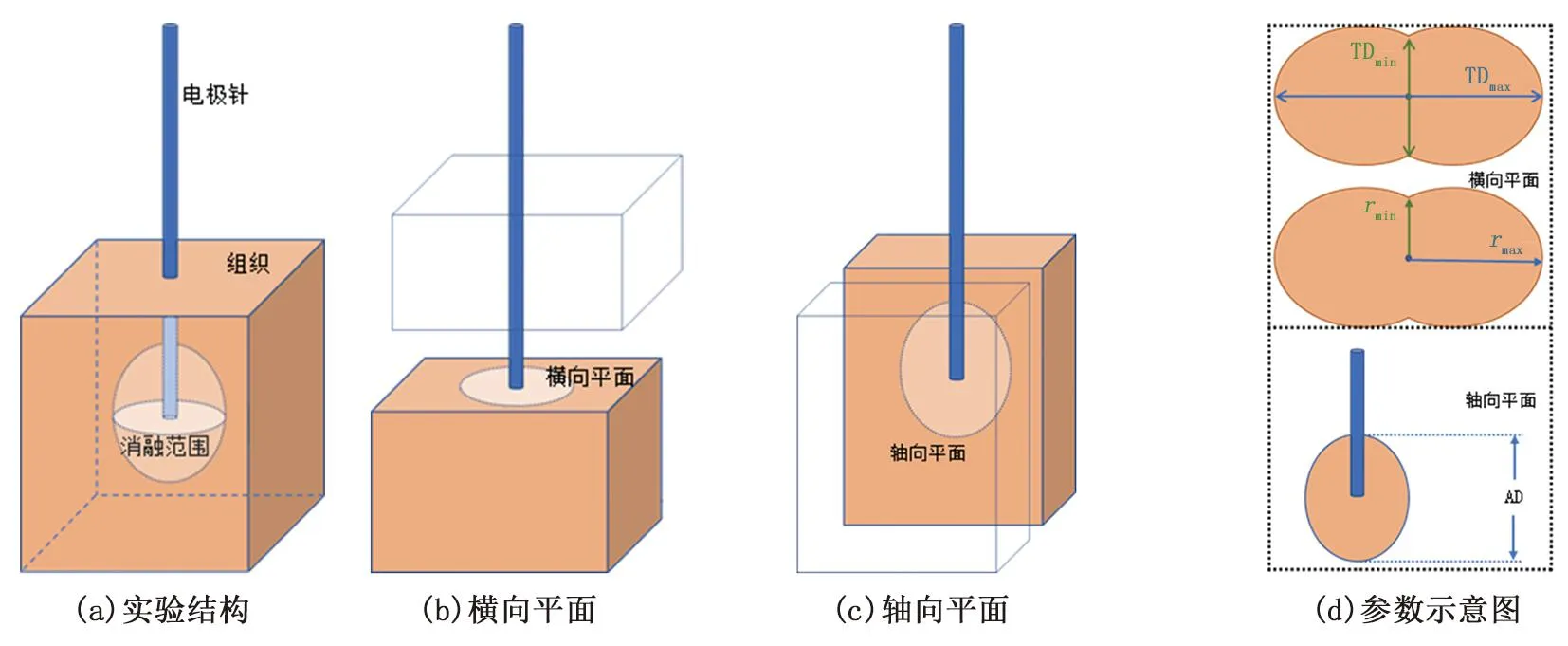
图5 消融参数示意图
2 结果
2.1 传统恒功率射频消融实验结果
本研究采用射频功率为10、20、30、40 W,采取占空比恒功率输出15 min。传统恒功率射频消融实验果见图6。
使用游标卡尺测量TDmax、TDmin、AD、rmax和rmin。由表1的传统射频消融变色区域各参数可知,相对于标准的球形凝固区(EI和RI都为1),传统恒功率射频消融区域的EI最大偏差为253%,RI最大偏差为53%,平均EI值为2.54,平均RI值为0.56。




图6 传统恒功率射频消融
2.2 冷却恒功率射频消融实验结果
冷却恒功率射频消融同样采用射频功率为10、20、30、40 W,采取占空比恒功率输出15 min。冷却恒功率射频消融实验结果见图7。
由表2的各项消融参数可知,冷却恒功率射频消融变色区域的EI最大偏差为32%,RI最大偏差为43 %,平均EI值为1.13,平均RI值为0.66。
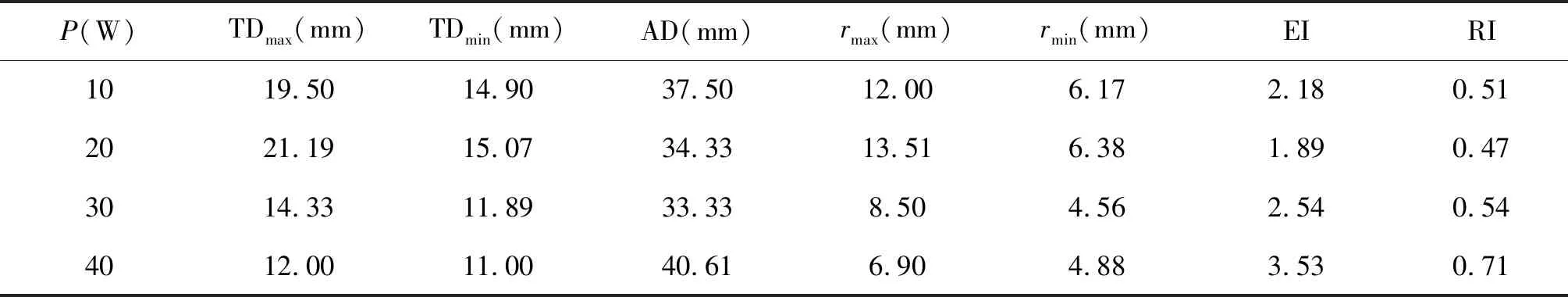
表1 传统恒功率射频消融变色区域各个参数




图7 冷却恒功率射频消融
2.3 算法控制冷却射频消融实验结果
本研究算法控制离体牛肝实验结果,见图8。实验中,采用四根热电偶对以电极针为中心,半径为15 mm的前后左右测温。图9为在射频消融15 min内,四根热电偶采集到的组织温度逐渐增加,越过51 ℃,时间大于2 mim。这表明,在直径为30 mm的消融区域范围内,牛肝组织都彻底坏死,证明了自制冷却射频消融系统在15 min内,使用单根电极可一次性消融直径不小于30 mm的病变组织。
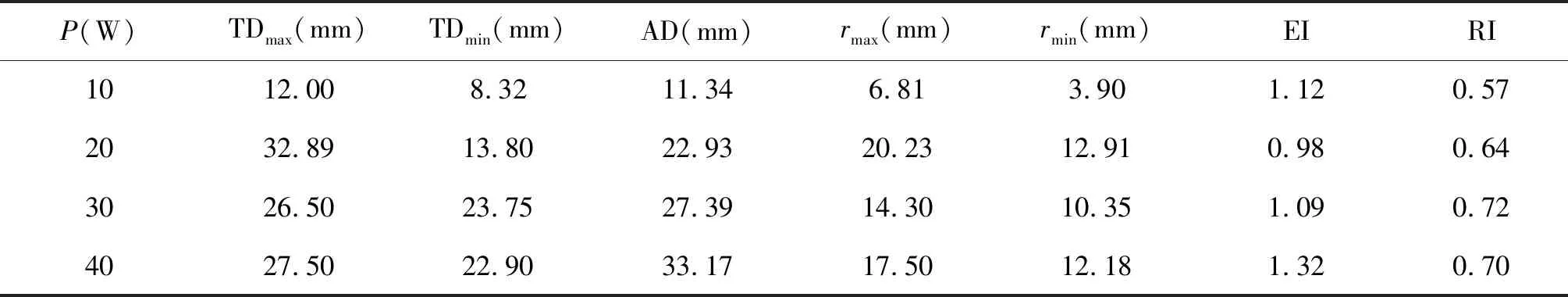
表2 冷却恒功率射频消融变色区域各个参数



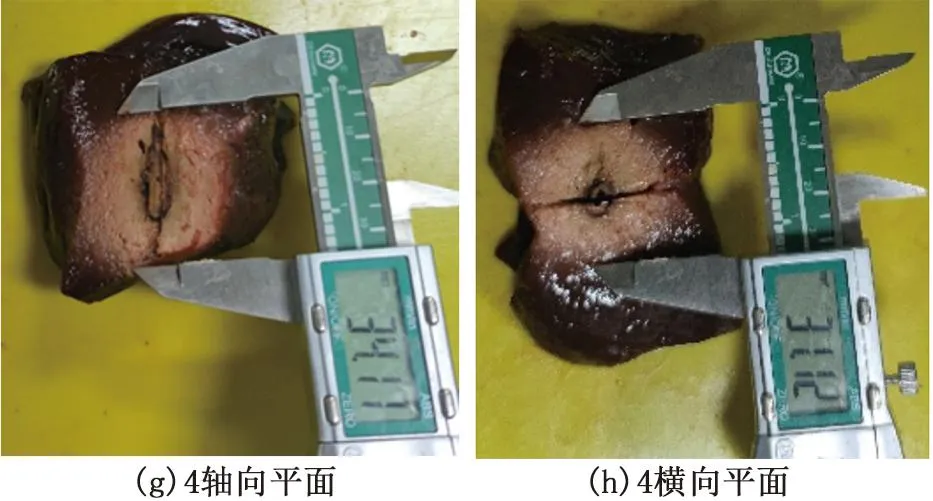
图8 四组算法控制离体牛肝实验图
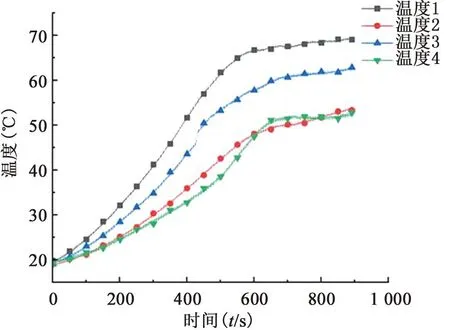
图9 距电极针半径15 mm四周温度曲线图
由表3的消融区域各参数可知,本研究算法控制冷却射频消融的消融EI最大偏差为8%,RI最大偏差为42%。四组控制算法下随机离体牛肝实验的平均EI值为1.03,平均RI值为0.72。
3 实验分析讨论
三种不同射频消融模式下,离体实验计算得到的EI、RI值见图10。
在三种不同模式下RI、EI的方差值见表4。其中,本研究算法控制离体实验中EI和RI的方差最小,稳定程度在三种消融方式中最高。
传统恒功率射频消融的EI和RI值距标准球形偏离程度最大,消融范围的横向直径最小。这是由于在传统射频消融中,高频电流通过电极进入体内组织,当局部组织升温到100 ℃而发生沸腾、气化或碳化时,“烧焦的组织”相当于绝缘体,其电阻骤然增加,限制交流电的流动,降低了热量传递效率,导致消融范围缩小[23]。由图11(a)传统射频消融的电流密度走向可知,交流电会沿着阻抗低的路径传递,由于出现组织碳化,交流电开始沿着电极针轴线方向来回流动,此不均匀的消融可能会伤害周围健康组织、增加术后并发症等。

表3 算法控制冷却射频消融变色区域各个参数
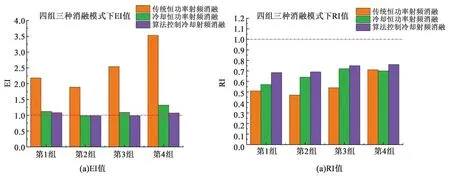
图10 三种消融方式的EI值RI值
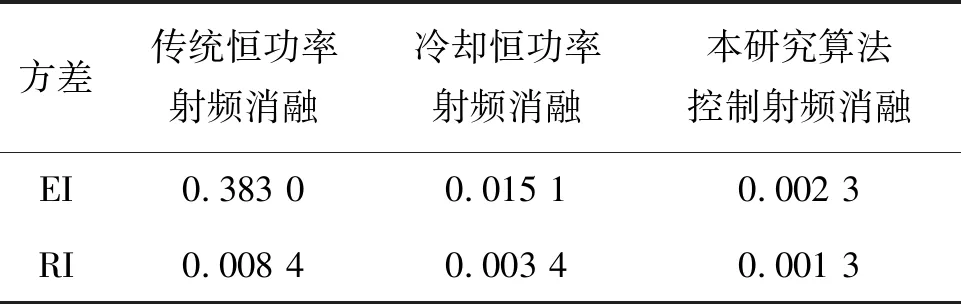
表4 三种消融模式EI与RI的方差
冷却设备可控制电极针表面的温度处于较低水平,减少过度加热的风险。由3.1离体实验结果图可知,冷却恒功率射频消融获得的范围更大,是由于冷却电极针可以将更多能量输送到目标组织,产生更有效的损伤[24-25]。由图10可知,冷却恒功率射频消融的EI和RI值比传统恒功率射频消融更接近于1,且冷却恒功率射频消融电极针拔出顺利,电极针表面比较干净。而传统射频消融电极针拔出需要的力度更大,电极针表面常带出因过热而碳化和粘连在电极针表面的组织,冷却射频消融避免此情况。
本研究的算法控制射频消融可以在一次性实验下获得直径大于30 mm的消融区域。由图10与表4可知,算法控制的冷却恒功率消融下的EI和RI值在三种消融模式中最稳定且消融区域接近于标准球形,这是由于算法控制冷却射频消融在冷却电极同时,采用占空比输出,使得每个周期内组织都有空闲时间回流。射频输出根据采集到的阻抗值不断进行自适应调整,避免出现部分组织过热而发生加热不均匀。由图11(b)算法控制下电流密度走向可知,大部分交流电会沿着电极针轴线四周方向传递,冷却射频输出有更大的能量输送能力和消融范围,产生更均匀的消融结果。在本研究自制冷却射频消融仪器下,本研究设计的算法控制冷却射频消融比传统和冷却恒功率消融更稳定、更趋于球形,规则程度更大。
4 结论
本研究在自制冷却射频消融设备的基础上,基于阻抗控制算法进行占空比能量输出,以实现在获得更大消融区域的同时,得到更规则且趋于球形的消融范围。相较于传统和冷却恒功率射频消融,本控制算法下随机离体牛肝实验的EI最大、偏差值最小,平均EI和平均RI值最接近于1,EI和RI的方差值为0.002 3和0.001 2,稳定性好。并且每次消融范围的直径都大于等于30 mm。球形损毁的形成可在临床应用中具有更好的预测性、均匀性和安全性,使得医生能更好地规划消融过程,并确保消融区域足以覆盖目标组织,从而更好地避免伤害周围健康组织。
