2022年英国风湿病学会《孕期和哺乳期用药-免疫调节抗风湿药物和皮质激素类药物》指南解读
2024-01-18董晓静
姚 蓉,董晓静
(重庆医科大学附属第二医院妇产科,重庆 400010)
风湿性疾病(风湿病)是一大类主要累及关节及其周围组织的系统性疾病,所涵盖的病种包括系统性红斑狼疮(SLE)、抗磷脂综合征(APS)、类风湿性关节炎(RA)、干燥综合征(SS)、系统性硬化病(SSc)、特发性炎性肌病(IIM)、系统性血管炎、脊柱关节炎等[1],治疗药物主要包括非甾体抗炎药、糖皮质激素及改善病情的抗风湿药物(DMARDs)。许多疾病需要长期用药治疗,随意停药或更换药物可能导致病情加重甚至危及患者生命,对于特殊时期如妊娠期、哺乳期及父亲用药对母胎的安全性一直是患者非常关心的问题,为此国内外专家针对风湿病围妊娠期用药发布了指南或用药规范。然而,不断有新研发药物出现,增加了妊娠期和哺乳期用药安全性的不确定性,2022年英国风湿病学会(BSR)在2016年指南[2]的基础上更新了药物种类和安全性相关的证据,发布《孕期和哺乳期用药-免疫调节抗风湿药物和皮质激素类药物》指南(以下简称指南),内容包括抗疟药、糖皮质激素、传统合成的抗风湿药物(csDMARDs)和免疫制剂、生物合成DMARDs(bDMARDs)和靶向合成DMARDs(tsDMARDs)在妊娠期、哺乳期的安全性及对父亲用药方面的建议[3],见表1。指南补充了bDMARDs和tsDMARDs的推荐意见,旨在为医务人员使用该类药物提供依据。根据GRADE标准,推荐等级1表示强推荐、2表示弱推荐,证据等级分别用A、B、C表示,SOA(Strength of agreement)即专家对建议的认可度以百分比表示。
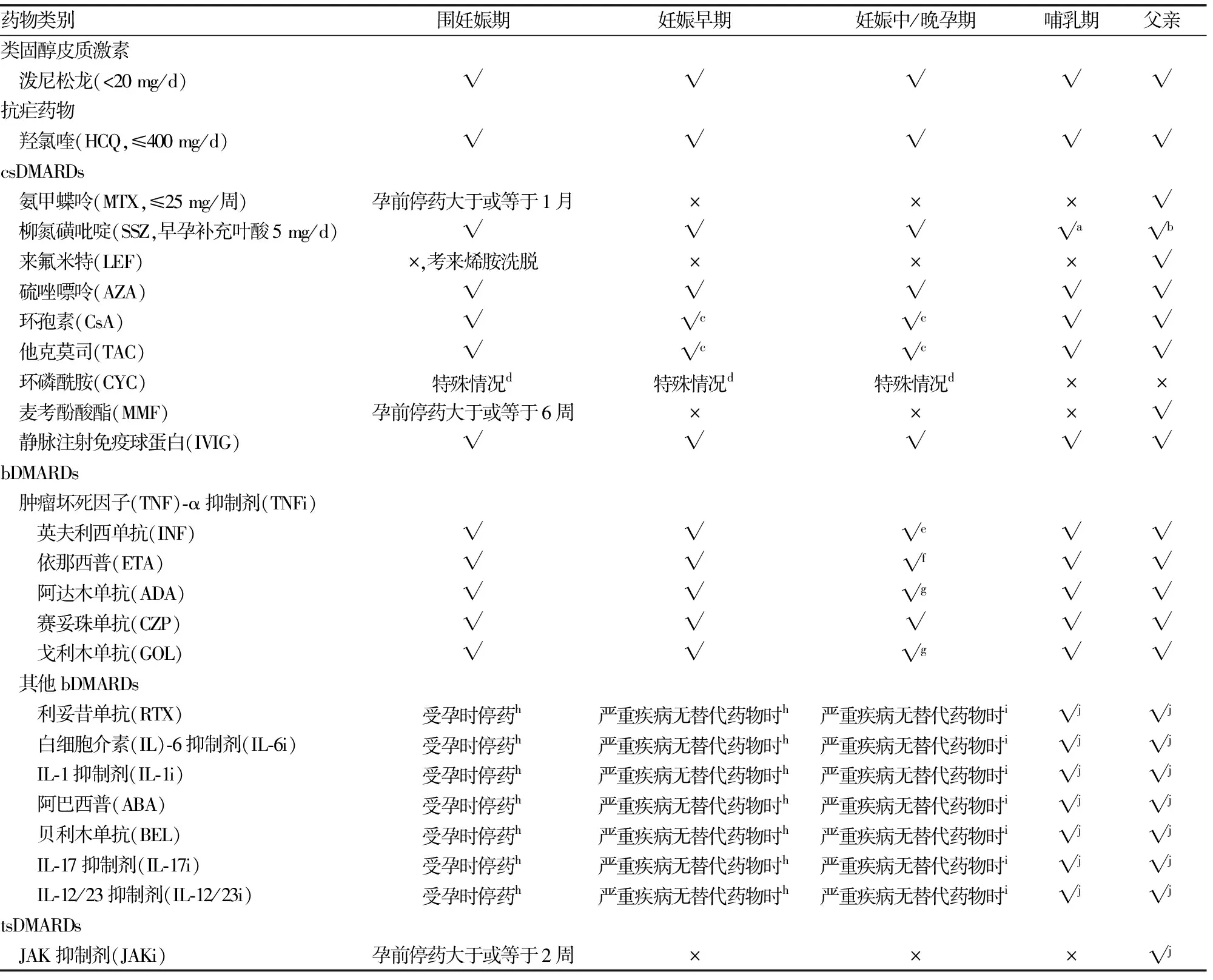
表1 孕期和哺乳期用药安全性汇总
1 妊娠期风湿病患者使用免疫调节和(或)皮质激素类药物的一般建议
1.1推荐意见 (1)风湿病患者备孕前应前往专业机构咨询以便更好地控制疾病,并得到关于妊娠时机、围妊娠期药物治疗及避孕的建议(GRADE 1A,SOA 99.5%);(2)有妊娠计划时避免使用妊娠期不相容药物(GRADE 1A,SOA 100.0%);(3)医务人员在选择妊娠期控制母体疾病药物时应讨论并详细记录药物对母体和胎儿各自的风险和益处(GRADE 1A,SOA 99.5%);(4)应在备孕时将孕期避免使用的免疫调节剂替换为可安全用于妊娠期的药物,并确保更换的新药仍能控制病情发展(GRADE 1A,SOA 100.0%);(5)若没有妊娠期可选用的安全药物,应优先考虑对母亲疾病的控制效果而不是对胎儿的潜在风险(GRADE 1B,SOA 99.0%);(6)所有bDMARDs均可在妊娠期用于控制严重或处于活动期的母体疾病(GRADE 1B,SOA 98.5%);(7)对于宫内暴露于bDMARDs的新生儿产后疫苗注射时间应根据使用药物的种类、生物利用度、代谢时间和接种疫苗种类决定(GRADE 1C,SOA 99.5%);(8)尽可能调整药物剂量至控制疾病进展的最低有效剂量,在评估母亲停止治疗后疾病发作风险低的情况下可以考虑停药(GRADE 1B,SOA 100%);(9)部分药物可能会降低男性的生育力,但目前关于父亲暴露与不良母胎结局的相关性研究证据不足,有限的证据认为正在服用抗风湿病药物的男性可正常备孕(GRADE 2C,SOA 98.4%)。
1.2解读 风湿病治疗药物复杂多样,对于治疗期间需要备孕的夫妻建议转诊至专业机构进行孕前咨询,联合多学科针对性讨论母亲妊娠期用药对母体和胎儿的风险和收益,在选择或更换药物前,必须考虑到由于药物不良反应、控制疾病效果减弱而导致母亲病情恶化的可能性,原则上以母亲的安全为主,选择对胎儿有潜在益处且不加重母亲疾病的药物。男性患者使用部分药物可能会降低男性生育力(少精、畸精等),但基于目前已发表的文献来看,父亲暴露并未增加母胎远近期并发症发生风险。
2 抗疟药物
2.1推荐意见 (1)HCQ仍然是女性患者计划妊娠且需要药物治疗时可选择的抗疟疾药物,应该在妊娠期持续服用,用药剂量小于或等于400 mg/d(GRADE 1B,SOA 100.0%);(2)可用于哺乳期(GRADE 1B,SOA 99.5%);(3)父亲可以使用(GRADE 2C,SOA 99.3%)。
2.2解读 HCQ主要用作抗疟药物,也具有抗炎和免疫抑制作用。HCQ是妊娠期治疗风湿病的常用抗疟药物。指南共纳入46项包括4 701例妊娠期暴露于HCQ的研究,主要集中在妊娠早期,数据分析后未发现HCQ对妊娠周数和新生儿出生体重的不良影响,甚至可能延长妊娠周数并增加新生儿出生体重。虽然HCQ可以通过胎盘,目前没有足够证据说明HCQ增加胎儿致畸风险,一项大型队列研究纳入2 045例妊娠早期暴露于HCQ的母亲,虽然结果显示妊娠早期每天摄入超400 mg HCQ可能略微增加胎儿先天性畸形风险,主要表现为唇腭裂、呼吸系统异常、泌尿系统缺陷[4],由于研究未排除混杂因素影响,仍认为对大多数患者来说妊娠期使用HCQ带来益处可能会超过这种风险。HCQ可能导致不可逆的视网膜损伤[5],建议HCQ最大剂量不超过400 mg/d。妊娠期应持续使用HCQ,停药可能导致病情加重或流产发生[6-7]。母乳中检测到的HCQ浓度小于1%,对母乳喂养的婴儿无不良影响[8-9]。对13例父亲暴露于HCQ的数据分析未发现其增加胎儿不良事件[10]。
3 皮质激素类药物
3.1推荐意见 (1)泼尼松龙是治疗女性妊娠期间风湿病的首选皮质激素类药物,用药期间注意监测母亲血糖、血压(GRADE 1B,SOA 100.0%);(2)用药剂量应小于20 mg/d,并逐渐减量至控制母体疾病的最小有效剂量(GRADE 1C,SOA 99.5%);(3)泼尼松龙哺乳期可使用(GRADE 1B,SOA 100.0%);(4)甲泼尼龙(MP)的胎盘转运率与泼尼松龙类似,妊娠期及哺乳期均可以使用(GRADE 2C,SOA 99.0%);(5)父亲可以使用泼尼松龙(GRADE 1B,SOA 99.3%)。
3.2解读 用于治疗风湿病的皮质激素类药物主要为糖皮质激素,包括泼尼松龙、泼尼松、MP等,糖皮质激素为强效抗炎药,在疾病早期可以通过抑制基因表达延缓病情进展[11],这些激素主要在胎盘代谢,仅不到10%的药物到达胎儿体内。既往研究认为,泼尼松龙对妊娠结局没有任何不良影响,指南最新纳入研究发现泼尼松龙可能增加低出生体重、子痫前期、早产的风险[12]。这一风险可能与大剂量使用泼尼松龙有关,因为一项前瞻性研究未发现每天使用泼尼松龙的剂量小于或等于20 mg是不良妊娠结局的高危因素[13]。目前认为泼尼松龙对早产及胎儿不良结局的影响需要高质量证据证实。泼尼松龙母乳暴露的证据有限,但研究显示母乳中检测到的药物浓度非常低,即使低浓度的药物不认为会对婴儿带来任何风险,可选择用药后等待2~4 h哺乳,减少婴儿的暴露[14]。对于母乳暴露的婴儿进行长期随访未发现不良影响。MP的胎盘转运率与泼尼松龙类似,但其作用持续时间更长,推测MP同样可以在妊娠期及哺乳期使用。对4 507例父亲暴露于皮质激素类药物的数据分析未发现其增加胎儿不良事件[10,15-20]。
4 csDMARDs及免疫抑制治疗
csDMARDs在治疗RA中有一定疗效,其作用机制主要是通过对免疫细胞的抑制,间接控制关节等组织的炎症。常用的csDMARDs包括MTX、SSZ、LEF等。
4.1MTX
4.1.1推荐意见 (1)妊娠期应避免使用任何剂量的MTX,并在妊娠前1个月停用更换为其他妊娠期相对安全的药物(GRADE 1A,SOA 98.0%);(2)妊娠前1个月内接受小剂量MTX治疗(<25 mg/周)的女性应持续补充叶酸(5 mg/d)至妊娠12周(GRADE 1B,SOA 99.5%);(3)小剂量MTX治疗期间意外妊娠者应立即停药,继续补充叶酸并尽早转诊至专业机构评估胎儿的风险(GRADE 1C,SOA 100%);(4)由于理论风险及妊娠结局数据不足,哺乳期不推荐使用(GRADE 2C,SOA 99.0%);(5)父亲可以使用小剂量的MTX(GRADE 1B,SOA 99.3%)。
4.1.2解读 MTX作为细胞毒性药物具有明确的致畸性,现认为MTX的致畸风险与用药剂量有关。已证实妊娠早期大剂量MTX(>25 mg/周)会导致胎儿严重畸形,包括头面部缺陷、手指畸形及脊柱和肋骨缺陷等,但早期暴露于小剂量MTX所导致不良妊娠结局风险暂不明确,需要进一步咨询胎儿疾病相关专家。MTX可以抑制二氢叶酸还原酶的活性,干扰叶酸合成,从而产生一系列不良反应,孕期使用MTX需大剂量补充叶酸减少胎儿神经管畸形风险[21]。指南缩短了孕前MTX停药间隔,因为有研究显示妊娠早期暴露于小剂量MTX的母亲与妊娠前停用MTX的疾病组比较胎儿先天性畸形、死亡或新生儿并发症的风险没有显著增加[22-23]。但对3例妊娠早期暴露于MTX的新生儿进行了14个月的产后随访发现了MTX相关的远期并发症,包括半叶前脑无裂畸形、心脏异常、气管狭窄需要行切开术和抗癫痫治疗。哺乳期用药安全性仍存在争议,目前仅报道了2例哺乳期用药母乳中检测到低剂量的MTX,未发现不良影响。如果在长期使用小剂量MTX期间进行母乳喂养,应注意监测新生儿的血图分析。指南分析了2 026例父亲暴露于MTX妊娠情况与4 700 599例未暴露的相比没有发现不良胎儿结局的风险增加,更加确定了父亲暴露的安全性。
4.2SSZ
4.2.1推荐意见 (1)SSZ可在整个妊娠期使用,孕前开始补充叶酸(5 mg/d)至妊娠早期(GRADE 1B,SOA 100.0%);(2)健康足月儿哺乳期可使用(GRADE 1C,SOA 99.5%);(3)男性使用SSZ可能导致生育力下降,但没有证据表明父亲不可以使用SSZ,如果用药期间超过12个月未怀孕,应考虑停用SSZ同时检查其他可能导致不孕的原因(GRADE 1C,SOA 99.0%)。
4.2.2解读 SSZ是水杨酸与磺胺吡啶的偶氮化合物,具有抗菌、抗风湿和免疫抑制作用。指南未发现关于SSZ的研究更新,基于既往178例母亲在妊娠期暴露于SSZ的数据分析未发现不良妊娠结局。由于SSZ会损害人体叶酸的吸收,因此接受SSZ治疗的母亲应补充叶酸[21]。尚无研究显示大剂量补充叶酸(5 mg/d)相较于标准剂量(0.4 mg/d)会增加母儿获益。SSZ在母乳中含量很低,但避免在用药期间对早产儿、高胆红素血症或葡萄糖-6-磷酸脱氢酶缺乏症的婴儿哺乳。男性使用SSZ可能出现精子数量减少、精子活力降低及异常精子比例增加等,但对237例父亲暴露于SSZ的数据分析未发现其增加胎儿不良事件[16,19,24-25]。
4.3LEF
4.3.1推荐意见 (1)虽然LEF可能不是人类致畸物,但仍缺乏有效证据支持其在妊娠期使用(GRADE 1B,SOA 98.0%);(2)用药期间考虑妊娠的女性应停药并进行标准的考来烯胺洗脱程序后换用其他妊娠期可以使用的替代药物(GRADE 1B,SOA 98.8%);(3)如果服药期间意外妊娠,立即停药,并进行标准的考来烯胺洗脱程序后转诊至母胎专家进行咨询(GRADE 1B,SOA 99.0%);(4)哺乳期不建议使用(GRADE 1C,SOA 99.5%);(5)父亲可以使用(GRADE 2C,SOA 99.3%)。
4.3.2解读 LEF是一个具有抗增殖活性的异唑类免疫调节剂,在妊娠期是禁用药物。指南分析814例妊娠暴露于LEF的研究未发现不良妊娠结局增加,基于有限的证据目前不认为LEF对人类存在致畸性,仍需要高质量的证据证明其在妊娠期使用的安全性。目前尚无哺乳期暴露于LEF的研究。一项研究报道了2例父亲妊娠前3个月使用了LEF并且没有进行标准的考来烯胺洗脱程序,其导致意外妊娠后没有发生胎儿不良事件[16,26]。
4.4AZA
4.4.1推荐意见 (1)整个妊娠期可使用AZA(GRADE 1B,SOA 100.0%);(2)哺乳期可使用(GRADE 2C,SOA 99.5%);(3)父亲也可使用AZA(GRADE 1B,SOA 99.3%)。
4.4.2解读 AZA是一种有机化合物,具有嘌呤拮抗作用,其在体内的代谢产物为6-巯基嘌呤(6-MP)和具有治疗活性的6-巯鸟嘌呤核苷酸(6-TGN)。经过胎盘屏障仅在胎儿脐血中检测到6-TGN。目前研究显示,母亲暴露于AZA没有增加流产、早产、新生儿低出生体重或先天性畸形风险,但新生儿可能伴贫血[27],产后近10年的随访未发现不良影响。既往指南建议妊娠期用药剂量小于或等于2 mg/kg,但大多数研究没有具体说明在研究人群中使用AZA的平均剂量,也没有关于限制剂量的明确证据,胎儿和母体6-TGN浓度之间存在强相关性[27],妊娠期应注意监测AZA代谢物浓度并遵循当地指导方针。哺乳期使用AZA的产妇母乳中可检测到药物浓度极低且没有发现对婴儿的不良影响,建议用药后等待4 h再哺乳以减少婴儿的暴露。3 282例父亲暴露于AZA后未发现胎儿不良事件增加。
4.5CsA
4.5.1推荐意见 (1)CsA可以在整个妊娠期使用,注意监测母亲血压、肾功能、血糖和药物浓度(GRADE 1B,SOA 100.0%);(2)哺乳期可以使用(GRADE 2C,SOA 99.7%);(3)父亲可以使用(GRADE 1C,SOA 99.3%)。
4.5.2解读 CsA属于钙调磷酸酶抑制剂,通过FKBP结合于钙调磷酸酶,抑制IL-2的释放,全面抑制T淋巴细胞的浸润[28]。关于CsA的安全性研究纳入了401例妊娠期暴露的数据未发现胎儿不良结局增加,但母亲发生高血压、子痫前期和妊娠糖尿病等妊娠期并发症的风险增加,因此用药期间应加强监测。母乳中检测到的CsA浓度很低,且接受哺乳的婴儿血液中CsA浓度低于检测下限,哺乳期用药未发现不良反应,若选择纯母乳喂养需要严密监测婴儿一般情况,必要时监测血清药物浓度。已超过500例父亲暴露于CsA,均未发现胎儿不良事件增加。
4.6TAC
4.6.1推荐意见 (1)TAC可以在整个妊娠期使用,注意监测母亲血压、肾功能、血糖和药物浓度(GRADE 2B,SOA 100.0%);(2)哺乳期可以使用(GRADE 2C,SOA 99.8%);(3)父亲可以使用(GRADE 2C,SOA 99.3%)。
4.6.2解读 TAC同样属于钙调磷酸酶抑制剂。目前有限的证据并未表明自然流产、先天畸形或死胎与妊娠期暴露于TAC之间存在关联。之前发现少量TAC哺乳期暴露的婴儿没有不良影响,新纳入13例哺乳期暴露的婴儿结局也没有不良结局,脐带血和母乳中的TAC浓度较低,母乳喂养婴儿中TAC的相对浓度小于1%,婴儿血液中的TAC水平低于检测限值[29]。≥120例父亲暴露于TAC后未发现胎儿不良事件增加。
4.7CYC
4.7.1推荐意见 (1)CYC已知有致畸性和性腺毒性,只有疾病严重威胁母亲生命或器官功能且无其他药物可选的情况下才考虑使用该药(GRADE 1B,SOA 99.5%);(2)不推荐哺乳期使用该药(GRADE 2C,SOA 100.0%);(3)不推荐父亲使用该药,建议用药前进行精液冷冻保存(GRADE 1C,SOA 99.5%)。
4.7.2解读 CYC是主要作用于S期的细胞周期的非特异性烷化剂,是明确的人类致畸物且对男女均存在性腺毒性。指南共纳入20例孕前[平均(3.7±1.5)年]、妊娠早期暴露于CYC研究提示胎儿流产、先天性畸形、早产风险增加,但未发现对母亲有不良影响,建议只在疾病危及母亲安全时使用。一项病例报告连续4 d检测暴露于CYC的母亲母乳喂养后婴儿血液中CYC相对剂量,第1天为4.7%,第4天降至0.9%,未报道婴儿远期结局[30],该研究证明了CYC进入乳汁量有限,但作为毒性药物应谨慎用于哺乳期。
4.8MMF
4.8.1推荐意见 (1)MMF是妊娠禁用药物,计划妊娠的女性需至少提前6周停药或更换妊娠期相对安全药物(GRADE 1B,SOA 100.0%);(2)服药期间意外妊娠女性应立即停药并进一步咨询近远期风险(GRADE 1B,SOA 100%);(3)不推荐哺乳期使用(GRADE 2C,SOA 99.7%);(4)父亲可以使用(GRADE 2C,SOA 99.3%)。
4.8.2解读 MMF是一种淋巴细胞增殖强效抑制剂,具有明显的致畸性,其导致的典型先天性畸形主要包括唇裂和(或)腭裂、小耳畸形伴耳闭锁、小颌下垂和眼畸形。指南新汇总5项研究共714例妊娠期暴露于MMF的母亲出现351例流产、8例死产和38例先天畸形,而在妊娠前停用MMF 6周以上可显著改善妊娠结局[31]。目前仍没有关于MMF哺乳期暴露的研究。有少数婴儿在母亲MMF治疗期间接受母乳喂养,没有报道任何不良反应。约300例父亲暴露于MMF没有增加胎儿不良结局。
4.9静脉注射IVIG
4.9.1推荐意见 (1)整个妊娠期均可使用IVIG(GRADE 1B,SOA 99.5%);(2)哺乳期可使用(GRADE 2C,SOA 100.0%);(3)目前尚无父亲暴露的证据,但基于母亲使用的安全性,认为父亲也可以使用(GRADE 2C,SOA 99.3%)。
4.9.2解读 IVIG具有免疫替代和免疫调节的双重治疗作用。关于IVIG的研究多侧重于IVIG的治疗效果,而不是安全性,使用IVIG对妊娠的影响与疾病本身相关而非IVIG所特有,认为IVIG在妊娠期使用不会增加因药物引起的不良结局。目前仍无IVIG在哺乳期暴露的相关研究,仅2例母亲IVIG治疗期间检测乳汁成分发现IgG正常或偏高,IgM正常或偏低。目前尚无有关父亲暴露的研究,但基于母亲暴露的安全性认为父亲暴露同样安全。
5 bDMARDs
治疗风湿病的生物制剂通常作为二线用药,常与其他DMARDs联合给药。bDMARDs为重组蛋白,最常见的是针对特定靶标的单克隆抗体IgG1或受体阻断蛋白与IgG1的Fc段相连形成的融合蛋白,bDMARDs存在5种作用机制[32]:抑制TNF、阻断T淋巴细胞共刺激、抑制IL-6受体、耗竭B淋巴细胞、抑制IL-1,代表药物包括TNFi等。目前对bDMARDs的研究有限,分析发现暴露于bDMARDs不增加流产、死产、先天性畸形、早产和新生儿低出生体重的风险。
5.1TNFi
5.1.1推荐意见 (1)使用INF、ADA、GOL在妊娠前或妊娠期治疗无/低活动性疾病时无需更换为胎盘转运率最低的CZP(GRADE 1B,SOA 100.0%);(2)整个妊娠期间均可使用CZP,并且婴儿出生后可正常接种疫苗(GRADE 1B,SOA 100.0%);(3)如果认为母亲在妊娠期疾病活动风险低,建议在20周停用INF,在28周停用ADA和GOL,在32周停用ETA,以便足月婴儿可以正常接种疫苗(GRADE 1B,SOA 99.5%);(4)如果母亲疾病控制需要,INF、ADA、ETA或GOL可以在整个妊娠期持续使用,但婴儿应避免在出生6个月内接种活疫苗(GRADE 1B,SOA 100.0%);(5)如果在妊娠期间停用了TNFi,产后在没有感染或手术并发症的情况下尽快恢复使用以控制疾病发展(GRADE 1C,SOA 100.0%);(6)哺乳期可以使用TNFi(GRADE 1C,SOA 100.0%);(7)父亲可以使用(GRADE 1C,SOA 99.3%)。
5.1.2解读 目前有5种TNFi的生物制剂被批准用于治疗风湿疾病:ETA、INF、ADA、GOL和CZP。TNFi分为单克隆抗体和受体融合蛋白两种,INF、ADA和GOL是针对TNF-α的单克隆抗体IgG1,ETA是IgG1 Fc区与TNF受体连接形成的融合蛋白,而CZP是缺少IgG1 Fc区的抗TNFα抗体的抗原结合片段(Fab′),这些药物具有不同的半衰期、生物利用度和胎盘转移率。结构中包含IgG1 Fc段的TNFi在妊娠16周后能被胎盘转运,因此妊娠16周前使用TNFi理论上是安全的。大部分关于妊娠期暴露于TNFi的研究没有发现早产、流产、低出生体重或先天性畸形的风险增加,少部分结论不一致的研究也被认为不良结局的发生与疾病本身有关,目前证据非常有限,无法排除TNFi对胎儿的不良影响。理论上认为,免疫抑制剂抗体通过胎盘可能导致新生儿或婴儿免疫力降低增加感染风险,不同药物宫内暴露后在婴儿体内清除时间不一致,最长可达12个月。因此根据不同TNFi的胎盘转移率制定了产前停药时间,前提是在母亲妊娠期疾病活动风险低的情况下,目的是使新生儿出生时体内无法检测到TNFi。由于CZP胎盘转移率极低没有限制CZP使用时间。对于严重疾病需要在妊娠期持续使用TNFi的情况下建议婴儿产后6个月避免接种活疫苗。哺乳期暴露于TNFi的研究中发现,部分母乳中可检测到少量CZP,可检测到极少量ETA、ADA和GOL,INF通常检测不到或者低于检测下限。由于每种药物的分子量较大,认为所有TNFi均不会被婴儿吸收。对宫内暴露于TNFi的胎儿进行产后长达5年的随访未发现感染或疫苗接种不良反应等不良结局。对751例父亲暴露于不同TNFi的数据分析未发现其增加胎儿不良事件。
5.2RTX
5.2.1推荐意见 (1)目前没有足够的证据表明RTX可用于妊娠期,建议妊娠期停药(GRADE 2C,SOA 99.3%);(2)需要控制严重疾病且无其他药物可选的情况下可以考虑使用该药(GRADE 2C,SOA 99.7%);(3)如果在妊娠晚期使用RTX控制疾病,婴儿应避免在出生6个月内接种活疫苗(GRADE 2C,SOA 98.7%);(4)有限的证据认为哺乳期可以使用RTX(GRADE 2C,SOA 99.5%);(5)有限的证据认为父亲可以使用(GRADE 2C,SOA 99.3%)。
5.2.2解读 RTX是靶向CD20的单克隆抗体IgG1,在妊娠16周后能通过胎盘。先前指南建议妊娠前停药6个月仅仅是由于研究发现,妊娠中晚期母亲暴露于RTX后婴儿出生后B淋巴细胞含量低,甚至缺乏,没有明确报道RTX的致畸性。目前认为仍然缺乏有力的数据说明妊娠期使用RTX是否导致早产、流产、先天性畸形、低出生体重、先天性畸形,但已有部分妊娠前甚至妊娠早期暴露于RTX的母亲没有发现不良妊娠结局。同时也缺乏证据说明RTX对婴儿免疫系统是否存在影响,建议适当推迟出生后活疫苗接种时间。母乳中检测到的RTX含量低于0.4%[33],且RTX作为高分子蛋白很难被婴儿吸收,目前没有发现哺乳期暴露于RTX后的不良影响,故而支持RTX治疗期间哺乳。父亲暴露于RTX的证据十分有限,目前没有发现胎儿不良事件。
5.3IL-6i
5.3.1推荐意见 (1)目前未发现IL-6i的致畸性,但没有足够的证据表明IL-6i可用于妊娠期,建议妊娠期停药,妊娠期如果暴露于IL-6i可能不会造成严重后果(GRADE 2C,SOA 99.7%);(2)需要控制严重疾病且无其他药物可选的情况下可以考虑使用该药(GRADE 2C,SOA 100.0%);(3)如果在妊娠晚期使用IL-6i控制疾病,婴儿应避免在出生6个月内接种活疫苗(GRADE 2C,SOA 99.3%);(4)有限的证据认为哺乳期可以使用IL-6i(GRADE 2C,SOA 100%);(5)有限的证据认为父亲可以使用(GRADE 2C,SOA 99.3%)。
5.3.2解读 目前用于治疗妊娠期风湿病的IL-6i主要包括托珠单抗(TCZ)和沙利鲁单抗,其中TCZ应用较多。TCZ为单克隆抗体IgG1结构,现认为妊娠早期暴露于TCZ可能不太有害,指南取消了妊娠前停药3个月的建议。目前研究发现,妊娠早期暴露于TCZ的母亲不增加胎儿先天性畸形率,可能导致较高的流产率,对新生儿出生体重和早产的影响暂不明确,但由于大多没有排除母体疾病的混杂因素影响,这些结论仍无法令人信服。目前缺乏有关TCZ宫内暴露对婴儿免疫系统影响的数据,建议在婴儿出生6个月内避免接种活疫苗。母乳中的TCZ浓度在用药后第3天达到峰值,显著低于产妇血清中药物浓度,哺乳期暴露于TCZ的婴儿没有发现不良影响。暂时缺乏母亲暴露于沙利鲁单抗的研究,报道13例女性治疗期间妊娠后7例出现流产,2例父亲暴露后孩子健康出生。2项15例父亲暴露于TCZ的研究没有发现任何与药物相关的影响。
5.4IL-1i
5.4.1推荐意见 (1)目前未发现IL-1i的致畸性,但没有足够的证据表明IL-1i可用于妊娠期,建议妊娠期停药,妊娠期如果暴露于IL-1i可能不会造成严重后果(GRADE 2C,SOA 99.8%);(2)需要控制严重疾病且无其他药物可选的情况下可以考虑使用该药(GRADE 2C,SOA 100.0%);(3)如果在妊娠晚期使用IL-1i控制疾病,婴儿应避免在出生6个月内接种活疫苗(GRADE 2C,SOA 99.3%);(4)有限的证据认为哺乳期可以使用IL-1i(GRADE 2C,SOA 100.0%);(5)有限的证据认为父亲可以使用(GRADE 2C,SOA 99.3%)。
5.4.2解读 目前用于治疗妊娠期风湿病的IL-1i主要包括阿那白滞素(ANA)、卡那单抗(CAN)。ANA是重组人型白细胞介素-1受体拮抗剂(IL-1Ra)无法通过胎盘转运,CAN作为一种针对IL-1的人源化单克隆抗体在妊娠中期后可能通过胎盘。关于妊娠期暴露于ANA的研究十分有限,指南在原有5例患者的基础上新增了43例妊娠期使用ANA治疗期性发烧和严重疾病的母亲,除外2例先天性肾脏异常和2例羊水过少以外,没有发现其他严重后果,并且认为导致胎儿肾脏异常的原因无法排除疾病本身,可以将ANA作为妊娠期周期性发热患者的替代治疗药物。妊娠期暴露于CAN的已知妊娠结局有47例,3例人工流产,9例流产,1例早产,27例为健康新生儿,7例不良结局中3例被认为与CAN暴露有关。12例哺乳期暴露于ANA、4例暴露于CAN的婴儿均没有发现不良影响。一项5例父亲暴露于ANA的研究未发现任何与药物相关的影响。
5.5ABA
5.5.1推荐意见 (1)目前未发现ABA的致畸性,但没有足够的证据表明ABA可用于妊娠期,建议妊娠期停药,妊娠期如果暴露于ABA可能不会造成严重后果(GRADE 2C,SOA 99.3%);(2)需要控制严重疾病且无其他药物可选的情况下可以考虑使用该药(GRADE 2C,SOA 99.3%);(3)如果在妊娠晚期使用ABA控制疾病,婴儿应避免在出生6个月内接种活疫苗(GRADE 2C,SOA 99.3%);(4)有限的证据认为哺乳期可以使用ABA(GRADE 2C,SOA 99.5%);(5)有限的证据认为父亲可以使用(GRADE 2C,SOA 99.3%)。
5.5.2解读 ABA是一种含有IgG1 Fc段的融合蛋白,在妊娠16周后可通过胎盘,目前关于妊娠期使用ABA的研究多联合使用了其他多种药物,包括MTX,未发现暴露于ABA的不良妊娠结局风险增加。研究发现,高流产率和致畸率与ABA不相关[34]。目前关于ABA的建议是在临床评估该药对母亲的益处大于对胎儿的潜在风险的情况下可以选用。母乳中ABA浓度是母亲血清水平的1/200~1/300[35],一个案例报道没有发现母乳暴露的婴儿出现任何不良反应,现认为哺乳期没有其他合适治疗药物选择的情况下可以选用ABA。11例父亲暴露于ABA的妊娠结局为10例健康新生儿和1例选择性终止妊娠。
5.6BEL
5.6.1推荐意见 (1)目前未发现BEL的致畸性,但没有足够的证据表明BEL可用于妊娠期,建议妊娠期停药,妊娠期如果暴露于BEL可能不会造成严重后果(GRADE 2C,SOA 99.3%);(2)需要控制严重疾病且无其他药物可选的情况下可以考虑使用该药(GRADE 2C,SOA 99.5%);(3)如果在妊娠晚期使用BEL控制疾病,婴儿应避免在出生6个月内接种活疫苗(GRADE 2C,SOA 98.8%);(4)有限的证据认为哺乳期可以使用BEL(GRADE 2C,SOA 99.5%);(5)有限的证据认为父亲可以使用(GRADE 2C,SOA 99.3%)。
5.6.2解读 BEL是一种人源化的抑制B淋巴细胞激活因子的单克隆抗体IgG1。一项纳入66例妊娠期暴露BEL的研究发现SLE患者妊娠期使用BEL后流产率与SLE患者的流产率相似[36],BEL可能是SLE患者妊娠期用药的合理选择。母乳中BEL浓度是母亲血清水平的1/200~1/500[37],2例报道未发现母乳暴露的婴儿出现任何不良反应,若在使用BEL期间时对新生儿或早产儿哺乳需谨慎。没有发现父亲暴露于BEL的研究。
5.7IL-17i
5.7.1推荐意见 (1)目前未发现IL-17i的致畸性,但没有足够的证据表明IL-17i可用于妊娠期,建议妊娠期停药,妊娠期如果暴露于IL-17i可能不会造成严重后果(GRADE 2C,SOA 99.3%);(2)需要控制严重疾病时且无其他药物可选的情况下可以考虑使用该药(GRADE 2C,SOA 99.0%);(3)如果在妊娠晚期使用IL-17i控制疾病,婴儿应避免在出生6个月内接种活疫苗(GRADE 2C,SOA 99.3%);(4)有限的证据认为哺乳期可以使用IL-17i(GRADE 2C,SOA 99.5%);(5)有限的证据认为父亲可以使用(GRADE 2C,SOA 99.3%)。
5.7.2解读 IL-17i主要有司库奇尤单抗(SEC)和依奇珠单抗(IXE),由于IL-17i没有广泛应用,先前指南没有纳入推荐。理论上SEC的IgG1结构跟IXE的IgG4结构比更容易通过胎盘。目前报道了妊娠早期244例暴露于SEC和18例暴露于IXE的母亲,没有发现跟这些药物相关的不良反应。哺乳期暴露于IL-17i的证据有限,无法得出确切的结论,可以肯定的是没有报道新的安全性问题。父亲暴露于IL-17i的报道未发现任何与药物相关的影响。
5.8IL-12/23i
5.8.1推荐意见 (1)目前未发现IL-12/23i的致畸性,但没有足够的证据表明IL-12/23i可用于妊娠期,建议妊娠期停药,妊娠期如果暴露于IL-12/23i可能不会造成严重后果(GRADE 2C,SOA 99.3%);(2)需要控制严重疾病且无其他药物可选的情况下可以考虑使用该药(GRADE 2C,SOA 98.8%);(3)如果在妊娠晚期使用IL-12/23i控制疾病,婴儿应避免在出生6个月内接种活疫苗(GRADE 2C,SOA 99.3%);(4)有限的证据认为哺乳期可以使用IL-12/23i(GRADE 2C,SOA 99.5%);(5)有限的证据认为父亲可以使用(GRADE 2C,SOA 99.3%)。
5.8.2解读 乌司奴单抗(UST)是一种全人源“双靶向”拮抗IL-12和IL-23的IgG1单克隆抗体,先前指南同样没有纳入推荐。分析517例妊娠早中期暴露于UST的数据表明,UST暴露的活产、流产和先天性畸形的发生率与普通人群及TNFi暴露的一致。在母乳UST浓度非常低甚至检测不到,母乳喂养的婴儿的吸收可能很少,如果产后需要使用UST治疗不需要停止哺乳,但在哺乳期使用UST需谨慎,特别是早产儿和新生儿。没有发现父亲暴露于IL-12/23i的研究。
5.9阿尼鲁单抗 阿尼鲁单抗是一种针对Ⅰ型干扰素受体亚单位1的全人型单克隆抗体IgG1j,大部分国家没有批准使用,仅在临床试验中报道了20例用药期间意外妊娠的患者,发现妊娠后立即停药,目前没有发现与该药相关的先天性畸形和不良事件。目前没有关于哺乳期暴露的研究,但阿尼鲁单抗作为大分子物质可能母乳中含量非常低,即使进入婴儿体内也很难被吸收。指南对阿尼鲁单抗没有进行推荐。
6 tsDMARDs
6.1推荐意见 (1)没有足够的证据表明Janus激酶抑制剂(JAKi)可用于妊娠期,建议孕前2周停药(GRADE 2C,SOA 99.5%);(2)没有足够的证据表明JAKi可用于哺乳期,鉴于JAKi可能进入母乳中,建议哺乳期禁用(GRADE 2C,SOA 99.5%);(3)有限的证据认为父亲可以使用JAKi (GRADE 2C,SOA 99.3%)。
6.2解读 关于在妊娠期间使用tsDMARD的数据仍然很少,先前指南未做推荐。治疗风湿病的靶向药物包括JAKi和阿普米司特。JAKi包括枸橼酸托法替尼(TOF)、巴瑞替尼(BAR)、乌帕替尼(UPA)。JAKi作为小分子物质理论上可以通过胎盘,半衰期较短(TOF半衰期3 h),但用药后导致的NK细胞和C反应蛋白下降即使停药也需要2周才能恢复。关于妊娠期使用JAKi安全性的研究证据十分有限,不推荐妊娠期使用。目前没有哺乳期使用JAKi的研究,考虑到JAKi理论上可以进入母乳,故不推荐哺乳期使用。目前没有发现妊娠期使用阿普米司特的研究,指南未做推荐。关于父亲暴露于JAKi的证据多源于临床试验,认为父亲暴露JAKi相对安全。
综上所述,2022年BSR指南对孕前、妊娠期和哺乳期及父亲抗风湿药使用推荐重新寻找了大量证据,该指南相对放宽了TNFi抑制剂等生物制剂在妊娠前、妊娠期及哺乳期的使用指征,更新了生物制剂如IL-17i、IL-12/23i和靶向制剂的推荐,补充了更多关于父亲暴露的证据。
