番茄液泡蔗糖转化酶抑制蛋白克隆、生物信息学及表达分析
2024-01-18许洋程远阮美颖王荣青叶青静姚祝平周国治刘乐承万红建
许洋,程远,阮美颖,王荣青,叶青静,姚祝平,周国治,刘乐承,万红建*
(1.长江大学 园艺园林学院,湖北 荆州 434000;2.农产品质量安全危害因子与风险防控国家重点实验室 浙江省农业科学院 蔬菜研究所 中澳作物改良中心,浙江 杭州 310021)
蔗糖转化酶(invertase,INV)是糖代谢的关键酶,可将蔗糖分解为葡萄糖和果糖,在植物的初级代谢、生长发育和响应逆境胁迫等过程中发挥着关键作用[1-2]。蔗糖转化酶依据亚细胞定位,可分为3类:细胞壁转化酶(cell wall invertase,CWIN),液泡转化酶(vacuolar invertase,VIN)和细胞质转化酶(cytoplasmic invertase,CIN)。依据酶催化反应的最适pH值划分,CWIN和VIN同属于酸性转化酶,且在翻译后水平受各自转化酶抑制蛋白的调节。其中,调控VIN转录翻译后活性的抑制子为液泡转化酶抑制因子(vacuolar invertase inhibitor,VIF),调节CWIN表达的为细胞壁转化酶抑制因子(cell wall invertase inhibitor,CWIH)。转化酶抑制因子是一组能通过蛋白质与蛋白质的相互作用而抑制酸性转化酶活性的小多肽[3],且该基因仅存在于表达模式多样的高等植物中[4],在调节蔗糖代谢、调控植物的生长发育方面发挥着重要作用。
转化酶抑制因子的存在已在多种植物中被证实,如烟草[5]、拟南芥[6]、玉米[7]、番茄[8-9]、马铃薯[10]、辣椒[11]、梨[12]、桃[13]和萱草[14]等。转化酶抑制因子是一种小分子蛋白质,分子量为15~23 ku,由4个保守的半胱氨酸残基组成[1,15]。它通过与酸性转化酶相互作用,调控转化酶的活性,在糖信号传递和碳分配方面发挥重要的作用。Wang等[13]通过酵母双杂(yeast two-hybrid,Y2H)和双分子荧光互补(bimolecular fluorescence complementation,Bifc)实验,证明了桃的蔗糖转化酶抑制因子(PpINH1)与液泡转化酶(PpVIN2)存在相互作用,且PpINH1抑制桃果实中VIN的活性,在经过海藻糖处理后,桃果实中PpINH1的表达上调导致了VIN活性的降低,从而减缓了蔗糖分解,提高了果实抗冷的能力;Qin等[16]通过Y2H实验,验证了番茄液泡蔗糖转化酶与液泡蔗糖转化酶抑制蛋白两者之间的互作关系,并证实了液泡蔗糖转化酶抑制蛋白参与蔗糖代谢,影响果实的成熟;Ma等[12]亦在梨中鉴定出了液泡转化酶PbrAc-Inv1与液泡转化酶抑制因子PbrII5,并通过Y2H与Bifc实验证实了PbrII5通过与PbrAc-Inv1相互作用,调控VIN 的活性,从而调控梨果实中糖分的组成等。上述研究表明,蔗糖转化酶抑制因子通过与蔗糖转化酶相互作用,调控蔗糖转化酶的活性,调节植物体内糖分组成,影响果实成熟,提高植株抵御逆境的能力等。
番茄(SolanumlycopersicumL.)属茄科,是水果和蔬菜兼用作物,也是研究肉质果实发育的模式作物[17-18]。在番茄果实发育及植物生长过程中,糖类可为番茄提供甜味,产生膨压,促进细胞膨胀,是果实风味的重要指标,也是其抵御不利环境的重要方式。本研究克隆得到了SlVIF的cDNA与基因序列,利用生物信息学手段对其编码的氨基酸序列及蛋白结构进行预测分析,通过构建进化树发现茄科物种的INH在基序(motif)上的保守性。并利用RNA-seq数据分析了SlVIF的组织特异性表达模式,可为后续深入研究番茄VIF基因的功能提供理论基础。
1 材料与方法
1.1 材料
以种植在浙江省农业科学院蔬菜研究所人工气候室的Alisa为实验材料。试验所用的植物总RNA提取试剂盒为Omega公司的E.Z.N.A®Plant RNA Kit,反转录和胶回收试剂盒为天根公司的FastKing RT Kit(With gDNase)FastKing cDNA 第一链合成试剂盒与Universal DNA Purification Kit通用型DNA纯化回收试剂盒,克隆载体采用全式金公司的pEASY@-Blunt Cloning Kit。
1.2 番茄SlVIF基因的克隆
依据Solyc12g099190从番茄基因组数据库(https://solgenomics.net/)中下载对应的基因序列和CDS序列,利用PCR退火温度计算器设计特异性引物SlVIF(表1),以Alisa的DNA与cDNA为模板,利用KOD OneTMPCR Master Mix进行基因序列与cDNA序列的扩增。反应体系:(1)DNA扩增体系,DNA模板1.5 μL、KOD OneTMPCR Master Mix 25 μL、上下游引物各1.5 μL、ddH2O 20.5 μL;(2)cDNA扩增体系,cDNA模板2 μL、KOD OneTMPCR Master Mix 25 μL、上下游引物各1.5 μL、ddH2O 20 μL。反应程序:95 ℃ 3 min;98 ℃ 10 s、55 ℃ 5 s、68 ℃ 10 s,34个循环;72 ℃ 10 min。用1.2%的琼脂糖进行凝胶电泳。将胶回收得到的SlVIF基因产物与cDNA产物分别与pEASY®-Blunt Cloning Vector进行连接后转化Trans1-T1感受态,将菌液均匀涂布于含有50 mg·mL-1卡那霉素的LB固体培养板上,倒置37 ℃培养过夜,挑取单克隆进行菌液PCR检测,将阳性单菌落送至擎科生物技术有限公司(杭州)进行测序。

表1 SlVIF基因引物信息Table 1 SlVIF gene primer information
1.3 番茄SlVIF基因生物信息学分析/序列特征分析
利用EMBL-EBI在线序列比对工具Needle比对参考序列与擎科测序结果,分析其中差异;使用CSDS2.0绘制SlVIF的基因结构。采用Expasy-ProtParam进行SlVIF蛋白理化性质预测;利用Protscale、DeepTMHMM、SignaIP-6.0预测蛋白的亲疏水性、是否存在跨膜结构和信号肽;采用SOPMA与SWISS-MODEL进行蛋白质的二级和三级结构预测;采用NCBI-CD-search预测蛋白质的保守结构域。
1.4 番茄SlVIF蛋白保守基序与系统发育分析
使用MEGAX软件构建NJ(Neighbor-joining)系统发育树,采用MEME对转化酶抑制蛋白序列特征进行分析,基序数量设为10,并利用TBtools对转化酶抑制蛋白的发育树与保守基序进行可视化。
1.5 番茄SlVIF基因启动子序列分析
使用PlantCARE对SlVIF基因启动子区域(3 000 bp)进行顺式作用元件预测。
1.6 番茄SlVIF的表达量分析
利用从Tomato functional genomics数据库中提取的有关SlVIF在花、果实、根、叶片等器官与组织中的RNA-seq数据来研究该基因的差异表达。使用从Tomato functional genomics中提取的SlVIF基因在多种DC3000菌株处理下不同组织的RPKM值及Tomato Expression Atlas数据库中提取的SlVIF基因在水胁迫下不同组织内的RPKM值来研究该基因在逆境胁迫下的表达模式。采用经log2(RPKM+1)转换的值来生成显示组织特异性表达图谱的热图,基因表达水平的可视化通过TBtools软件完成。
2 结果与分析
2.1 番茄SlVIF基因的克隆
利用SlVIF分别对Alisa的DNA和cDNA进行扩增,扩增结果用每100 mL 12 g的琼脂糖凝胶电泳进行检测,得到两条大于500 bp的特异性条带(图1中a)。切胶回收后与载体连接转化,筛选阳性单克隆并送至公司测序。测序结果显示,两组PCR产物的长度均为528 bp,碱基序列具有一致性,编码175个氨基酸。测序结果与番茄基因组数据库筛选到的序列相似度为99.8%,仅存在一个碱基的差异,造成了单个氨基酸的变异(Asn→His),并且通过多序列比对,发现该基因含有4个保守的半胱氨酸残基位点(图1中b)。GSDS2.0绘制的SlVIF基因结构显示,其不含有内含子和非翻译区域(UTR结构),仅由外显子区域构成(图1中c)。
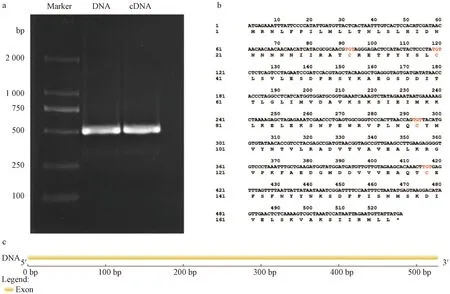
a表示SlVIF基因与cDNA序列PCR扩增产物电泳检测结果;b表示SlVIF核苷酸序列及氨基酸序列全长,其中标红字体为VIF蛋白保守位点;c表示SlVIF基因结构。图1 番茄SlVIF基因克隆Fig.1 Cloning of tomato SlVIF gene
2.2 番茄SlVIF理化性质与蛋白结构分析
对Expasy-ProtParam预测结果分析表明,SlVIF蛋白的理论等电点为5.53,分子量为19.92 ku,负电荷残基(Asp+Glu)总数为23,正电荷残基(Arg+Lys)总数为21,蛋白质的分子式为C881H1423N231O268S12,总平均亲水指数为-0.127,不稳定系数为32.48,说明SlVIF蛋白稳定性好。依据Protscale预测SlVIF蛋白的亲疏水性结果显示,SlVIF蛋白有5个较明显的亲水区,亲水指数最小值位于第21位氨基酸,为-2.578,疏水指数最大值位于第8位氨基酸,为2.456,再结合总平均亲水指数,推测该蛋白表现为亲水性(图2中a)。SlVIF跨膜结构域预测表明其不存在跨膜结构(图2中b)。信号肽预测结果表明,SlVIF蛋白在1~17氨基酸(aa)之间存在一个信号肽(图2中c)。保守结构域为PMEI。二级结构预测结果显示,SlVIF由57.71%的α-螺旋(alpha helix),11.43%的延伸片段(extended strand),1.71%的β-转角(beta turn)以及29.14%的无规则卷曲(random coil)组成(图3中a)。并且通过SWISS-MODEL预测SlVIF蛋白的三级结构,发现该蛋白主要由α-螺旋与无规则卷曲构成(图3中b),与二级结果预测一致。经过保守结构域分析发现,番茄SlVIF蛋白的特异性保守结构域含有CIF_like(30~174 aa)与PMEI(26~170 aa)特异性保守结构域,及PHE_inhib(1~175 aa)与PMEI(26~167 aa)非特异性保守结构域,属于PMEI家族(图4)。
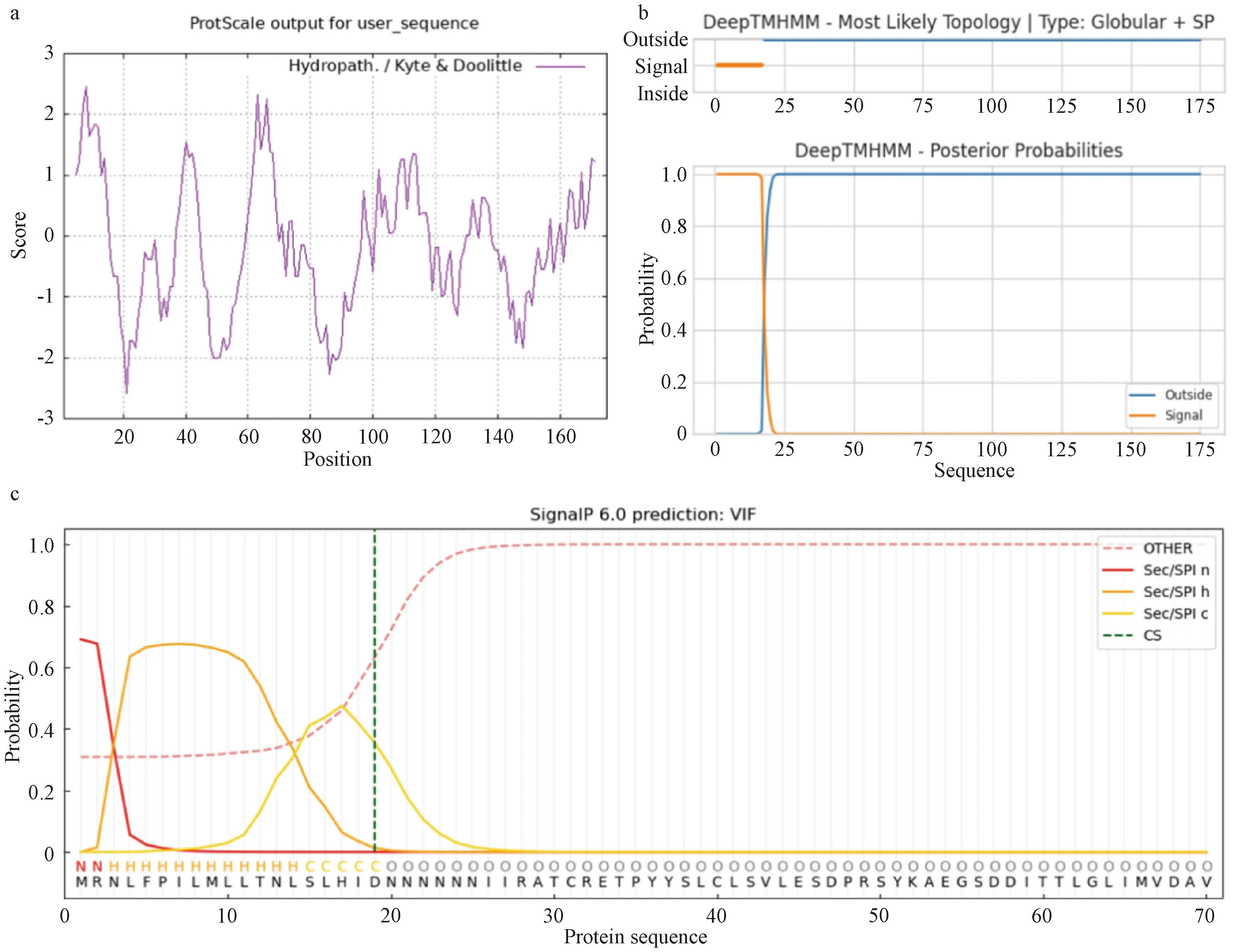
a表示亲疏水性预测,b表示跨膜结构域预测,c表示信号肽预测。图2 SlVIF蛋白序列分析Fig.2 SlVIF protein sequence analysis

图4 SlVIF蛋白保守结构域预测Fig.4 Prediction of the conservative domain of SlVIF protein
2.3 番茄SlVIF蛋白保守基序与系统发育分析
通过查找文献及BlastP氨基酸序列比对,从NCBI、Solanaceae Genomics Network数据库中下载转化酶抑制蛋白的同源序列,并通过MEGA X构建系统发育树。如图5所示,转化酶抑制蛋白被划分为4个亚组,番茄转化酶抑制蛋白全部被划分在第一亚组(黄色区域),且茄科物种转化酶抑制蛋白均被划分在这一亚组,在这一亚组内番茄VIF与CWIH(Solyc12g099200与Solyc12g099210)被划分在两组(group a与group b)内。在group a内,XP_016474343[19]与AIT42248[20]在已有的研究中被证实为液泡转化酶抑制蛋白,b组中CAA73333[21]、Solyc12g099200与Solyc12g099210[16]被注册或鉴定为细胞壁转化酶抑制蛋白。故推测group a组的基因为VIF基因,b组为细胞壁转化酶抑制蛋白基因,液泡和细胞壁转化酶抑制蛋白被划分为两个分支。结合保守基序分析,亚组Ⅰ中除SlVIF、AIT42248与茶的两个INH基因外,都具有相同的保守基序,且氨基酸长度基本相等。
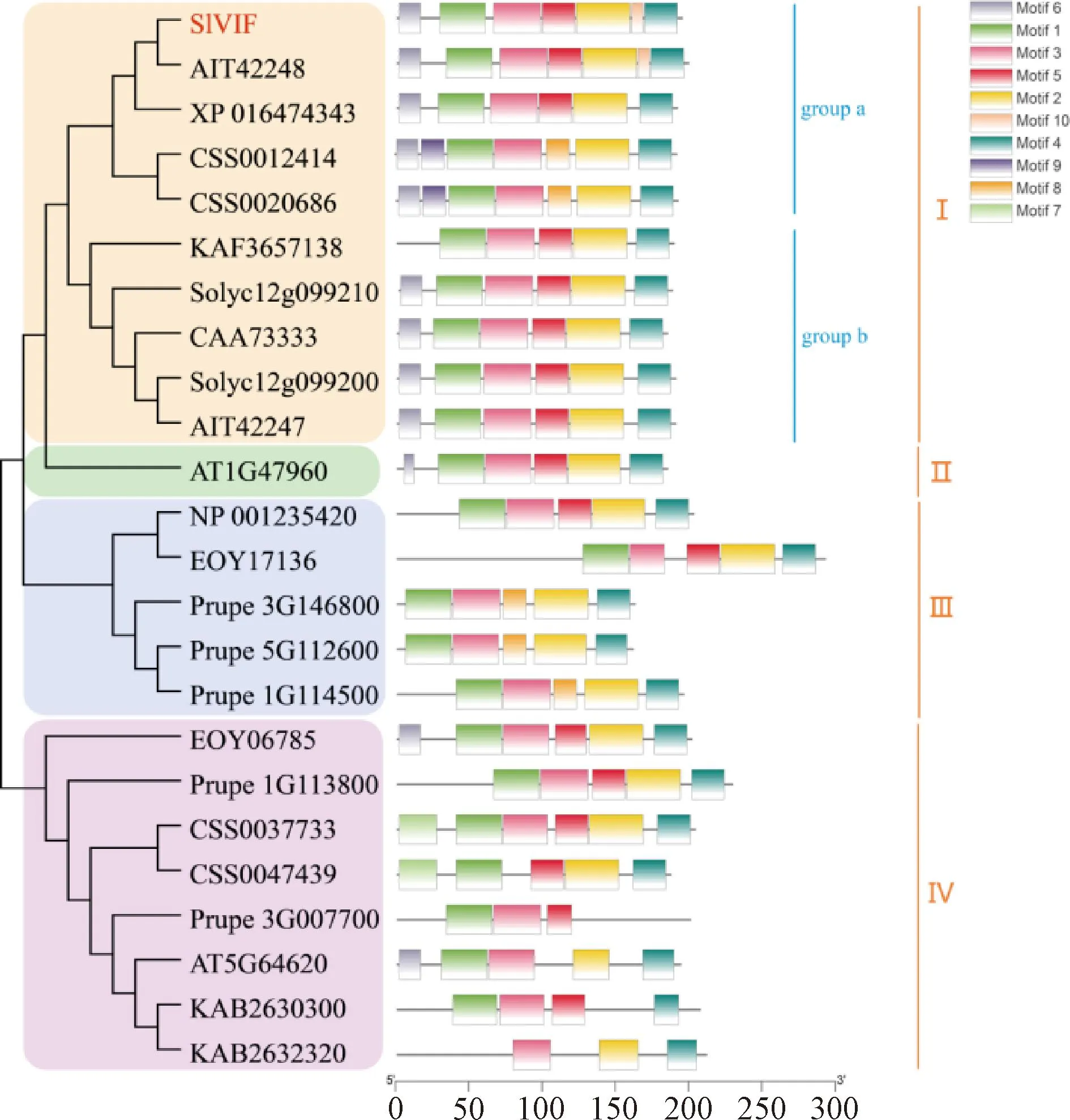
番茄:Solyc12g099200,Solyc12g099210[16];马铃薯:AIT42248,AIT42247[20];烟草:XP_016474343[19],CAA73333[14];辣椒:KAF3657138;拟南芥:AT1G47960,AT5G64620[20];茶:CSS0012414,CSS0020686,CSS0037733,CSS0047439[22];桃:Prupe_5G112600,Prupe_3G146800,Prupe_1G114500,Prupe_1G113800,Prupe_3G007700[13];梨:KAB2630300,KAB2632320[23];可可:EOY17136,EOY06785[24]。图5 植物液泡蔗糖转化酶抑制蛋白系统发育关系及保守基序分析Fig.5 Phylogenetic relationship and conserved motif analysis of plant vacuolar sucrose invertase inhibitory protein system
2.4 番茄SlVIF基因启动子序列分析
启动子区域顺式作用元件预测结果显示,在该区域内,存在多个与激素、非生物胁迫相关的作用元件,包括脱落酸(ABRE)、茉莉酸(CGTCA-motif、TGACG-motif)、乙烯(ERE)、赤霉素(GARE-motif、P-box)、生长素(TCA-element、TGA-element)、干旱(MYB、MYC)等。此外,还发现了与光响应相关的元件,有AAAC-motif、AT1-motif、Box 4、chs-CMA1a、chs-CMA2a、G-Box、G-box。结果表明,该启动子可能参与光、干旱胁迫、激素等诱导。
2.5 番茄SlVIF基因的表达
2.5.1SlVIF基因在不同组织与器官中的表达模式分析
RNA-seq数据分析结果显示(图6),SlVIF基因在Heinz(Solanumlycopersicum)与LA1589 (Solanumpimpinellifolium)番茄不同器官中的表达存在明显差异,在所选的器官中,SlVIF在Heniz番茄中只在根部有高水平的表达,在其他部位表达水平较低(图6中a)。而在LA1589中,随着果实的生长发育,SlVIF的表达量在持续上调,在成熟果实中表达水平达到最高;此外,SlVIF在整个根部也有较高的表达水平,但其在叶片、下胚轴、子叶、幼花芽中的表达量相对较低(图6中b)。
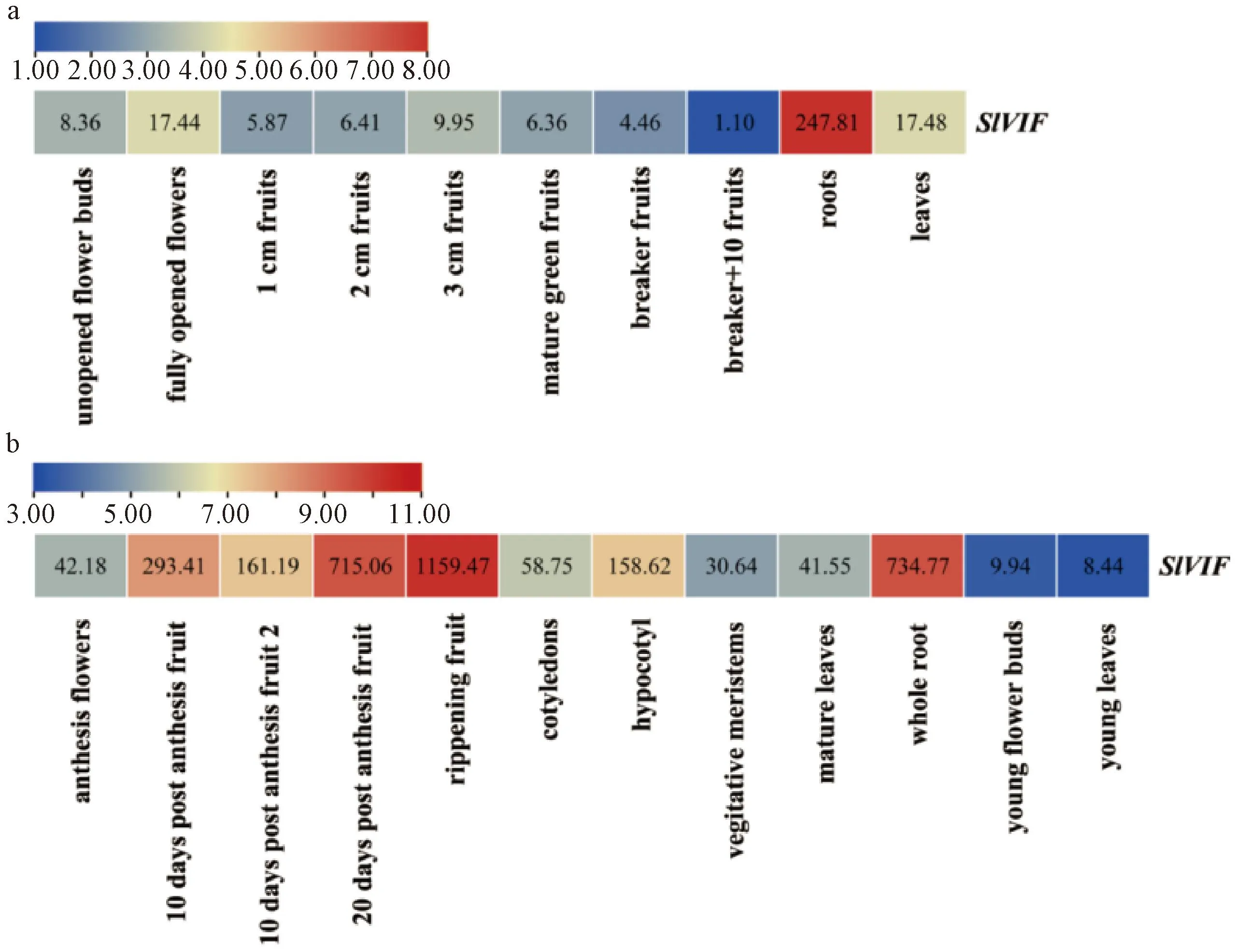
a表示 Heinz番茄,b表示 LA1589番茄。图6 番茄不同组织与器官中SlVIF基因的表达模式热图Fig.6 Heat map of the expression pattern of SlVIF gene in different tissues and organs of tomato
2.5.2SlVIF基因在不同非生物胁迫下的表达模式分析
SlVIF基因在经过水分胁迫处理后,在M82番茄不同组织中的表达水平存在差异(图7中a)。随着土壤中含水量的降低,其在未成熟果实与成熟果实中相同部位转录水平存在一定的差异。在未成熟果实中,SlVIF在隔膜、胎座、轴柱中的表达量呈现先下调后上调的趋势,在成熟果实中,SlVIF在果皮、隔膜与叶片中的表达水平变化不明显,而在小柱和种子中表现出表达量逐步上调的趋势。使用多种DC3000菌株处理Rio Grande番茄的叶片,RNA-seq数据显示,SlVIF基因在相同处理的不同时间段,表达水平未呈现显著性变化,但总体随着处理时间的增加,SlVIF基因的表达水平呈现上调的趋势(图7中b)。
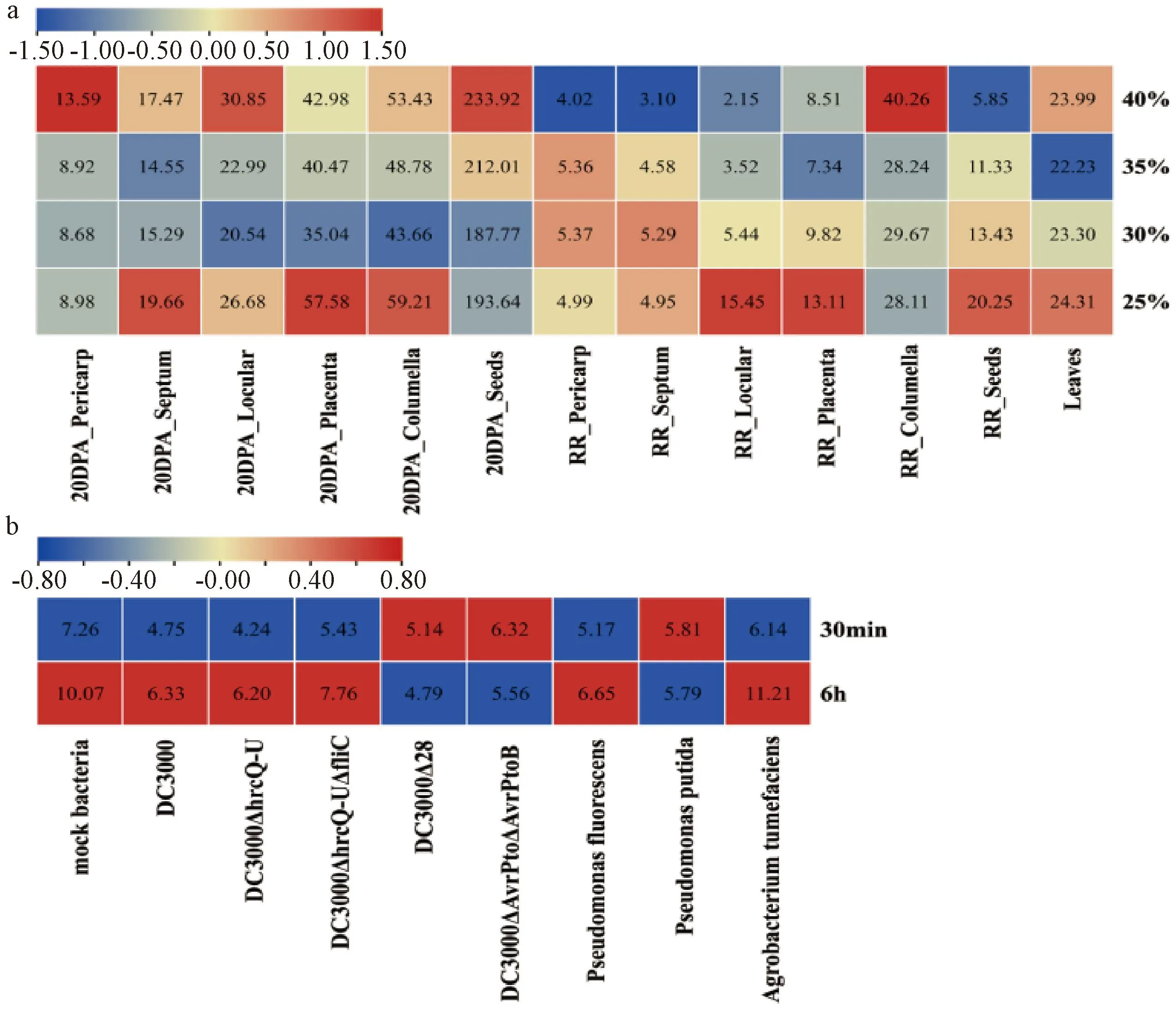
a表示M82番茄,水分胁迫,40%、35%、30%、25%表示土壤含水量,20DPA表示果实生长天数,RR表示成熟果实(红熟);b表示Rio Grande番茄,不同DC3000菌株胁迫。图7 SlVIF基因在不同非生物胁迫下的表达模式热图Fig.7 Heat map of expression patterns of SlVIF gene under different abiotic stresses
3 讨论
液泡转化酶抑制因子通过在翻译后水平与液泡转化酶相互作用,来调控液泡转化酶的活性,这在调节植物生长发育和响应逆境胁迫[22,25-26]等方面发挥着重要作用。液泡转化酶是蔗糖转化酶的重要组成部分,可在液泡内将蔗糖不可逆地水解为己糖,参与果实内蔗糖代谢[27-28]、介导细胞伸长[29-30]、响应非生物胁迫[31]等。并且对SlVIF基因上游启动子区域3 000 bp的序列进行顺式作用元件预测,结果表明,该序列存在多个与激素、干旱、光等相关的元件,故推测该基因具有抵抗不利环境因素,参与调节植物逆境胁迫的能力。Chen等[26]在一个对脱落酸敏感的保卫细胞特异性启动子(AtRab18)的控制下用烟草液泡转化酶抑制因子的同源物(Nt-inhh)转化拟南芥,发现烟草VIF在保卫细胞中异位表达增强拟南芥的抗旱性。
本研究从番茄中克隆出的SlVIF基因长为528 bp,共编码了175个氨基酸,不存在内含子区域。通过Blastp,获得不同物种的同源序列,发现蔗糖转化酶抑制因子因调控对象的不同,在系统发育树中存在不同的分支,且茄科物种中的转化酶抑制因子亲缘关系较近,被划分在同一亚组内,具有相同的保守基序。Wan等[4]和Wang等[13]通过构建系统发育树,推测VIF仅存在于维管束植物中,并且Wang等[13]在被子植物的祖先Amborellatrichopoda中没有预测到VIF基因,VIF的数量在不同的物种中存在差异。现已在番茄中鉴定了一个液泡转化酶抑制蛋白和两个细胞壁转化酶抑制蛋白[16,4]。He等[22]在茶树中共鉴定了4个INH(CsInvInh),在冷胁迫下这些INHs通过抑制酸性转化酶的活性参与茶树生长发育与冷响应。
本研究对SlVIF在组织与器官中的表达分析发现,该基因在不同的番茄(Heinz和LA1589)中的表达模式存在差异。在栽培番茄Heinz中,SlVIF在根部有一个高水平的表达;在野生番茄LA1589中,SlVIF在整个植株的不同部位都有表达,尤其是在果实发育的后期和根部有高水平的表达;在栽培番茄Ailsa Craig中,SlVIF在成熟果实中有相对高的表达,而在根组织中表达水平很低[16]。这或许与选材、苗龄、植物生长状态等有关。SlVIF基因可能通过介导蔗糖代谢,影响果实成熟或根系的生长等。苏涛等[21]在杨树中鉴定并证实了PtC/VIF1为β-果糖苷酶抑制子(转化酶抑制因子),发现其在根部有一个高水平的表达。Mollah等[32]发现液泡转化酶抑制剂 PpINHa 和 PpINH3 对桃果实中糖分积累的作用是相反的,但过表达这两个基因,与果实糖代谢与转运相关的基因都会受到影响。此外,RNA测序(RNA-seq)数据显示,SlVIF的表达受到水分胁迫与细菌的诱导,SlVIF在不同的组织中呈现差异表达,但整体随着水分含量的降低与菌株胁迫时间的延长,表达量呈上调的趋势。这与顺式作用元件预测结果一致。
蔗糖转化酶抑制蛋白通过调节酸性转化酶的活性来调控蔗糖代谢,使其维持稳态。在冷藏期间,过表达对低温糖化敏感的马铃薯块茎中的VIF(INH2)基因,可导致酸性转化酶活性的降低与还原糖积累的减少,而在抗低温糖化的品系中抑制INH2的表达可增加其对低温糖化的敏感性[33]。ShINH1与ShINH2可在甘蔗蔗糖积累中发挥调节作用,重组ShINH1可有效抑制酸性转化酶的活性,是控制甘蔗收获前后蔗糖变质的候选药物[34]。此外,VIF的表达受环境和发育信号的调控[35],通过调节植物体内的糖分积累来影响植物的生长发育。故对VIF进行深入研究,有助于了解植物的生长发育,调控果实品质,提高作物抵御不良环境的能力。
