基于计算机断层扫描图像的房颤患者左心耳封堵前后的血流模拟
2024-01-18徐庆虎张天逸程云章
徐庆虎,张天逸,程云章△
(1.上海理工大学 健康科学与工程学院,上海 200093;2.上海介入医疗器械工程技术研究中心,上海 200093)
0 引言
房颤是临床上最常见的心律失常疾病,通常由肺静脉根部的不规则电脉冲触发,致使左心房以一种快速无序的方式收缩,而该异常收缩模式会促进左心耳(left atrial appendage, LAA)内部血栓的形成[1-2],容易引起系统性栓塞事件。调查数据显示,全世界房颤患者已超过3 300万[3],占因心律失常住院人数的三分之一,并且随着人口老龄化,房颤患者住院人数增长了60%[4]。房颤患者的中风风险是健康人群的5倍,其中15%~18%的中风与房颤有关[1-2]。
LAA是从左心房伸出的狭长管状盲端,其内壁充满了凹凸不平的梳状肌,将内部分成了几个小叶。左心耳在正常窦性心率下,可缓解左心房的压力、辅助左心室充盈。但在房颤期间,左心耳的主动收缩能力下降,内部血流状态紊乱,血液流速减慢甚至停滞,易形成血栓,导致卒中的发生[5]。据估计,左心耳是90%房颤导致的缺血性卒中事件的血栓来源,被称为“人类最致命的附属结构”[6]。左心耳的形态具有很强的特异性,通常根据其形状分为四种不同的类型:最常见的是“鸡翅”形态,其次是“仙人掌”、“风袋”和“花椰菜”[5]。
房颤卒中的高致死率和引起的一系列并发症,严重危害人类的健康生活水平,因此,对高危房颤患者进行抗凝等干预治疗十分必要。目前,预防房颤相关卒中的主要治疗手段包括: 口服抗凝药物(例如华法林)[7]、左心耳手术排除[8]、左心耳封堵[9-10]。左心耳封堵术(left atrial appendage occlusion, LAAO)作为口服抗凝药的有效替代手段,广泛应用于大型随机临床实验中[11-12]。
众所周知,血流动力学因素,如流速、壁面剪切应力等都会导致左心房与左心耳内血栓形成[13]。然而在临床实践中,经食管超声心动图(transoesophageal echocardiography, TEE)等很难得到流场内部的流动状况,且参数信息少,无法满足基本分析需求。而计算流体力学(computational fluid dynamics, CFD)作为一种非侵入式手段,可以模拟左心房内部流场流线、涡流等信息,为预测血栓形成提供有效信息[14-16]。
由于目前分析左心耳封堵前后的血流变化实验以及研究的血流动力学参数少,本研究使用CFD对患者左心耳封堵术前后的左心房模型进行模拟,对比患者手术前后血流动力学的变化,针对血栓形成因素,研究血流速度、时均壁面剪切应力(time-average wall shear stress, TAWSS)、震荡剪切指数(oscillation shear index, OSI)等相关指标的变化,探讨左心耳封堵术对血流动力学以及血栓形成的影响。
2 资料与方法
2.1 图像处理
本研究图像为上海市复旦大学附属中山医院的一名非瓣膜性房颤成年患者的左心耳封堵术前后的心脏计算机断层扫描(computed tomography, CT)图像。扫描范围为颈部到腰部,平面分辨率为512×512,共640张切片,图片皆以DICOM格式保存。图1高亮部分即为本研究的左心房部位。使用Mimics 21.0从CT图像中构建患者特异性左心房几何结构,再将模型导入3-Matic进行修复、分割、平滑、细化等操作,然后以STL格式储存,患者封堵术前后模型见图2。
2.2 网格划分
为建立CFD模型,本研究使用Ansys ICEM CFD(Ansys,Inc.)对患者的三维解剖模型进行网格划分,使用四面体和棱柱体单元的组合,在左心耳区域使用较小的四面体单元,并且在心房壁附近创建了5层非结构化四面体网格的棱柱层。网格无关性验证后,患者手术前后模型的最终网格元素数量分别为1 376 250、1 121 943。
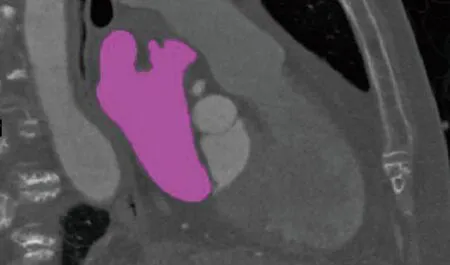
图1 人体心脏二维CT图

图2 封堵术前后模型
2.3 边界条件和血流动力学参数
模拟由Ansys Fluent 18.0(Ansys,Inc.,USA)进行,模拟计算时使用的基本方程是Navier-Stokes公式。使用Navier-Stokes和连续性方程对血流进行建模:
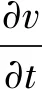
(1)
∇·v=0
(2)
血流被设定为不可压缩的牛顿流体,血液粘度μ=0.003 5 Pa·s,血液密度ρ=1 060 kg/m3,v是速度矢量,p是压力。质量和动量守恒方程的残差低于0.000 01被认为是绝对收敛标准。血液速度v取0.4 m/s,血管直径d取0.005 m,根据雷诺数的计算方法,得到雷诺数为606,远低于2 200,选择层流模型。当房颤发生时,左心房和左心耳的收缩性降低,导致左心房壁僵硬,阻碍其正常收缩,因此,对左心房壁面施加刚性壁和无滑移条件,模拟最严重的房颤情况[17]。
在四个肺静脉(pulmonary valve, PV)口处施加相同的速度波形作为入口,将二尖瓣(mitral valve, MV)设置为压力出口。对于入口,在心房舒张、收缩时期应用时变血流函数[18](见图3)。考虑心动周期中瓣膜的关闭和打开,将瞬时压力出口条件分配给MV孔口。在心房收缩期,施加等于零的恒定压力,设置为开放边界条件,模拟二尖瓣打开,而在心房舒张期,施加高压力[18](见图4),模拟二尖瓣关闭。心房收缩期和舒张期分别持续0.44和0.26 s。考虑在四个完整的心动周期内进行瞬态模拟,每个心动周期持续时间为0.7 s,以使血流充分发展,以0.001 s的时间步长离散0.7 s的整个心动周期进行数值模拟,并将最后一个周期作为输出。
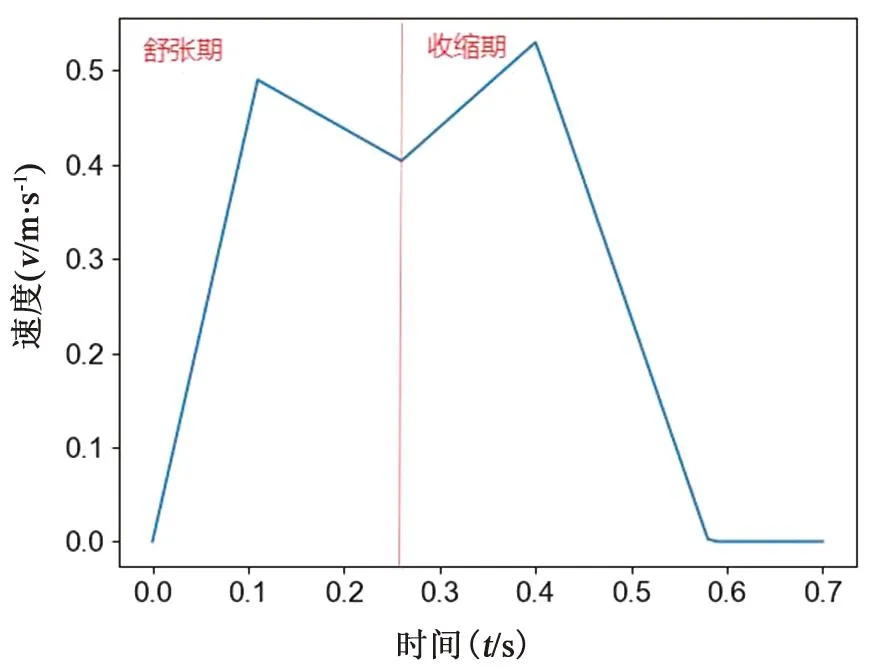
图3 时变血流函数
此外,比较患者在左心耳封堵前后的血流动力学参数变化,如流线、血流速度、时均壁面剪切应力等与血栓形成有关的参数。壁面剪切应力是指单位面积内切向血管/心内表面的血液所施加的力,时均壁面剪切应力指标由壁剪切应力得出,表示整个心动周期中左心房壁剪切应力的机械生物学效应,与血瘀和较高的凝血风险有关。低时均壁面剪切应力表示低流速,这与血栓形成有关[19]。震荡剪切指数是一个无量纲参数,也被证明可以成功识别动脉粥样硬化区域。震荡剪切指数通过将壁面剪切应力平均值与其大小进行比较来捕捉大小和方向上的流动震荡[20]。时均壁面剪切应力(TAWSS)和震荡剪切指数(OSI)的计算如下:
(3)
(4)
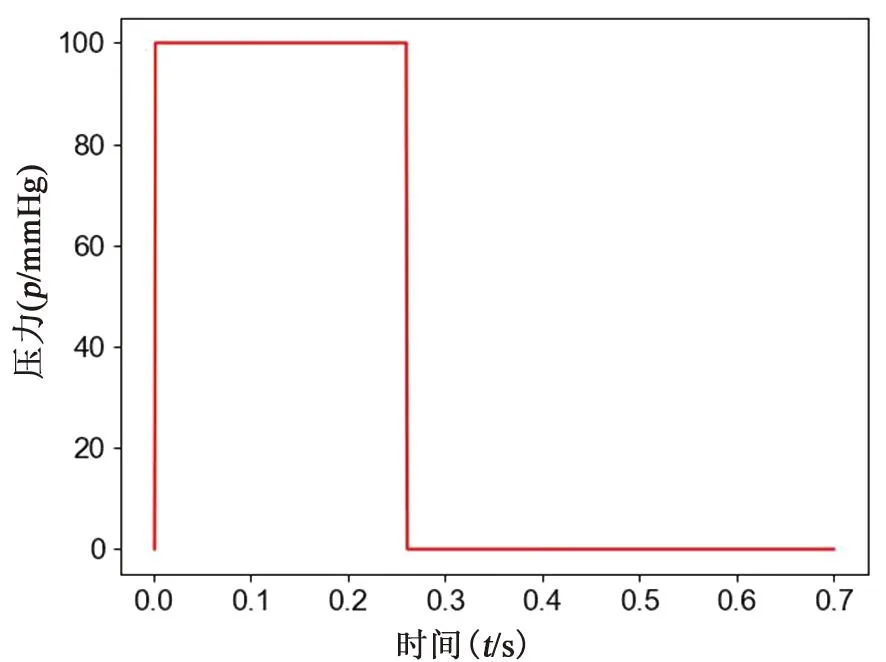
图4 二尖瓣压力出口
3 结果
已知速度大小、流线、时均壁面剪切应力、震荡剪切指数等参数与血瘀和血栓的形成有关。本研究比较患者在左心耳封堵前后两个时间点(0.1, 0.4 s)的流线图,0.2 m/s的等表面速度、时均壁面剪切应力和震荡剪切指数图。患者在左心耳封堵术前后的流场变化见图5。
3.1 血流速度
模拟流动的速度流线可直观地分析左心房的血液流动状况。血流速度低于0.2 m/s与左心房内血管栓塞事件的发生率较高有关[21]。为了比较血流速度,本研究以两个特定时间点下的流动模式差异(舒张期:t=0.1 s, 收缩期:t=0.4 s),分析患者的血流流速状态。患者在左心耳封堵术前后的流场数据数值见表1。
由图5可知,左心耳的速度总是明显低于左心房,并且左心耳内血流速度从孔口到尖端不断减小,从而使左心耳内部血流更容易出现滞淤,增加血栓形成风险。左心耳封堵前后在收缩期和舒张期时的血流流线图显示,与左心耳封堵术后相比,术前明显表现出更加复杂、无序的流线状态,尤其是左心耳内部,流线更加紊乱且流速几乎停滞。0.2 m/s的等表面速度图显示,舒张期时左心耳内部的血液流速大都低于左心耳孔口的流速(0.2 m/s),尽管收缩期提高了左心耳内部的流速,但左心耳的大部分区域,速度仍仅为0.2 m/s或更低,增加了血栓形成的风险。
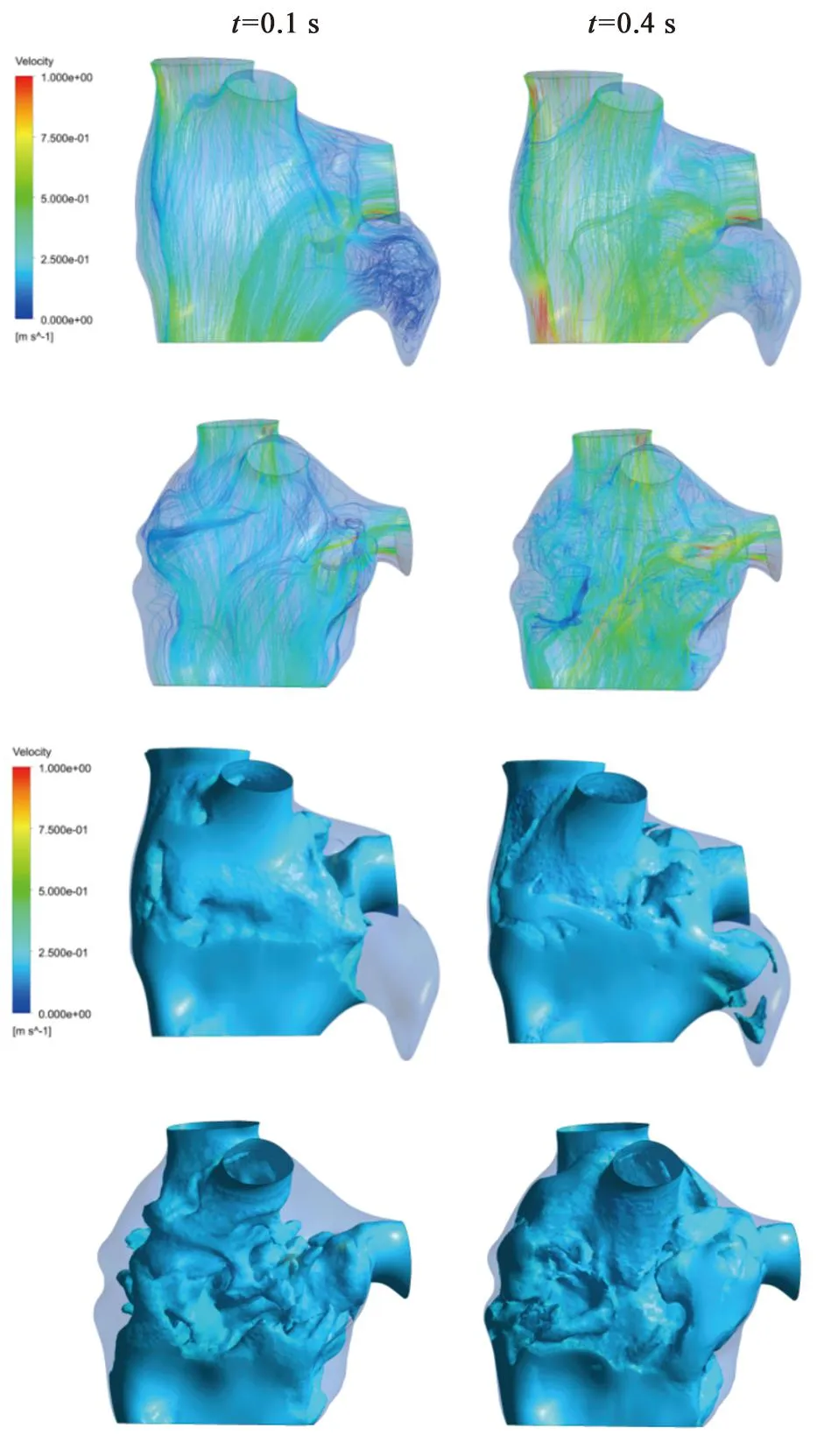
图5 0.1和0.4 s时左心房的速度流线图和速度等值面图
表1也显示了相同的特征,与封堵前相比,无论是收缩期还是舒张期,患者整体的低流速区域虽然有所上升,但术后左心房的最大血流速度都得到了一定的提高。并且与患者术前相比,患者心房内低流速区域(低于0.1 m/s)体积得到了一定的下降,患者心房收缩期时的低流速区域得到了进一步改善。术后低流速区域大多分布在近心房壁面处,与术前相近,左心耳是血栓形成风险最高的区域。
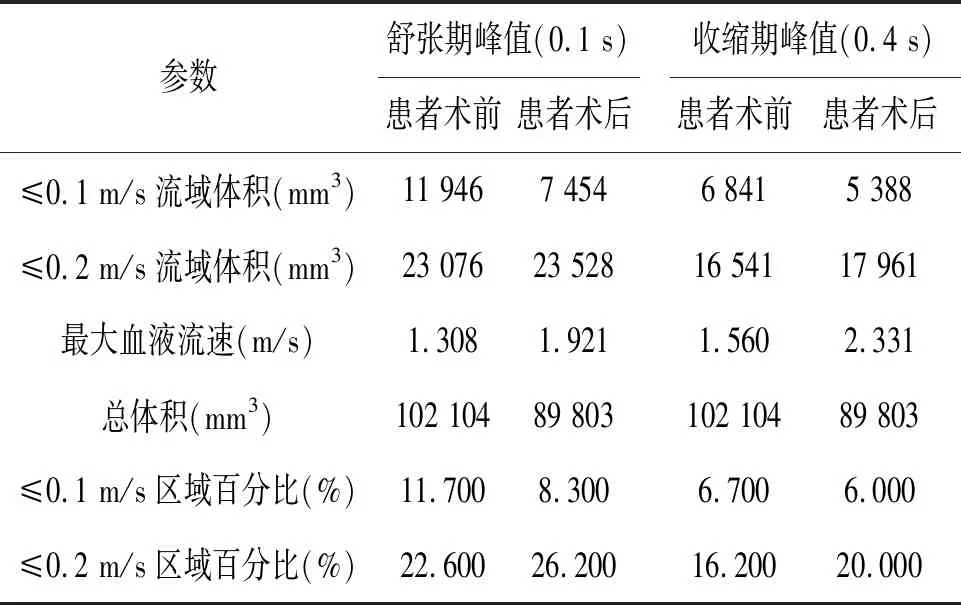
表1 左心耳封堵前后血液流速
3.2 时均壁面剪切应力
时均壁面剪切应力表示心房壁面在一个心动周期内收到的平均剪切应力,壁剪切应力与血流流速成正比,低时均壁面剪切应力会造成较高的血栓风险,图6为时均壁面剪切应力的分布。由于流速增加,高时均壁面剪切应力均分布在肺静脉入口或心房壁面内陷部位。左心耳区域的时均壁面剪切应力远小于心房壁面,越靠近尖端部位,时均壁面剪切应力值越低,越容易形成血栓。与左心耳封堵前相比,时均壁面剪切应力在左心房壁面的分布大体相似,患者心房壁面上时均壁面剪切应力最小为0.067 9 Pa,术后,患者的时均壁面剪切应力得到一定改善,提高到0.245 Pa。
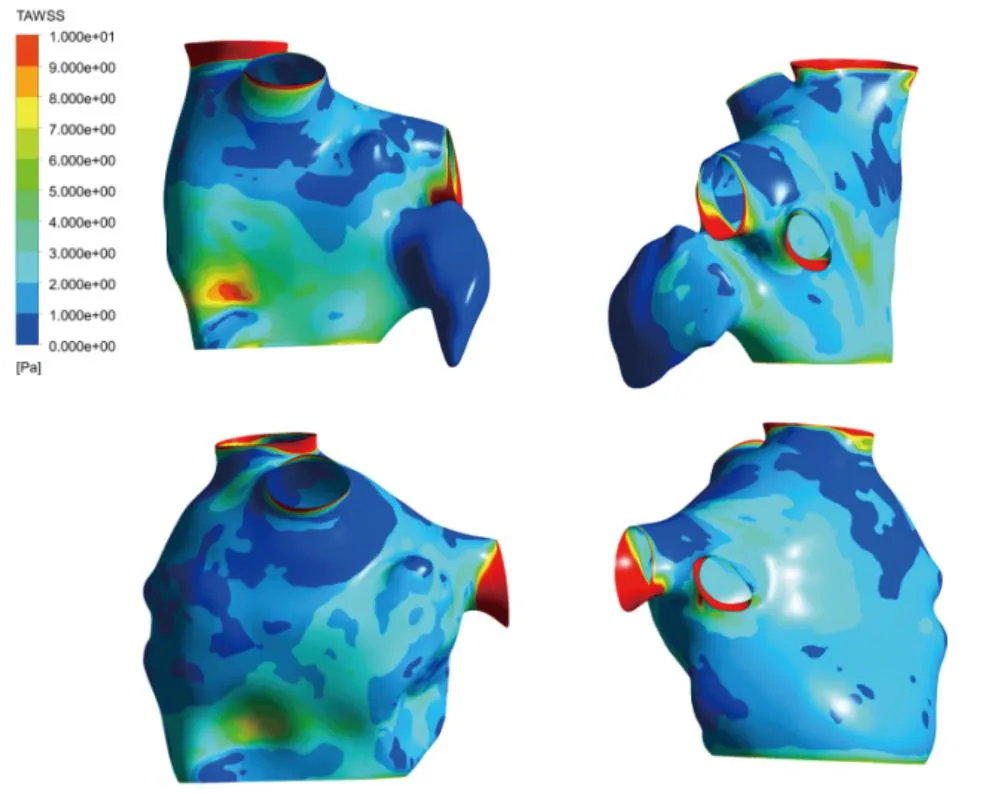
图6 时均壁面剪切应力分布图
3.3 震荡剪切指数
震荡剪切指数表征血流流动方向和强度的变化特征,反应血流流动的震荡水平。震荡剪切指数的分布见图7。可知高震荡剪切指数基本都分布在左心耳、左心耳口和肺静脉入口处,说明左心耳口和左心耳内的血流更加紊乱,受交变方向的剪切应力更加剧烈。并且与左心耳封堵前相比,术后心房壁面的震荡剪切指数强度有一定程度的下降,患者心房壁面的震荡剪切指数从0.494下降到了0.482。同样,高震荡剪切指数也会增加患者的血栓形成风险。
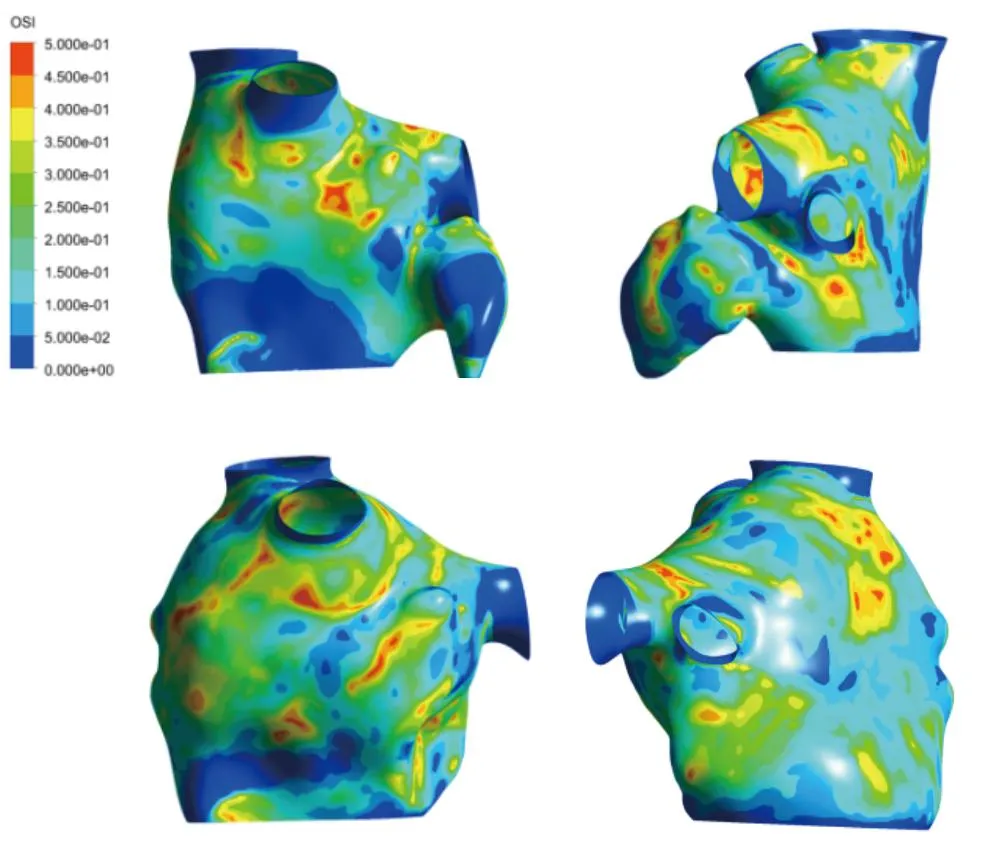
图7 震荡剪切指数分布图
4 讨论
本研究结合患者的CT图像,建立左心耳封堵术前后的左心房流体力学模型,包括在四个肺静脉和二尖瓣处适当应用流动边界条件,探讨手术前后的血流动力学参数差异,评估左心房血栓形成的风险。
通常情况下,左心耳的血流速度明显低于左心房其他部位,而左心耳远端的血流速度幅度约为0 m/s,近乎停滞,导致血栓形成风险增加[23-24]。在此基础上,利用时均壁面剪切应力和震荡剪切指数进一步评估左心房血栓风险。低时均壁面剪切应力、高震荡剪切指数区域基本是血栓形成的高发部位,表明左心耳是左心房中最易形成血栓的区域[17]。与左心耳封堵前相比,左心耳封堵术后患者心房内血流流动似乎更具有组织性,流速也得到一定的提高。之前在左心耳封堵前后血流动力学变化的研究,只涉及流速、涡流等参数的差异,并未比较与血栓形成有关的其他因素[25]。本研究首次提出比较患者在左心耳封堵前后时均壁面剪切应力、震荡剪切指数参数的差异,验证左心耳封堵术的安全性和有效性。
本研究采用数值模拟的方法验证左心耳封堵术的有效性。在这项特定患者的研究中,入口和出口的血流边界条件并非直接从患者特定数据中提取,而是引用了其他患者的特异性边界条件。患者个性化的边界条件可能会提供更加真实的流动情况。
为模拟最严重的房颤情况,本研究将所有心房壁设为刚性壁,未模拟心动周期中真实的心房收缩和运动。尽管刚性壁并不能准确地反映心房内血流状况,但和最严重的房颤情况(如慢性房颤)大体相似,Jorge等[20]已验证了刚性壁假设的合理性。
数值模拟过程中未使用湍流模型,但在左心房的特定区域,存在一定的过渡流。本研究在整个流体域和整个循环时间内使用层流模拟可显著简化计算量,并仍可以直接分析左心耳封堵前后的血流动力学参数差异。
5 结论
本研究使用左心房和左心耳的CT图像,进行了左心耳封堵效果的临床相关计算流体力学模拟研究,对比了在心房收缩期和舒张期速度峰值下的流动特征,如速度、流线、时均壁面剪切应力和震荡剪切指数等与血栓形成有关的因素。结果表明,左心耳封堵术对血流速度和路径有显著影响,可提高血流速度、改善心房内紊乱的血流状态。根据时均壁面剪切应力和震荡剪切指数分布,左心耳作为血栓形成的最危险部位,左心耳封堵术可有效避免血液在左心耳的滞留,改善整体心房的时均壁面剪切应力和震荡剪切指数的分布,降低患者血栓形成的风险。
