酿酒酵母发酵降解银杏叶多糖组分分析及活性研究
2024-01-17刘苗苗庞晓婷张如意
贺 莹, 刘苗苗, 庞晓婷, 张如意
(吕梁学院生命科学系,山西吕梁 033000)
银杏树一般是人工栽培的, 栽培地遍布全国各地。 银杏叶可以入药,能促进血液循环,消除充血,缓解经络痛、哮喘,清除混浊,减少脂质,减缓胸痛和心痛(李春艳,2011)。银杏叶的脂溶性提取物在食品和医药行业已经有了较广泛的应用,但开发和应用水溶性提取物的研究还很少(Liu,2021)。本研究以新鲜银杏叶打汁接种酿酒酵母菌后置于摇床发酵降解, 为银杏叶多糖的开发利用提供基础。
目前, 对于银杏叶多糖的活性研究主要集中在抗肿瘤和免疫调节方面(Fang,2020),如侯华新等(2005)研究了银杏叶多糖的辅助抗肿瘤作用。各实验室对银杏叶多糖的类型和银杏叶多糖的单糖组成的研究结果差异很大; 有些试验研究对银杏叶多糖进行了预分析, 但没有分析出多糖的完整初级结构,也没有进行结构和构象研究。利用微生物发酵降解后再提取的方法较少, 刘艳芳(2020)采用酿酒酵母发酵的方法对灵芝胞外多糖进行了降解,并对其产物在表观黏度、分子质量、多糖得率和含量及单糖组成和生物活性等方面进行了系统比较和分析。 李万丛(2019)以新鲜人参为原料, 经酿酒酵母CCTCC M 2016373 发酵后,采用水提醇沉法及Sevage 法脱蛋白获得发酵后的人参粗多糖,包括未发酵多糖、发酵多糖和菌多糖3 种组分, 采用化学方法测定粗多糖各组分的中性糖、糖醛酸、蛋白质含量,对粗多糖的总抗氧化能力、 羟自由基清除能力和超氧阴离子自由基清除能力进行了比较。
本研究通过酿酒酵母发酵银杏叶多糖,其由水提醇沉法制备,用高效液相色谱法测定发酵不同时期银杏叶多糖的单糖组成,对多糖中的单糖种类进行鉴定,并计算其摩尔百分比。 通过测定抑菌圈大小来研究酿酒酵母发酵降解后的银杏叶多糖的抑菌性。 采用邻苯三酚法和Fenton 法进行酿酒酵母发酵降解后银杏叶多糖的抗氧化性的试验。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料 新鲜银杏叶, 大明湖边银杏树上采摘;马铃薯,星玛客超市购买;酿酒酵母、枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌由吕梁学院微生物实验室提供。
1.1.2 试验试剂 酵母膏、蛋白胨、苯酚,分析纯,天津市光复精细化工研究所;牛肉膏,分析纯,北京奥博星生物技术有限公司;无水乙醇,分析纯,天津市凯通化学试剂有限公司; 无水葡萄糖、氯仿、正丁醇、三氟乙酸、标准单糖,分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备 电子天平(FA2004),上海力辰仪器科技有限公司; 数显电子恒温水浴锅(HH-6),常州国华电器有限公司;破碎机(DFT-100),温岭市林大机械有限公司; 医用离心机(L350),湖南湘仪实验室仪器开发有限公司; 生化培养箱(SPX-25),上海跃进医疗器械有限公司;立式压力蒸汽灭菌器(LDZX-50KBS),上海申安医疗器械厂;数控超声波清洗器(SB-100D),昆山市超声仪器有限公司; 紫外可见分光光度计 (UV-3100PC),上海美谱达仪器有限公司;电热鼓风干燥箱(GZX-9146MBE),上海博讯实业有限公司医疗设备厂;恒温培养振荡器(ZWY-100D),上海智城分析仪器制造有限公司; 高效液相色谱仪(E2695),美国Waters 公司。
1.3 酿酒酵母的培养
1.3.1 马铃薯葡萄糖琼脂培养基(PDA) 的配制取200 g 马铃薯,1 L 去离子水,先进行水煮,煮烂后用8 层的纱布过滤。 去离子水继续补充到1 L,放入称好的20 g 葡萄糖和18 g 琼脂粉, 一边加热一边用玻璃棒慢慢搅拌一直到完全溶解。 把溶解后的液体倒进1 L 大烧杯中, 用去离子水加到1 L 刻度线,分装入锥形瓶中密封,在121 ℃条件下高压灭菌30 min,稍冷却后倒入灭完菌的培养皿中,固体培养基凝固待用。
1.3.2 酿酒酵母发酵液体培养基的配制 称取20 g 葡萄糖,添加5 g 酵母膏,再称取10 g 蛋白胨,在自然pH 下加热溶解后冷却,分装到容量为250 mL 的三角瓶,每个装100 mL 即可,在121 ℃条件下高压灭菌30 min,然后取出备用。
1.3.3 酿酒酵母菌培养 在已经灭菌的PDA 培养基上接种已培养好的酿酒酵母菌, 在30 ℃、90 r/min 的摇床培养48 h 充分活化, 等到菌长满平板后, 切下适量的菌块接入酿酒酵母发酵液体培养基, 继续摇床培养48 h 后的菌液为一级种子液,之后继续传代,接种量为3%,再按照上述条件摇床培养48 h,菌种充分活化后的菌液即为二级种子液,4 ℃条件下冷藏待用。
1.4 发酵银杏叶制备 新鲜银杏叶与水配比为1:4 打汁,装进三角瓶塞好棉塞灭菌,将已经活化好的酿酒酵母菌株接入新鲜银杏叶汁中, 在摇床上培养72 h,分别于0、24、48、72 h 取样进行分析检测。
1.5 水提醇沉法提取发酵银杏叶粗多糖 称取酿酒酵母发酵不同时期的银杏叶汁, 按照比例与去离子水充分搅拌,在温度设置为85 ℃的水浴锅中浸提银杏叶汁8 h,在浸出过程中会出现蒸发,需要不断加入去离子水并及时用玻璃棒搅拌。8 h后把浸提后的银杏叶汁放到冰箱里过夜, 银杏叶汁会产生沉淀, 把纱布折成6 层过滤沉淀后的上清液,然后离心上清液,再继续放到水浴锅中85 ℃的条件下浓缩,再倒进无水乙醇放到冰箱里过夜,离心取沉淀,然后烘干水分,干燥过程中要不断去观察,干燥完的褐色固体物就是粗多糖(刘奕辰,2019;Chen,2016)。
1.6 对酿酒酵母发酵降解后的银杏叶多糖进行脱蛋白脱色处理
1.6.1 Sevage 法脱蛋白 配制所需浓度的酿酒酵母发酵后的银杏叶多糖液, 正丁醇及氯仿混合在一起(正丁醇:氯仿=1:4),然后与发酵后的银杏叶多糖溶液混合后超声波清洗机振荡20 min。 振荡后再去离心, 直到白色物质不再出现在液面交界处(王路瑶,2019)。
1.6.2 活性炭吸附脱色 对酿酒酵母发酵后的银杏叶多糖溶液进行脱色时用活性炭进行吸附,吸附后的溶液中加入4 倍的无水乙醇使其产生沉淀。 先离心再用无水乙醇把离心后的沉淀洗脱4次,多糖在冷冻干燥后取得。
1.6.3 苯酚-硫酸法测定多糖含量 称取10 mg标准葡萄糖,用蒸馏水将其全部溶解并倒入容量瓶中, 然后向容量瓶中加入蒸馏水以定容至100 mL,葡萄糖标准液完成备用(何钢,2015)。准备7 只洗干净的试管,按顺序向试管中加入0、0.2、0.4、0.6、0.8、1.0 mL 和1.2 mL 的标准液,然后再按顺序补蒸馏水, 再依次倒进1 mL 苯酚和5 mL 浓硫酸,添加好后先放置20 min 进行反应。之后设置波长为490 nm 测各试管中样品的吸光度, 记录数据借助软件画出标准曲线。
再称10 mg 酿酒酵母发酵后的银杏叶多糖,定容后取2 mL, 再按照同样的步骤测吸光度,记录数据以后根据方程算出酿酒酵母发酵降解后多糖所占的比例。
1.6.4 酿酒酵母发酵降解银杏叶多糖的组分分析取2 mg 酿酒酵母发酵后的银杏叶多糖样品,先三氟乙酸水解样品, 然后用高效液相色谱法测定来自酿酒酵母发酵银杏叶多糖的单糖成分。把D-葡萄糖、D-阿拉伯糖、L-岩藻糖、D-鼠李糖、L-甘露糖、D-木糖、D-半乳糖这些单糖作为混标,对酿酒酵母发酵降解银杏叶多糖中的单糖种类进行鉴定,并且算出每种单糖所占的摩尔百分比,最后对酿酒酵母发酵降解不同时期的银杏叶多糖的单糖组成进行比较分析。
1.7 酿酒酵母发酵降解银杏叶多糖抑菌性研究
1.7.1 配制肉汤培养基 按比例配制牛肉膏、葡萄糖、 蛋白胨和琼脂溶解灭菌后分别做成液体培养基和固体培养基。
1.7.2 活化菌种 选择适量的枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌接进培养基中。在恒温振荡器120 r/min 的转速中于37 °C 培养20 h,以确保细菌在液体培养基中的均匀分布并充分活化以形成种子溶液。
1.7.3 滤纸片抑菌圈试验 把滤纸做成10 mm的小圆形,分别放到清洗过的培养皿中,把装有小圆形滤纸片的培养皿与其他需要的仪器一起放进高压蒸汽锅中灭菌20 min。灭菌后把0.2 mL 的指示菌接到固体培养基, 借助涂布棒涂到培养基上尽量均匀,再把小圆形的滤纸片放到上面,最后将酿酒酵母发酵降解后的银杏叶多糖的小液滴放到小圆形滤纸片上,等待24 h 后,测量抑菌圈的直径, 将酿酒酵母发酵降解后的银杏叶多糖对指示菌的抑制作用进行对比分析(王筱瑜,2019)。
1.8 酿酒酵母发酵降解银杏叶多糖抗氧化活性的测定
1.8.1 邻苯三酚法测定银杏叶多糖抗氧自由基活性 吸取1.45 mL 浓度为0.1 mol/L 三羟甲基氨基甲烷溶液,先提前加热,到25 ℃时加入浓度为6 mmol/L 的邻苯三酚50 μL, 混匀后加入酿酒酵母发酵降解后的银杏叶多糖液。 向空白的样品中加蒸馏水0.5 mL, 在波长320 nm 处每半分钟测吸光度。 结果用抑制率表示(孟兆丽,2008)。
1.8.2 Fenton 法测定银杏叶多糖抗羟自由基活性的测定 在Fenton 体系中加进1.5 mL 的磷酸缓冲液,0.2 mL 的藩红,0.7 mL 浓度为2 mmol/L 的乙二胺四乙酸溶液,0.8 mL 发酵后的多糖液, 再加入0.8 mL1%的H202, 把几种溶液搅拌均匀后在37 ℃的水浴锅中进行保持温度,30 min 后在520 nm的波长处测吸光度。 在对照组和空白组中加入相同体积的蒸馏水(王萌皓,2019)。结果按以下公式计算:
羟自由基清除率/%=A0-(Ax-Ax0)/A0×100;
式中:A0为空白对照的吸光值;Ax为加样品的吸光值;Ax0为不加显色剂H2O2。
最后对酿酒酵母发酵降解不同时期的银杏叶多糖的抗氧自由基活性及抗羟自由基活性进行对比分析。
2 结果与分析
2.1 酿酒酵母发酵降解不同时期银杏叶多糖含量 将酿酒酵母接种到新鲜的银杏叶汁后, 提取发酵不同时期银杏叶中的粗多糖, 经过脱蛋白脱色后得到多糖, 将发酵各时期的多糖含量进行比较(杜涓,2020;吴娟,2019)。根据葡萄糖标准曲线的回归方程:y=0.5711x+0.1442,R2=0.9981(图1),得出酿酒酵母发酵降解不同时期银杏叶多糖含量为8.97%、9.54%、10.43%、11.18%。 由图2 可见,经酿酒酵母发酵降解的银杏叶多糖含量高于未发酵的银杏叶,且随着发酵时间的延长,银杏叶中的多糖含量逐渐增加。

图1 葡萄糖标准曲线
2.2 酿酒酵母发酵降解银杏叶多糖的单糖组成分析 各种标准单糖作为混标, 测定出酿酒酵母发酵后的银杏叶多糖的单糖有甘露糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖,在这其中葡萄糖和甘露糖占比较多, 在酿酒酵母不断发酵的过程中, 葡萄糖比例逐渐下降而甘露糖比例不断升高(表1)。 酿酒酵母发酵降解过程中,单糖组成由葡萄糖为主转变为以甘露糖为主发酵改变了银杏叶多糖中某些单糖的含量(施娅楠,2019),可能与酿酒酵母菌生长所产生的酶系以及代谢过程有关(彭继燕,2017)。
2.3 酿酒酵母发酵银杏叶多糖的抑菌性研究本研究选择生活中常见的代表性细菌, 金黄色葡萄球菌、 大肠杆菌和枯草芽孢杆菌 (杜成涛,2020),考察了不同浓度的酿酒酵母发酵后的银杏叶多糖溶液对三种指示菌的抑制能力, 结果如表2 所示。
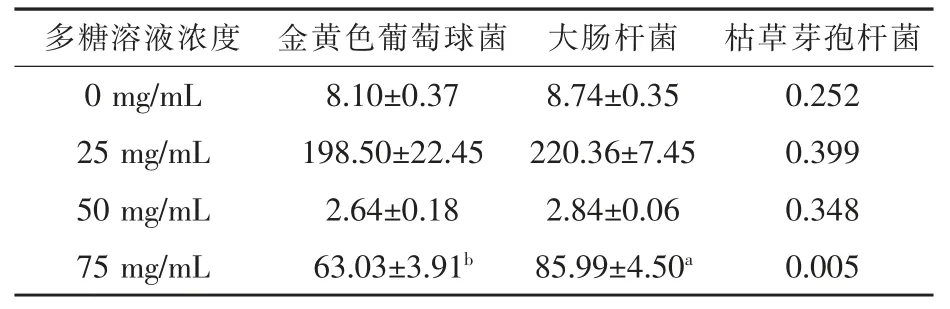
表2 酿酒酵母发酵多糖溶液对指示菌的抑菌圈直径 mm
通过测定三种指示菌抑菌圈的直径来判断酿酒酵母发酵后的银杏叶多糖溶液的抑菌能力(莫晓宁,2019)。由表2 可见,四个酿酒酵母发酵多糖溶液浓度中,除了空白试验,各个浓度的多糖溶液对三种指示菌均有抑菌圈且直径与对照组相比均显著增大, 说明酿酒酵母发酵降解后的银杏叶多糖溶液都有抑菌能力。 浓度高的酿酒酵母发酵多糖溶液对三种指示菌的抑菌圈直径较大, 浓度低的酿酒酵母发酵多糖溶液对三种指示菌的抑菌圈直径较小, 这说明本研究制备的酿酒酵母发酵的银杏叶多糖对三种指示菌均有不同程度的抑菌作用,酿酒酵母发酵的银杏叶多糖溶液浓度越高,抑菌能力越强。
2.4 酿酒酵母发酵银杏叶多糖的抗氧化活性测定
2.4.1 不同发酵时期银杏叶多糖的氧自由基抑制率 图3 为邻苯三酚法测定不同发酵时期银杏叶多糖的抑制氧自由基的结果。在图3 中可以看出,各个发酵时期的银杏叶多糖都具有抑制氧自由基的能力,而且酿酒酵母发酵降解银杏叶后,多糖的氧自由基抑制率会逐渐升高。
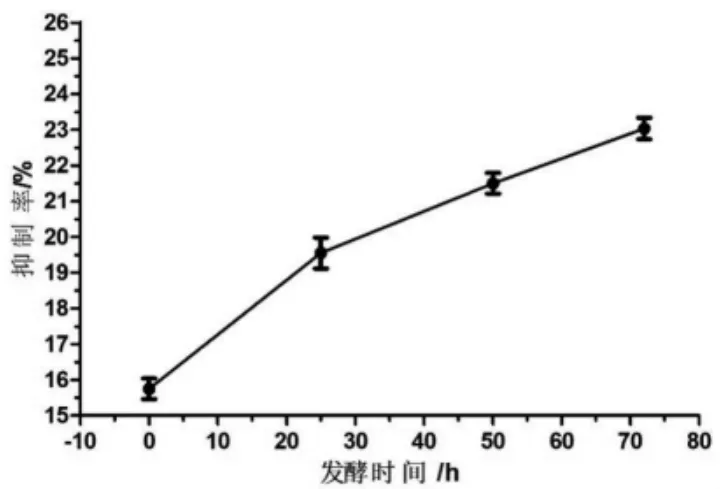
图3 邻苯三酚法测定不同发酵时期银杏叶多糖的氧自由基抑制率
2.4.2 不同发酵时期银杏叶多糖的羟自由基抑制率 图4 为酿酒酵母发酵降解过的银杏叶多糖的Fenton 法抗羟自由基活性的测定结果。 由图4 可知,Fenton 体系中不同发酵时期银杏叶多糖都有清除羟自由基的能力, 而且酿酒酵母发酵降解银杏叶后,随着发酵时间延长,多糖的羟自由基清除率会逐渐升高。

图4 Fenton 体系中不同发酵时期银杏叶多糖的羟自由基清除率
3 结论
苯酚-硫酸法测定结果表明, 经过酿酒酵母发酵降解72 h 的银杏叶多糖含量由8.97%提高到11.18%。通过对酿酒酵母发酵降解后的银杏叶多糖中的单糖进行种类鉴定, 其单糖组成为鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖、木糖、岩藻糖。 抑菌性试验结果表现出不同浓度的酿酒酵母发酵银杏叶多糖对三种指示菌都有抑菌作用,与对照组相比,其抑菌圈均显著增大,酿酒酵母发酵过的银杏叶多糖溶液的浓度越高,抑菌能力越强,浓度为25 mg/mL 的酿酒酵母发酵多糖溶液对金黄色葡萄球菌的抑菌圈直径为7.37 mm, 浓度为75 mg/mL 的酿酒酵母发酵多糖溶液对金黄色葡萄球菌的抑菌圈直径为10.71 mm。 抗氧化试验结果显示, 酿酒酵母发酵降解不同时期的银杏叶多糖都具有抑制氧自由基和清除羟自由基的能力,经过酿酒酵母发酵降解后的银杏叶多糖溶液抑制氧自由基和清除羟自由基的能力更强。
