曲妥珠单抗联合SOX方案治疗进展期胃癌的效果及对患者血清肿瘤标志物水平的影响
2024-01-17户军燕邱作栋
户军燕 邱作栋 周 宁 于 婷
作者单位:450000 郑州大学第五附属医院
胃癌(gastric cancer,GC)是指在各种致癌因子和高危因素作用下胃黏膜上皮细胞发生异常增生的消化道恶性肿瘤疾病[1],早期无明显症状,大多数患者确诊时已处于进展期,错过了手术治疗的最佳时间,即使行手术治疗仍存在50%~70%的复发率和30%的5年生存率,整体预后较差[2-3]。故如何提高进展期胃癌(advanced GC,AGC)患者的手术效果,延长生存期成为当前研究的重点。目前多推荐替吉奥联合奥沙利铂的SOX方案作为新辅助化疗的手段,其对杀伤肿瘤细胞,延缓病情进展的作用显著,但也存在恶心呕吐、腹泻等不良反应[4-5],因此临床上多采用SOX方案联合放疗、靶向治疗、免疫治疗等来减少不良反应的发生,提高治疗效果。有研究表明[6],存在25%~30%的AGC患者表现人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)阳性表达,其与肿瘤细胞的增殖、分化、浸润、迁移等密切相关,故其治疗方案的选择以作用于HER-2靶向的抗癌药物联合SOX方案较为适宜。基于此,本研究选用曲妥珠单抗联合SOX方案来探究其对AGC患者的疗效,以期为临床实践提供新的参考。
1 资料与方法
1.1 一般资料
将2021年1月至2023年2月期间本院收治的68例AGC患者纳入研究,并按随机数字表法将符合下列标准的患者分成对照组(34例)和研究组(34例),2组一般资料无明显差异(P>0.05)。见表1。

表1 2组一般资料的对比
纳入标准:①符合2020版《胃癌诊治难点中国专家共识》[7]中AGC的标准并经病理活检确诊;②参照《胃癌HER-2检测指南》[8]中染色评分标准确诊为HER-2阳性AGC;③年龄20~75岁,首次接受新辅助化疗;④过去3个月未接受其他抗肿瘤治疗;⑤预计生存时长>3个月;⑥患者对本研究知情同意。
排除标准:①存在免疫疾病、凝血功能异常、心肾功能不全、恶性肿瘤等疾病;②存在精神障碍或沟通困难;③不耐受本研究所选治疗药物;④存在化疗禁忌证;⑤存在胃部手术史或消化道大出血、消化道穿孔等并发症;⑥中途退出或依从性较差者。伦理委员会已批准本研究。
1.2 治疗方法
对照组应用SOX方案治疗。每个疗程第1天给予静脉滴注奥沙利铂130 mg/m2+5% 500 ml葡萄糖溶液,3 h内输注完成;第1~14天给予口服替吉奥,剂量据体表面积调整:S体表<1.25 m2,每次40 mg;1.25 m2≤S体表<50 m2,每次50 mg;S体表≥1.50 m2,每次60 mg,每日2次(早、晚饭后口服)。21 d为1个疗程,连续治疗4个疗程。研究组应用曲妥珠单抗联合SOX方案治疗,SOX方案的治疗方法同对照组,在此基础上给予静脉滴注曲妥珠单抗+0.9% 250 ml氯化钠溶液,首次剂量为8 mg/kg,时长为90 min,而后以6 mg/kg的剂量维持治疗,每周1次,连续服用12 w。
1.3 观察指标
1.3.1 短期疗效 参照RECIST1.1进行疗效评价[9]。①完全缓解(CR):症状、体征和肿瘤病灶基本消失,维持时间>4周;②部分缓解(PR):症状、体征有所缓解,病灶直径减小≥30%;③病情稳定(SD):症状、体征无明显改善,病灶直径减小<30%或增加≤20%;④疾病进展(PD):症状、体征无明显改善甚至加重,病灶直径增加>20%或产生新病灶;⑤总有效率(ORR)=(CR例数+PR例数)/总例数×100%。
1.3.2 血清肿瘤标志物 分别于治疗前后空腹采集静脉血3 ml,置于抗凝管后行3000 r/min离心处理10 min,取上层血清于-75 ℃下冷藏保存。应用电化学发光法检测糖类抗原724(Carbohydrate antigen 724,CA724)、癌胚抗原(Carcinoembryonic antigen,CEA)、糖类抗原199(Carbohydrate antigen 199,CA199)水平。1.3.3 免疫功能 分别于治疗前后采集静脉血,离心处理后应用酶联免疫吸附法检测免疫球蛋白A(Immune globulin A,IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)水平。
1.3.4 药物毒副作用发生情况 参考CTCAE v4.0药物不良事件评价标准[10],记录2组恶心呕吐、胃肠道反应、骨髓抑制、肝功能异常、外周神经毒性、贫血、心脏毒性、白细胞减少等药物毒副作用的发生率。
1.4 统计学方法
2 结果
2.1 2组短期疗效的对比
研究组的ORR率为67.65%,高于对照组的41.18%(χ2=4.802,P=0.028)。见表2。

表2 2组短期疗效的对比(例,%)
2.2 2组血清肿瘤标志物水平的对比
治疗后,2组的血清CA724、CEA、CA199水平均低于同组治疗前,且研究组低于对照组(P<0.05)。见表3。

表3 2组血清肿瘤标志物水平的对比
2.3 2组免疫功能的对比
治疗后,2组的IgA、IgG、IgM水平均低于同组治疗前,但研究组高于对照组(P<0.05)。见表4。
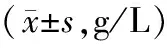
表4 2组免疫功能的对比
2.4 2组药物毒副作用发生率的对比
2组各项药物毒副作用的发生率无明显差异(P>0.05)。见表5。
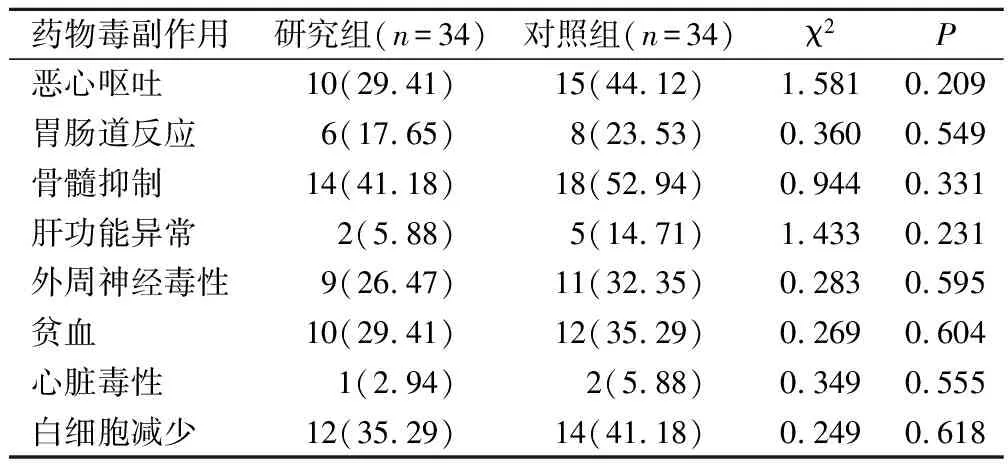
表5 2组药物毒副作用发生率的对比(例,%)
3 讨论
近年随着社会经济发展、生活方式改变和饮食结构调整,消化系统疾病发生的危险因素普遍暴露,GC的发生率也呈现逐年上升的趋势,其中以病情较为严重的AGC最为多见,对患者的生命健康造成严重威胁[11]。AGC患者已失去手术根治的最佳时机,较多研究指出[12],新辅助化疗在缩小病变范围,降低肿瘤分期,提高手术切除率,延长患者生存时间方面发挥重要作用。奥沙利铂联合替吉奥的SOX方案是最常用的新辅助化疗方案,二者联合更能显著抑制DNA的复制和转录,提高抑癌效果,但也会增加药物毒副作用,降低治疗依从性[4,12]。而有研究指出[13],靶向治疗辅助SOX方案能显著提高治疗效果,加之HER-2靶点在AGC中具有较高的特异性和敏感性,故选用靶向HER-2的分子靶向药物即曲妥珠单抗较为适宜。为了探究曲妥珠单抗联合SOX治疗AGC的效果,本文开展此次研究。
本研究结果显示,治疗后研究组总有效率和疾病控制率均高于对照组,结果表明曲妥珠单抗联合SOX方案相比于单用SOX方案治疗AGC的疗效更加显著。其原因在于SOX方案联合两种化疗药物,抗癌作用显著;HER-2属原癌基因,与配体结合后可激活酪氨酸激酶活性,介导多种通路参与调节细胞的增殖、分化、迁移过程,而曲妥珠单抗为人源化单克隆抗HER-2抗体,能特异性抑制HER-2基因表达,阻断其介导的信号转导和转录过程来发挥抑制癌细胞增殖的作用[14]。两种方案的联合更能发挥协同效应,进一步提高抗肿瘤效果。
治疗后2组的血清CA724、CEA、CA199水平均低于同组治疗前,且研究组低于对照组。CA724属高分子糖蛋白,其在消化系统肿瘤中呈异常高表达;CEA多分布于内胚叶起源的消化系统癌,其表达水平与GC的发生呈显著正相关;CA199属低聚糖肿瘤相关抗原,分布于消化系统的上皮组织,在GC患者中呈高表达[15]。本研究结果提示曲妥珠单抗联合SOX方案更能显著降低AGC患者的血清中肿瘤标志物水平,提高抗癌效应。
治疗后2组的IgA、IgG、IgM水平均低于同组治疗前,而研究组的水平高于对照组。蒋世海等[16]研究指出,肿瘤细胞和化疗药物副作用均会对机体的免疫功能造成损伤,上述指标水平与免疫功能呈正相关。治疗后2组指标均下降表明SOX化疗方案会损伤患者的免疫功能,而研究组高于对照组则提示联合曲妥珠单抗能降低化疗所致的免疫抑制效应,维护机体安全。除此之外,2组药物毒副作用发生率无明显差异。提示曲妥珠单抗联合SOX方案不会显著增加不良反应的发生,应用较安全,也从侧面证明了曲妥珠单抗的免疫保护作用,与杨乔等[17]研究结果相一致,进一步证实了本研究方案的安全性。
综上所述,曲妥珠单抗联合SOX方案治疗AGC的效果显著,对于降低患者血清肿瘤标志物水平,减弱化疗对机体的免疫抑制作用,减少药物毒副作用的发生均具有重要作用,值得在临床上广泛应用。
