CAR-T细胞免疫疗法对复发/难治性弥漫大B细胞淋巴瘤患者LDH、ALC、CD4+/CD8+、Ki67表达的影响
2024-01-17付艳杰郭文静段鹏月刘星辰
付艳杰 郭文静 段鹏月 刘星辰
作者单位:450000 郑州大学附属肿瘤医院,河南省肿瘤医院
淋巴瘤属于恶性血液系统肿瘤,具有高度异质性,其中非霍奇金淋巴瘤占比约90%[1]。弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是常见的侵入性B细胞非霍奇金淋巴瘤,发病率约占总非霍奇金淋巴瘤的30%,且具有全身浸润特点[2]。临床治疗以化疗、放疗等方案为主,经一线治疗后治愈率约70%,但仍有30% DLBCL患者复发,10%~15%呈现难治性,2年生存率仅20%[3]。既往研究显示对于复杂/难治性DLBCL再次采用原方案或进行二线治疗难以起效[4]。随着肿瘤免疫治疗的研究进展和技术发展,嵌合抗原受体T细胞(chimeric antigen receptor T-Cell,CAR-T)被发现对恶性肿瘤细胞具有较好的靶向性和杀伤活性。同时通过准确评估治疗效果,将治疗方案进行个体化的调整,提高DLBCL患者的治愈率是当前临床的研究热点。乳酸脱氢酶(lactate dehydrogenase,LDH)属于糖酵解酶,是肿瘤微环境中重要的代谢酶之一,在肿瘤细胞生长中提供能量[5]。淋巴细胞作为机体免疫功能的重要组成部分,在细胞介导的抗肿瘤免疫反应中起了关键作用,大量研究发现淋巴细胞绝对值(absolute lymphocyte count,ALC)与肿瘤发生、发展和预后密切相关[6]。CD4+/CD8+在肿瘤免疫监测中具有重要作用,Ki67是判断肿瘤增殖能力和判断肿瘤恶性程度的重要指标。故本研究主要探讨CAR-T免疫疗法对复发/难治性DLBCL患者LDH、ALC、CD4+/CD8+、Ki67水平表达的影响。
1 材料与方法
1.1 一般资料
回顾性选取我院2018年2月至2022年2月收治且明确诊断为复发难治性DLBCL患者92例,男性49例,女性43例;年龄22~74岁,平均(55.13±14.36)岁,符合《中国弥漫大B细胞淋巴瘤诊断与治疗指南》[7]中相关诊断标准,满足以下任意1项即可诊断:①经标准化疗方案治疗至完全缓解(complete remission,CR),但半年内复发,采用原方案或二线治疗方案无法获得CR;②经标准一线治疗≥4疗程,病情进展或肿瘤缩小<50%;③造血干细胞移植后复发。纳入标准:①经活检确诊;②可干预靶点(CD20/CD19);③年龄≥18岁,≤75岁;④ECOG评分[8]:0~3分;⑤预计生存期>3个月;⑥外周血T淋巴细胞计数≥0.2×109/L;⑦临床资料及随访资料完善;⑧AnnArbor分期[9]:Ⅱ~Ⅳ期。排除标准:①T细胞淋巴瘤患者;②育龄期妇女妊娠结果为阳性;③心、脑、肝等器官功能严重衰竭;④既往1个月内参加其他临床试验者;⑤采用激素或免疫抑制治疗其他慢性疾病者;⑥伴有自身免疫疾病或免疫缺陷者;⑦伴有严重感染者。
1.2 治疗方法
所有患者均行CAR-T细胞免疫治疗。患者于本院行外周血淋巴细胞单采,抽取DLBCL患者外周静脉血,采用血细胞单采仪(COBE Spectra型)应用采集程序采集80~100 mL血细胞,获得适量淋巴细胞,数量>1×109/L。行体外分离、纯化T细胞。构建CAR表达载体,利用基因工程技术,选择CD19作为靶点分子融合T细胞受体的跨膜激活信号域,促进T细胞增殖,使CAR基因在T细胞表面表达,制成CAR-T细胞,培养过程无菌操作、严格质控。CAR-T细胞治疗前3~5 d行FC方案(氟达拉滨30 mg/m2·d-1+环磷酰胺750 mg/m2·d-1)连续3 d预处理。根据患者反应输注人源化CD19 CAR-T细胞,输注剂量均为1×106/kg,总输注剂量为5×108~11×108cell。
1.3 观察指标
1.3.1 疗效评估[10]观察DLBCL患者经CAR-T细胞治疗后总有效率,CR:治疗前相关临床病症体征完全消失;治疗后残留病灶经正电子发射计算机断层扫描(positron emission tomography,PET)扫描呈阴性,为典型氟代脱氧葡萄糖(FDG)高亲和性淋巴瘤;治疗后CT显示淋巴结及淋巴结病灶缩至正常大小;治疗后不触及肝、脾,影像学检查为正常大小。部分缓解(partial remission,PR):淋巴结、肝、脾无增大,单个淋巴结最大横径缩小≥50%;其他器官未见可测量病灶;无新病灶。稳定(stable disease,SD):治疗效果未达到CR和PR,但不符合疾病进展标准;影像学检查未见新病灶。进展(progression disease,PD):治疗中出现横径≥1.5 cm新病灶;淋巴结、受累结节及其他病灶增大≥50%。总有效率=(CR+PR)/接受治疗总病例数×100%。观察治疗有效和无效患者临床特征,包括性别、年龄、AnnArbor分期、ECOG评分、结外受累部位、国际预后指数(international prognostic index,IPI)、CAR-T治疗线数。
1.3.2 安全性评价 以治疗开始后的临床观察、体格检查、实验室检查及相关特殊检查为依据,观察经CAR-T细胞治疗后患者细胞因子释放综合征(cytokine release syndrome,CRS)、神经毒性反应、低免疫球蛋白血症等。
1.3.3 LDH、ALC、CD4+/CD8+、Ki67水平检测 取患者外周静脉血6 ml,采用全自动生化分析仪(博科BK-400型)检测LDH水平;采用全自动血细胞分析仪(WD-5000型)检测ALC、CD4+/CD8+表达。超声引导下穿刺取病灶活检标本,40 g/L甲醛溶液固定行石蜡包埋,采用免疫组化法检测癌组织Ki67水平,试剂盒购于北京百奥莱博科技有限公司,操作严格按照试剂盒说明书进行。
1.4 统计学分析

2 结果
2.1 临床疗效
92例DLBCL患者经CAR-T细胞免疫治疗后CR 39例(42.39%),PR 24例(26.09%),SD 18例(19.57%),PD 11例(11.96%),总有效率为68.48%。
2.2 不良反应
92例DLBCL患者在CAR-T细胞免疫治疗过程中71例(77.17%)发生CRS,均予以对症治疗,症状改善不明显患者采用糖皮质激素治疗,未发生不良影响;发生低免疫球蛋白血症73例(79.35%);未出现神经毒性反应。
2.3 治疗前后LDH、ALC、CD4+/CD8+、Ki67水平比较
经CAR-T细胞免疫治疗后LDH、Ki67水平较治疗前下降,ALC、CD4+/CD8+较治疗前上升,差异具有统计学意义(P<0.05)。见表1。
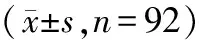
表1 DLBCL患者治疗前后LDH、ALC、CD4+/CD8+、Ki67水平比较
2.4 CAR-T细胞免疫治疗有效和无效患者治疗前临床特征比较
DLBCL治疗无效患者年龄、AnnArbor分期、结外受累部位数量、IPI、LDH、Ki67、CAR-T治疗线数均高于治疗有效组患者,ALC、CD4+/CD8+均低于治疗有效组患者(P<0.05)。见表2。
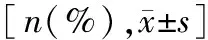
表2 CAR-T细胞免疫治疗有效和无效DLBCL患者治疗前临床特征比较
2.5 影响CAR-T细胞免疫治疗疗效的Logistic回归分析
Logistic回归分析显示,高龄、AnnArborⅣ期、多结外受累部位数量、高IPI得分、二线以上CAR-T以及治疗前LDH、Ki67的水平升高和ALC、CD4+/CD8+的水平降低是影响DLBCL患者CAR-T细胞免疫治疗疗效的危险因素(P<0.05)。见表3。
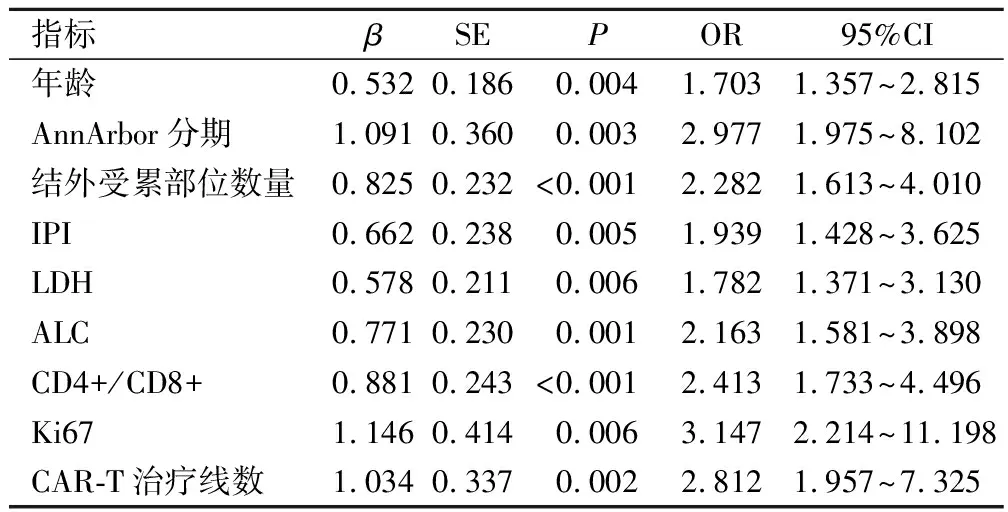
表3 影响CAR-T细胞免疫治疗疗效的多因素分析
2.6 LDH、ALC、CD4+/CD8+、Ki67水平对CAR-T细胞免疫治疗效果的预测价值
建立ROC曲线,LDH、ALC、CD4+/CD8+、Ki67 AUC分别为0.823、0.835、0.873、0.849,提示LDH、ALC、CD4+/CD8+、Ki67 对CAR-T细胞免疫治疗疗效具有一定的预测价值。见表4、图1。
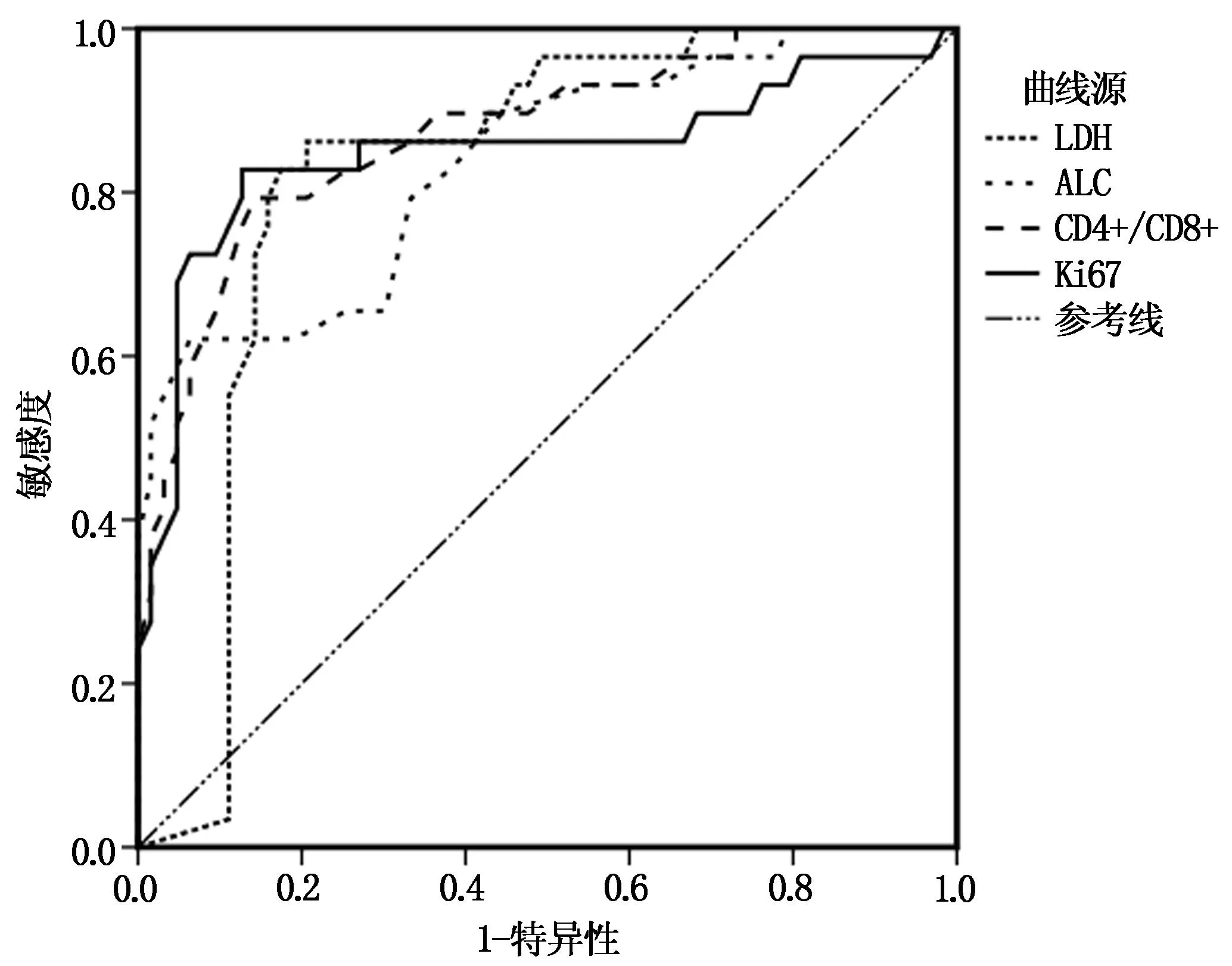
图1 LDH、ALC、CD4+/CD8+、Ki67水平对CAR-T细胞疗效的预测价值ROC曲线
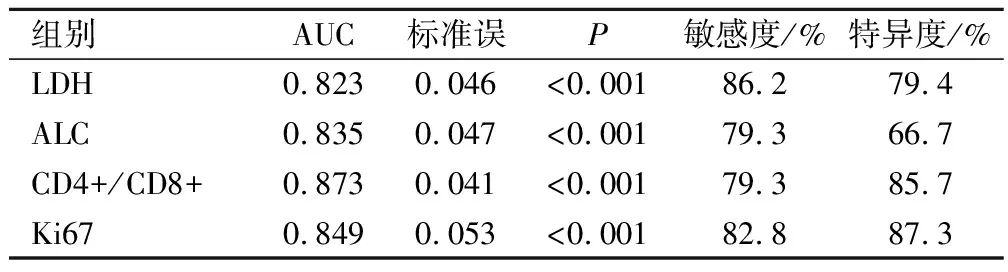
表4 治疗前LDH、ALC、CD4+/CD8+、Ki67水平对CAR-T细胞疗效的预测价值
3 讨论
DLBCL呈高度异质性和侵袭性,经规范治疗具有较好的缓解率,但部分患者在治疗出现CR或造血干细胞移植后1~3年复发,转变为复发/难治性DLBCL[11]。复发/难治性DLBCL传统治疗疗效差,中位生存期短。CAR-T细胞疗法是近年来推出的新型精准靶向治疗肿瘤细胞技术,成为肿瘤免疫治疗领域的研究热点,可通过改变肿瘤细胞蛋白质结构产生变异,从而杀灭癌细胞[12]。同时与传统免疫治疗相比,CAR-T可减少共刺激分子免疫逃逸,在血液系统肿瘤中具有良好的疗效[13]。本研究结果显示,经CAR-T细胞免疫治疗后临床总有效率68.48%。而CAR-T细胞免疫治疗在取得疗效的同时,存在CRS、神经毒性、感染、脱靶效应等不良反应,其中以CRS常见,由于CAR-T细胞活化可释放大量细胞因子,刺激巨噬细胞及单核细胞释放白细胞介素,使患者发生持续性高热等症状,这会引起多脏器功能障碍,严重情况下可危及生命[14-15]。本研究结果中71例(77.17%)发生CRS不良反应,及时干预后未见严重情况发生。CAR-T细胞灭杀肿瘤细胞的同时会损伤正常B细胞,出现脱靶效应,B细胞和免疫球蛋白水平下降。本研究73例(79.35%)患者发生低免疫球蛋白血症。因此在CAR-T细胞免疫治疗中,应实时监控患者不良反应发生情况及不良反应严重程度,并予以对症治疗。
此外LDH可为肿瘤细胞提供能量,因此在恶性肿瘤中水平高,当肿瘤细胞膜通透性增加导致大量LDH释放入血,因此血清LDH测定在肿瘤疗效的预后判断中具有重要意义[16]。有研究显示ALC与血液肿瘤预后具有密切关系,且ALC水平减少被列入霍奇金淋巴瘤预后评分,是霍奇金淋巴瘤预后的不良因素之一[17]。CD4+和CD8+均属于T淋巴细胞,是人体免疫力的重要指标,CD4+主要代表T辅助细胞,其记数能够直接反映人体免疫功能,但随生理情况波动;CD8+代表T抑制细胞和T杀伤细胞,而CD4+/CD8+从整体上反映细胞免疫功能状态,在肿瘤免疫检测中具有重要作用[18-19]。Ki67是判断肿瘤增殖能力、肿瘤恶性程度及预后效果的重要指标,但在DLBCL中Ki67阳性指数存在争议[20]。本研究结果中DLBCL治疗无效患者年龄、AnnArbor分期、ECOG评分、结外受累部位数量、IPI、LDH、Ki67、CAR-T治疗线数均高于治疗有效组患者,ALC、CD4+/CD8+均低于治疗有效组患者。采用Logistic回归分析结果显示,高龄、AnnArborⅣ期、多结外受累部位数量、高IPI得分、二线以上CAR-T以及治疗前LDH、Ki67的水平升高和ALC、CD4+/CD8+的水平降低是影响DLBCL患者CAR-T细胞免疫治疗疗效的危险因素。这与高龄患者自身免疫功能下降、脏器衰竭等相关,同时DLBCL患者AnnArbor疾病分期越高,存在多个结外受累部位提示病情越严重。而IPI评分标准根据患者年龄、临床分期、结外受累数量、LDH等评价预后,因此IPI评分越高对预后危险度越高。Ki67阳性指数越高,提示肿瘤细胞恶性程度越高,因此可预测CAR-T细胞疗效。本研究经ROC曲线分析LDH、ALC、CD4+/CD8+、Ki67水平AUC分别为0.823、0.835、0.873、0.849,提示对DLBCL疗效具有预测价值。
综上所述,DLBCL患者经CAR-T细胞免疫治疗后,可升高ALC和CD4+/CD8+表达,降低LDH、Ki67水平表达,且LDH、ALC、CD4+/CD8+、Ki67水平的表达对临床疗效具有预测价值。本研究未观察DLBCL患者CAR-T细胞免疫治疗后的生存期,以及LDH、ALC、CD4+/CD8+、Ki67水平对长期预后的影响,待后续进行更全面的临床研究。
