博来霉素诱导的肺纤维化大鼠肺组织病理和超微结构变化*
2024-01-17廖一羲邱志广李明艳张彩丽田燕歌
廖一羲,王 搏,邱志广,李明艳,张彩丽,田燕歌,
(1呼吸疾病中医药防治省部共建协同创新中心,河南省中医药防治呼吸病重点实验室,河南 郑州 450046;2中医药科学院,河南 郑州 450046)
肺纤维化(pulmonary fibrosis,PF)是由多种因素(包括遗传、感染和环境暴露等)引起的一种间质性肺疾病,其主要病理表现为肺泡结构破坏、肺成纤维细胞增殖和细胞外基质沉积,导致广泛瘢痕形成,临床表现为进行性呼吸困难和肺功能进行性恶化[1-3]。随着全球老龄化的进展,PF发病率呈逐年上升趋势,预后不良[4-5]。目前缺乏有效的治疗手段,符合临床病理特征的动物模型是探讨疾病发病机理、寻求有效疗法的关键。一次性气管内滴注博来霉素(bleomycin,BLM)是目前研究中最为常用的PF 模型制备方法[6]。然而,目前对于此模型成模特点评价仍较为片面,且评价时间多为造模后28 d。因此,本研究基于此造模方法,于模型建立42 d通过检测肺功能、肺部CT、肺组织病理、肺组织超微结构变化等指标,较为全面地评价模型的成模特点,为基础研究应用提供参考。
材 料 和 方 法
1 实验动物
清洁级6~8 周龄雄性SD 大 鼠24 只,体 质量(200~240)g,购自斯贝福(北京)生物技术有限公司,合格证号为SCYK(京)2019-0015,动物质量合格证号为110324220102348616,饲养于河南中医药大学动物中心,已通过伦理审核,伦理编号为DWLL202208003。
2 主要试剂
盐酸博来霉素(批号:610740)购自日本化药株式会社;苏木素染液(批号:20220516)、伊红染液(批号:ZH192715)、Masson 三色染色试剂盒(批号:20180708)和Gluta 固定液(批号:20221026)购自索莱宝生物科技有限公司;异氟烷(批号:031217015,河北金达福药业有限公司);SPI-PON 812 Epoxy Resin Monomer(批号:1260804)和SPI Chem Accelerator,DY064(批号:1260810)购自SPI。
3 主要仪器
高分辨离活一体微型CT NEMO®Micro CT(平生医疗科技有限公司);RM2145 型自动切片机(Leica);TEM1400 透射电镜(JEOL);MCR 302e 型流变仪(Anton Paar);EMTP 型全自动树脂处理机(Leica);CK40 倒置相差显微镜(Olympus);Pannoramic MIDI型扫描仪(3D HISTECH);FinePointe™series 动物肺功能检测系统(BUXCO)。
4 实验方法
4.1 PF 模型建立 24 只动物按照随机数字表法随机分为2 组,包括对照(control)组和模型(model)组,每组12 只。采用1%戊巴比妥钠50 mg/kg 进行大鼠麻醉,使麻醉后的大鼠平躺在动物操作台上,在咽喉部冷光源照射下,使用气管导管经声门裂进行气管插管,模型组滴入3 mg/kg BLM 后,即令大鼠悬垂并旋转,以便药物在肺内均匀分布,对照组注入等量的生理盐水。造模完成后观察大鼠状态,待大鼠完全清醒后归笼。密切观察大鼠生存状态,记录大鼠死亡时点,进行生存曲线绘制。造模方案及试剂剂量均参照本实验室有关前期研究[7-8],造模后42 d 进行模型评价。
4.2 肺部CT 大鼠造模第42 天,采用异氟烷吸入麻醉法,气体流量调节为500~700 mL/min,诱导浓度调节为3%~4%,待麻醉剂充满诱导盒,约1 min 后,将动物放入诱导盒,随即关闭,等待动物完全麻醉。此时维持浓度调节为2%~2.5%,从诱导盒取出动物,使其俯卧于高分辨离活一体微型CT 的专用板上,持续吸入麻醉,调节各项参数后进行肺部CT 扫描。扫描结束后采用Recon 软件的迭代算法进行肺部CT 重构。将重构后的CT 图像导入Mimics Research 21.0 进行图片采集。参数:管电压60 KV,管电流0.15 mA。
4.3 肺功能 采用1%戊巴比妥钠按照50 mg/kg 的剂量麻醉后,大鼠行气管插管后,用FinePointe™series 动物肺功能检测系统检测大鼠的用力肺活量(forced vital capacity,FVC)及动态肺顺应性(dynamic lung compliance,Cdyn)等指标[9]。
4.4 肺组织硬度测试 使用流变仪 MCR 302e测量小鼠肺组织的储能模量(G')和损耗模量(G''),进而获得其杨氏模量(Young's modulus)[10]。相应的杨氏模量使用以下公式计算:E = 2G(1 + υ);G = G'2 +G''2。公式中:E:杨氏模量,υ:材料的泊松比(肺组织为0.4),G:剪切模量,G':储能模量,G'':损耗模量。
4.5 肺组织病理检测 肺组织用甲醛固定,梯度脱水,石蜡包埋。
4.5.1 HE 染色 石蜡切片逐级脱蜡至水;苏木素染色4 min,1%盐酸乙醇分化,流水冲洗;伊红染液中染色4 min,流水冲洗;切片依次逐级放入浓度更高的乙醇及二甲苯中透明,晾干后,中性树胶封片。采用Pannoramic MIDI 扫描仪进行扫描,用slide-viewer软件进行图片采集,采用Szapiel 评分系统[11]进行肺泡炎评分,见表1。

表1 Szapiel评分系统Table 1. Szapiel score system
4.5.2 Masson染色 与HE切片的脱蜡方法相同;切片放入重铬酸钾浸泡过夜;放入苏木素染液浸染,流水冲洗后,1%盐酸乙醇分化;切片放入丽春红酸性品红浸染,流水冲洗;分别于磷钼酸水溶液浸染后于苯胺蓝染液染;1%冰醋酸分化后,无水乙醇脱水。切片透明、封片以及图片采集与HE 染色方法相同。采用Ashcroft 半定量评分系统[12]进行肺部纤维化评分,见表2。
4.6 透射电镜观察 肺组织切成1 mm×1 mm×1 mm 后于2.5%戊二醛电镜固定液中固定4 h,PBS 洗后以1%锇酸固定液固定1.5 h,梯度乙醇逐级脱水,丙酮脱水,812 环氧树脂包埋过夜,聚合后行超薄切片,饱和醋酸双氧铀水溶液染色10 min,柠檬酸铅溶液染色8 min 后烘干。采用日本电子TEM1400 透射电镜观察以下超微结构:胶原纤维;II 型肺泡上皮细胞(alveolar type II epithelial cells,AEC II)中的板层小体(lamellar bodies,LBs)、线粒体(mitochondrion,Mi)和内质网(endoplasmic reticulum,ER);巨噬细胞;呼吸膜形态变化(并测量呼吸膜厚度)。该实验委托河南中医药大学中医药科学院电镜中心完成。
5 统计学处理
采用SPSS 25.0 软件进行统计学分析,采用GraphPad Prism 8 软件进行绘图。计量数据用均数±标准差(mean±SD)表示。组间均数比较采用独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1 生存曲线
模型组大鼠的生存曲线如图1所示。结果显示,造模第2天死亡1只,解剖见肺淤血较严重,可能为造模不耐受死亡;第14~28 天死亡2 只,解剖均见双肺肺门部有大片白色斑片出现,可能为肺部病变较重死亡;至42 d,模型组有9只存活,存活率为75%。
2 肺部CT
对照组双肺支气管走行光滑规则、血管分布均匀,肺纹理清晰;模型组以肺门部病变较严重,可见牵张性支气管扩张/细支气管扩张,双肺可见蜂窝影及网状密度增高影,部分可见肺不张现象,见图2。

Figure 2. CT images of rat lungs in control group (A) and model group (B). Atelectasis in the left lung with honeycomb and lattice shadows in the hilar region of both lungs (solid arrows).图2 大鼠肺CT图像
3 大鼠肺功能及肺组织硬度变化
与对照组比较,模型组大鼠用力肺活量(forced vital capacity,FVC)和动态肺顺应性(dynamic lung compliance,Cdyn)均显著降低(P<0.05),见图3A;与对照组比较,模型组大鼠肺组织硬度显著升高(P<0.05),见图3B。
4 大鼠肺外观及肺组织病理
4.1 肺外观 造模42 d,解剖可见对照组大鼠肺脏呈淡红色,颜色均匀,质地柔软且均一;模型组大鼠肺颜色较暗淡,肺组织较肿胀,肺上可见散在暗红色出血点及白色斑块状病变,颜色及质地不均匀,质地较对照组偏硬,见图4A。
4.2 肺组织病理的变化 HE 染色分析可见,与对照组相比,模型组可见肺泡结构被破坏,炎症反应细胞浸润,肺泡壁增厚,纤维条索出现,见图4A。病理评分显示,模型组肺泡炎较为严重,与对照组相比具有统计学意义(P<0.01),见图4B。Masson 染色分析可见,与对照组相比,模型组在在肺泡及细支气管壁出现纤维增生,且肺泡结构破坏,肺组织中可见大量胶原纤维成片状生成,见图4A。病理评分显示,模型组纤维化较为严重,与对照组相比具有统计学意义(P<0.01),见图4C。
5 超微结构
5.1 胶原沉积情况 对照组大鼠肺组织胶原纤维沉积较少,在动脉中膜及内皮下层可见少量胶原纤维;模型组大鼠肺组织中可见大片胶原纤维沉积,肺泡上皮细胞、内皮细胞周围可见大量胶原纤维,且排列紊乱,部分成束状定向排列,纤维直径较均一,见图5。
5.2 AEC II 电镜下对照组AEC II 结构清晰,包膜完整,细胞未见肿胀,细胞表面可见较多排列整齐的微绒毛,细胞核居中,染色质均匀;胞质丰富,ER、LBs 等细胞器结构未见明显异常;Mi 膜清晰,嵴排列均匀,未见明显肿胀。模型组可见细胞包膜破坏,胞内基质局部溶解,细胞分界不清,细胞表面的微绒毛减少且排列不齐;细胞核成不规则多边形,较皱缩,核染色质凝集粗块状,异染色质较多;胞质中细胞器结构破坏;Mi 肿胀,嵴断裂及空泡化。模型组Mi 显著减少(P<0.05);ER 扩张,出现脱颗粒现象;LBs 数量显著减少(P<0.05),呈现空泡化。见图6。
5.3 巨噬细胞 对照组巨噬细胞呈卵圆形,表面出现长度不一的扁平状胞质突起;细胞核大而圆,染色质细密,异染色质多集中于核周边;细胞质内含有较多的溶酶体,初级溶酶体较多。模型组间质巨噬细胞及肺泡腔内巨噬细胞数量显著增多,细胞体积较大,胞质内溶酶体丰富,次级溶酶体及残体较多。与对照组相比,模型组大鼠肺间质巨噬细胞数量显著增多(P<0.01)。见图7。

Figure 7. Ultrastructure of macrophages. A: ultrastructure of macrophages in control and model groups (scale bar=10 μm for original electron microscopic images; scale bar=2 μm for detail electron microscopic image in control group; scale bar=5 μm for detailed electron microscopic image in model group); B: macrophage counts. Mean±SD. n=6. **P<0.01 vs control group.图7 巨噬细胞超微结构
5.4 呼吸膜 对照组呼吸膜厚薄均匀、质地平滑、层次清晰;模型组呼吸膜结构破坏,可见断裂现象,显著增厚(P<0.01),且厚度不均匀,部分呈凸起状,以肺泡上皮基膜增厚与毛细血管基膜间隙增宽为主,见图8。
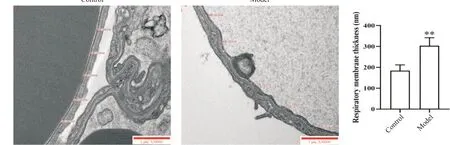
Figure 8. Ultrastructure of respiratory membrane. A: ultrastructure of respiratory membrane in control and model groups (scale bar=1 μm); B: analysis of respiratory membrane thickness in control and model groups. Mean±SD. n=9. **P<0.01 vs control group.图8 呼吸膜超微结构
讨 论
PF 是一种慢性、进行性的间质性肺疾病[13]。目前PF 的发病机制尚未完全明确,普遍认为是肺泡上皮细胞反复损伤及异常修复后,大量细胞因子及生长因子的释放,导致胶原过度沉积等病理改变[14-15]。患者出现进行性肺功能下降、呼吸困难甚至呼吸衰竭死亡,严重危害患者的心理健康和生存质量,给社会造成巨大的经济负担[16-17]。
动物模型是研究肺纤维化病理变化及新药研究的主要工具。BLM 诱导的肺纤维化模型以其良好的可重复性和易于诱导性,且能够重现PF 的许多表征,成为目前使用广泛的动物模型[18-20]。因此,基于文献及前期研究,本研究选择SD 大鼠,采用经口咽部无创一次性气管内滴注BLM(3 mg/kg)的方法诱导PF 模型[8],以造模后42 d 作为模型评价的时点,以评价模型的特点及稳定性。
本组研究资料显示,BLM 诱导42 d 大鼠出现肺组织中肺泡结构破坏,纤维条索形成,肺功能下降。肺组织超微结构显示,肺泡上皮、内皮细胞周围大量胶原纤维沉积,AEC II 表面微绒毛减少,Mi 肿胀,ER扩张,LBs 空泡化。在PF 发生发展中,AEC II 一方面通过上皮间质化获得间充质表型,分化为肌成纤维细胞产生大量细胞外基质(extracellular matrix,ECM),导致PF;另一方面AEC II 的上皮间质化导致肺泡上皮的修复能力降低并加速PF 的发展[21]。Mi功能障碍在PF 中出现较早且是上皮细胞损伤的标志之一,可导致AEC II 对应激不耐受[22-23]。同时AEC II 通过表面活性剂的产生和分泌维持有效的气体交换,表面活性剂储存于LBs 中,发挥保持表面张力、维持肺泡正常空间结构的作用[24],故LBs 是鉴别AEC II 分泌功能是否正常的最直接方法[25]。因此,本研究显示的PF 大鼠AEC II 周围大量胶原沉积,可能与上皮间质化有关;Mi作为细胞的能量中心,其数量减少及肿胀表明AEC II 的增殖及修复功能下降;LBs 减少及空泡化表明AEC II 对于表面活性剂的分泌功能降低,难以维持肺泡正常结构而致其塌陷或不张,与本研究CT表征一致。
电镜观察到PF 大鼠肺泡巨噬细胞数量增多,聚集在肺泡腔中,表明机体仍处于炎症状态,肺损伤较严重,巨噬细胞募集以驱动组织修复。巨噬细胞分泌巨噬细胞集落刺激因子进行自我维持,并产生血小板衍生生长因子亚基A、精氨酸酶1、基质金属蛋白肽酶13 等,同时大量表达促纤维化趋化因子,募集纤维细胞,促进纤维化形成。在巨噬细胞组织修复过程中,产生白细胞介素4等,促进巨噬细胞向M2极化[26]。
呼吸膜由肺表面活性物质的液体层、肺泡上皮细胞层、上皮基底膜、肺泡上皮与毛细血管膜之间的间隙、毛细血管基膜、毛细血管内皮细胞层构成,是维持正常气体交换的主要结构[27],PF 大鼠呼吸膜层次不清,边缘模糊,可能与肺泡上皮和内皮细胞结构破坏有关,呼吸膜增厚导致有效气体交换面积减少,因而出现肺功能下降。临床上表现为肺弥散功能下降可能与此有关。
可见,BLM 导致AEC II结构和功能受损,修复能力有限,合成和分泌的肺泡表面活性物质减少,肺泡结构塌陷。呼吸膜增厚,有效气体交换面积减少,影响肺通气功能,故出现肺功能下降。炎症细胞浸润,胶原纤维及细胞外基质沉积,片状纤维斑片出现,纤维条索形成,使肺组织硬度增加。
然而,PF大鼠CT影像表现与寻常型间质性肺炎(usual interstitial pueumonia,UIP)患者在基底及胸膜下出现纤维化的CT 表现稍有出入,可能与气管内滴注的诱导方式具有一定关系,并且部分PF 大鼠可见肺不张现象,可能因大量纤维沉积导致肺实变出现,进而出现肺痿废不用[28-31]。
总之,一次性气管内滴注3 mg/kg BLM 可成功诱导PF 模型。因BLM 的肺毒性导致的蜂窝样改变是间质性肺疾病的特征表现,亦出现特征性斑片状实质炎症、反应性上皮增生以及上皮-间充质转化、ECM 沉积等表现,与特发性肺纤维化(idiopathic pulmoanry fibrosis,IPF)的表现相似。因此,该模型可用于建立IPF模型[32]。然而,尽管该模型已被证实与临床纤维化发生的许多细胞及分子机制具有一致性,但仍存在许多局限性。从纤维化分布来看,临床UIP多以下肺近胸膜部为主[3],而诱导的PF 模型纤维化区域多集中在支气管周围,以肺门部较为严重;从疾病进程来看,诱导的PF 模型在诱导的前7 d 为初始炎症期,炎症消退后的纤维化期才与临床PF 表现相似[33];从可逆性来看,临床PF 为慢性、不可逆性疾病,而诱导的PF 模型通常具有自限性及可逆性[27];另外,临床PF 好发于中老年人群,衰老因素对疾病的影响较大,由于实验时间及条件的限制,诱导老年动物PF 模型的研究较少[34]。因此,进一步研究将致力于构建更为接近人类病理特征的PF动物模型。
