发动蛋白抑制剂dynasore的功能及在疾病治疗中的研究进展*
2024-01-17田振振宋银宏
田振振,陈 喆,朱 平,宋银宏△
[1肿瘤微环境与免疫治疗湖北省重点实验室(三峡大学),湖北 宜昌 443002;2三峡大学感染与炎症损伤研究所,湖北 宜昌 443002;3三峡大学基础医学院,湖北 宜昌 443002;4三峡大学第一临床医学院肾病内科,湖北 宜昌 443003]
发动蛋白(dynamin)超家族存在于所有细胞生命活动中,在胞膜构成、肌动蛋白束和先天免疫等方面发挥重要作用。发动蛋白作为该家族的主要成员,是一种多结构域的机械化学鸟苷三磷酸酶(guanosine triphosphatase,GTPase)蛋白,对鸟嘌呤核苷酸具有低亲和力、高基础水解率,能自组装成高阶螺旋结构[1],在包膜重塑、膜裂变和跨高尔基体出芽等作用中发挥着重要作用[2]。
在哺乳动物中,发动蛋白包含3 种经典发动蛋白(dynamin 1、dynamin 2和dynamin 3)和几种发动蛋白样蛋白,同源性约为80%[3]。在经典发动蛋白中,dynamin 1 有神经元特异性,与多种神经系统疾病有关,例如肌萎缩侧索硬化和阿尔茨海默病[4]。此外,在白血病、肺和结肠癌的肿瘤细胞中dynamin 1 表达上调[5];dynamin 2 在细胞中表达广泛,主要介导跨膜运输。研究显示,dynamin 2 可以促进胞质分裂、细胞增殖和迁移,在肿瘤细胞中过度表达[6];dynamin 3主要在睾丸、大脑和肺部低水平表达,是肿瘤抑制因子,通过诱导p53 蛋白激活和表达来抑制肿瘤发生[7]。dynamin 1、dynamin 2 和dynamin 3 各自具有独特的功能,但它们在内吞作用中可以相互代偿[3]。
发动蛋白样蛋白中研究较为深入的主要是高度保守的发动蛋白相关蛋白1(dynamin-related protein 1,DRP1),与线粒体分裂、抗癌药物介导的细胞毒性以及癌症进展有关。DRP1在阿尔茨海默病、帕金森病、亨廷顿舞蹈症、肌萎缩侧索硬化症、多发性硬化症、糖尿病和肥胖症等疾病中也发挥着重要作用[8]。
发动蛋白是研究细胞生命活动、微生物感染和神经系统疾病等方面的一个重要靶点[9]。常用的发动蛋白抑制剂包括dynasore、肉豆蔻基三甲基溴化铵(MiTMAB)、十八烷基三甲基溴化铵(OcTMAB)及Dynole™化合物等[3]。长链铵盐的MiTMAB 和OcTMAB 效果良好,能够可逆地抑制神经元和非神经元细胞内吞作用。Dynole 34-2 是一种新型抗有丝分裂化合物,专门作用于脱落阶段并选择性地靶向分裂细胞,对多种癌细胞具有致死作用。Dynago 是改进后的dynasore类似物,它能够极大减少在体外的非特异性结合,并同时提高抑制效率。dynasore 最早于2006 年被Macia 等[10]从16 000 个小分子中筛选出,在体内、外干扰发动蛋白dynamin 1、dynamin 2 和DRP1 的GTPase 活性,抑制发动蛋白的内吞作用,是目前研究较为深入的发动蛋白抑制剂之一,在生物医学领域被大量应用。本文以dynasore 参与疾病的分子机制和信号通路为基础,对dynasore在微生物感染、神经退行性疾病和肿瘤等疾病中发挥的作用进行综述。
1 dynasore的功能
内吞作用是细胞普遍存在的生理过程,协助细胞进行营养摄取、受体更新和细胞信号传导等活动[11],而发动蛋白介导是其中最重要的部分[10]。dynasore 通过抑制发动蛋白,参与细胞内多种信号通路,并且在不依赖发动蛋白的情况下,通过脱靶效应参与多种细胞信号传导[10,12](图1)。
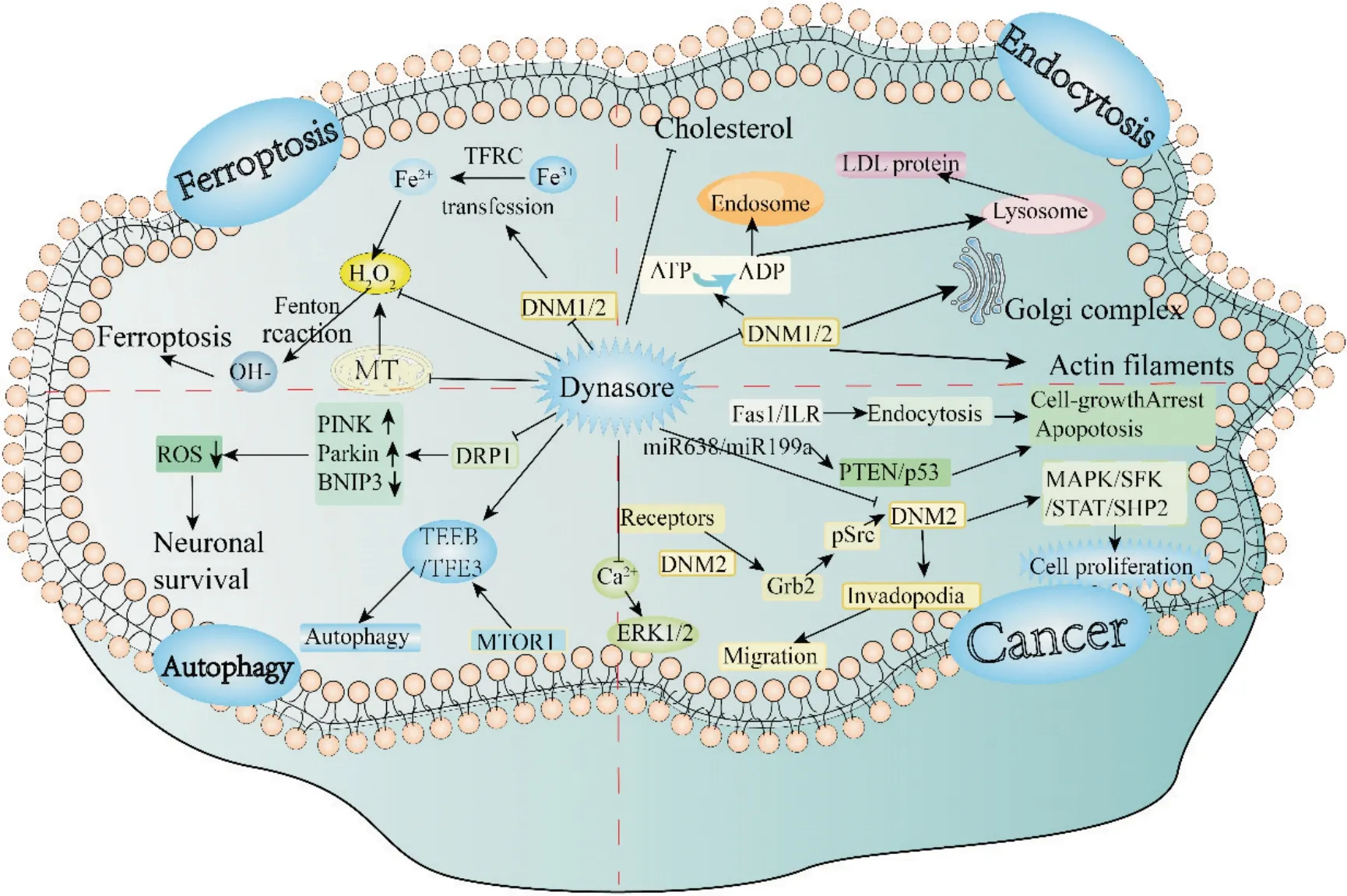
Figure 1. Schematic diagram about the mechanism of dynasore participating in intracellular signaling pathways. Dynasore participates in intracellular signaling pathway mechanism. DNM: dynamin; FasL: Fas ligand; MAPK: mitogen-activated protein kinase; ROS: reactive oxygen species; Grb2: growth factor receptor-bound protein 2; TFEB/TFE3: transcription factors EB/E3; MTOR1: mammalian target of rapamycin 1; MT: mitochondrion.图1 dynasore参与细胞内信号通路机制示意图
1.1 dynasore 抑制内吞作用 dynasore 是发动蛋白GTPase 活性的非竞争性抑制剂,以剂量依赖的方式抑制dynamin 1 或dynamin 2 的GTPase 活性,减少网格蛋白包被的凹坑和囊泡的形成,抑制内吞作用。研究证实,用dynasore 处理细胞可以在2 分钟内抑制网格蛋白介导的内吞作用,并且这种作用可以在20 min内通过去除抑制剂消除,对多个物种的细胞均起效[10]。除了抑制发动蛋白GTPase 活性外,dynasore对细胞胆固醇、脂筏和肌动蛋白也发挥相应效应,这些效应有些是依赖发动蛋白的,另外一部分则独立于发动蛋白[13]。
1.2 dynasore 介导的抗癌机制 dynamin 2 在大部分肿瘤细胞中过度表达,通过多种途径参与肿瘤细胞的迁移、侵袭和转移以及细胞的增殖和存活[14]。信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是肿瘤细胞增殖、存活和凋亡的关键调节因子,STAT3 的过度磷酸化表达与dynamin 2上调有关。研究显示dynasore可以抑制STAT3 通路抑制骨肉瘤细胞的增殖[15]。生长因子受体结合蛋白2(growth factor receptor-bound protein 2,Grb2)、凋亡相关因子(factor-related apoptosis,Fas)、人第10 号染色体缺失并与张力蛋白同源的磷酸酶(phosphatase and tensin homolog on chromosome ten,PTEN)和p53 蛋白等在细胞中的信号传导同样受dynamin 2 调控,dynasore 通过对dynamin 2 的抑制作用可以调控相关肿瘤信号传导[12,16],发挥抑制肿瘤细胞增殖的的作用。
1.3 dynasore抑制铁死亡进程 铁死亡指一种基于脂质的活性氧物质的积累引起的铁依赖性调节形式的细胞死亡,与多种病理进程有关,包括发育、肿瘤和神经变性[17-18]。研究显示,在完整的细胞中,dynasore 减少脂质活性氧(reactive oxygen species,ROS)积累,阻断线粒体超氧化物形成,抑制线粒体呼吸,减少线粒体ROS 的产生,保护细胞免遭铁死亡。在无细胞系统中,dynasore 具有自由基清除、抗氧化特性,可以作为ROS驱动型细胞死亡的高效抑制剂,通过阻断ROS 产生和脂质-ROS 驱动的细胞死亡两条途径,联合调节铁离子库和抑制ROS的产生[19]。
1.4 dynasore抑制线粒体自噬 线粒体自噬深度参与哺乳动物的分化、发育和多种类型的组织损伤,在肿瘤、神经变性、衰老和免疫反应中的发挥的作用已得到广泛认识[20]。DRP1 蛋白是维持线粒体动力学平衡、调节裂变、融合、线粒体自噬甚至运动的重要组成部分。它主要用作线粒体分裂因子,诱导线粒体分裂,但DRP1 蛋白下调时,会间接促进融合。DRP1 调节裂变可用于切除线粒体的受损部分以进行线粒体自噬,而DRP1 的减少会招募parkin 蛋白进行线粒体自噬。过度裂变或融合也会阻碍线粒体运输,其转录的下调或上调可用于测量线粒体动力学的增量变化[8]。dynasore 通过抑制DRP1,促进线粒体的分裂,并且在线粒体受损或老化时促进其进一步的降解。这种作用有助于维持线粒体的功能和质量,并且在细胞应激、代谢调节和疾病发生中具有重要的生理和病理意义。
1.5 dynasore 介导的血管内皮生长因子(vascular endothelial growth factor,VEGF)通路 VEGF 受体2(VEGF receptor 2,VEGFR2)是一种关键的血管生成受体,可以通过多种信号通路诱导肿瘤发生。在被VEGF 激活后,VEGFR2 通过dynamin 2 介导的内吞作用进入胞质内[21]。但有研究显示敲低或过表达发动蛋白不影响VEGF诱导的细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)的磷酸化,而dynasore明显降低ERK1/2的磷酸化,表明虽然dynasore 抑制VEGFR2 的内吞,但它在ERK1/2磷酸化中的抑制作用与VEGFR2 内吞作用的减弱无关,而是由于药物的脱靶效应——即dynasore可以抑制VEGF 诱导的钙释放,抑制ERK1/2 的磷酸化。由此可知,dynasore 通过抑制VEGF 通路参与细胞增殖、存活和凋亡相关生命过程[22]。
1.6 dynasore 介导的氧化应激保护作用 dynasore对氧化应激导致的眼表角膜细胞和细胞表面糖萼损伤具有显著的保护作用,减轻压力造成的损伤,防止屏障破坏和染料进入。其机制有三方面:一是dynasore靶向发动蛋白家族成员dynamin 2或DRP1,减轻线粒体断裂并阻断炎性物质的激活和炎性细胞因子的表达;二是dynasore 对质膜胆固醇、脂筏和肌动蛋白具有独立于发动蛋白的“脱靶”效应[23];第三是dynasore 通过维持未折叠蛋白反应和钙稳态来保护受到氧化应激的眼表黏膜上皮细胞,这也为dynasore作为新的眼表治疗药物提供了有力的支持[24-25]。
2 dynasore在疾病治疗中的应用
dynasore 能够干扰细菌内吞、诱导癌细胞凋亡、保护心肌细胞免受损伤,在微生物感染、肿瘤治疗和神经系统疾病等领域中的治疗作用正被研究开发。
2.1 dynasore在细菌性疾病中的抑制作用 细菌感染真核细胞需要内吞作用侵入进行,如福氏志贺菌在细胞间的传播取决于细菌的外膜蛋白与神经元Wiskott-Aldrich 综合征蛋白相互作用,后者募集肌动蛋白相关蛋白2/3复合物启动F-肌动蛋白聚合,使细菌能够在细胞内和细胞间传播。dynamin 2 是福氏志贺菌细胞间扩散的重要组成部分,dynasore 抑制dynamin 2 可以阻止福氏志贺菌的传播[26]。这种抑制机制在金黄色葡萄球菌、伤寒沙门菌和化脓性球菌中也被证实[27-28]。
2.2 dynasore 对病毒性疾病的疗效 dynamin 2 是巨细胞病毒感染早期病毒装配中心生成和初级内体/内循环室/高尔基体膜重排机制的一部分。在鼠巨细胞病毒感染的早期阶段,dynasore可以阻碍病毒装配中心的形成,抑制后期蛋白质的合成和病毒粒子的产生[29]。另有研究显示dynasore 以新型RAS 相关C3 肉毒杆菌毒素底物1(RAS-related C3 botulinum toxin substrate 1,Rac-1)、ROS 和线粒体抗病毒信号(mitochondrial antiviral signaling,MAVS)介导的信号级联反应,增强线粒体抗病毒信号聚集体的形成,激活不依赖内吞作用的核因子κB(nuclear factor-κB,NF-κB)[30-31]。dynasore 通过模拟病毒诱导这一关键炎症信号通路,显示出作为抗病毒治疗策略或疫苗佐剂的价值。
人类免疫缺陷病毒(human immunodeficiency virus,HIV)根据遗传特征和病毒抗原的差异分为1 型和2 型(HIV-1 和HIV-2)[32],与HIV-2 相比,HIV-1 的潜伏期更短,发病率更高,传播率更高,目前的研究主要是针对HIV-1 进行的[33-34]。研究证实HIV-1 是通过发动蛋白依赖性内吞作用进入细胞的,dynasore对几种常用细胞系中HIV-1 的感染产生抑制作用,并且dynasore 对HIV-1 感染的抑制作用不是由于网格蛋白依赖性内吞作用的阻碍,具体的分子靶标仍未明确[35-36]。通过抑制dynamin 2 介导的内吞作用,dynasore还抑制疱疹病毒、塞内卡病毒感染进入细胞内[25,37]。此外,通过软件模拟分析发现dynasore对冠状病毒2019(COVID-19)也有很好的抑制作用[38]。
2.3 dynasore对神经退行性疾病的缓解作用 自噬是一种重要的细胞蛋白调控过程,在神经退行性疾病发病机制中起着关键作用。神经退行性疾病的共同特征是自噬活性降低和蛋白质聚集异常。对自噬的药理调节有助于治疗神经退行性疾病[39]。研究显示dynasore 可以抑制哺乳动物雷帕霉素靶蛋白(mTOR)的溶酶体定位,阻断哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1,mTORC1)的活性,增强自噬主要调节因子(包括TFE3 和TFEB)的核转位,自噬通量在dynasore 处理后的细胞中上调。此外,dynasore的处理显著促进了由含有扩展聚谷氨酰胺(polyglutamine,polyQ)的突变亨廷顿蛋白形成的蛋白质聚集体的清除。相比之下,在自噬缺陷的细胞中,dynasore 对突变亨廷顿蛋白的polyQ聚集体的清除无明显作用。因此dynasore可以通过调节mTORC1-TFEB 信号传导影响神经退行性疾病相关蛋白的自噬降解[40]。另外,DRP1 是介导线粒体裂变和影响神经元线粒体自噬的关键调节因子,抑制DRP1改善运动缺陷和帕金森模型小鼠体内的酪氨酸羟化酶的表达,上调PTEN诱导推定激酶1(PTEN-induced putative kinase 1,PINK1)和parkin蛋白的线粒体表达,但不影响Nip 样蛋白X(Nip-like protein X,NIX)和BCL2 相互作用蛋白3(BCL2 interacting protein 3,BNIP3)的表达,改善了线粒体超微结构并恢复帕金森患者的线粒体稳态[39]。脊髓损伤(spinal cord injury,SCI)是一种常见且具有破坏性的中枢神经系统损伤,缺乏有效的治疗方法。另有研究显示,腹腔注射dynasore 处理SCI 大鼠后,显著改善了运动功能,dynasore组凋亡神经元和增殖星形胶质细胞减少,存活神经元细胞数量显著增加,证实了dynasore 抑制 DRP1,在大鼠患有SCI 后发挥有效保护作用[41]。
2.4 dynasore 在肿瘤治疗中的潜力 dynasore 是一种候选的有效抗癌药物,通过抑制内吞作用、破坏肌动蛋白稳定性和靶向降低dynamin 2 干预肿瘤细胞中的信号传导来降低肿瘤细胞的迁移和侵袭[42]。虽然dynasore尚未用于临床治疗,但其在基础科学研究中已经表现出良好作用[43]。
肺癌是全世界肿瘤疾病中发病率和死亡率最高的癌种之一,肺癌经常检测到表皮生长因子受体(epidermal growth factor receptor,EGFR)突变,导致该受体酪氨酸激酶持续活跃,已证明针对EGFR 的靶向治疗对于肺癌治疗有效[44]。dynasore 有效地抑制EGFR 外显子19 缺失突变体,对外显子19 缺失的EGFR 突变体驱动的肺癌细胞系的细胞增殖、集落形成、细胞迁移和细胞周期进程有明显抑制作用[45]。肺癌与线粒体融合和裂变失调有关,DRP1的抑制会减少肺癌细胞的增殖并增加其凋亡[46]。顺铂是肺癌临床治疗的一线化疗药物。然而,顺铂易引起耐药,降低了临床疗效[47]。顺铂增加线粒体分裂和dynamin 2 表达,而dynasore 具有相反的效果。顺铂和dynasore均独立诱导线粒体氧化应激,导致线粒体功能障碍、细胞增殖减少和细胞凋亡增强。但是二者联合使用时dynasore 增强了顺铂的抗癌作用[48]。dynasore 还可以通过STAT3 信号通路抑制细胞增殖、迁移和侵袭,并增强顺铂在骨肉瘤中的抗肿瘤能力[15]。
细胞间质上皮转换因子(cellular mesenchymal epithelial transition factor,c-Met)是一种受体酪氨酸激酶,对肝细胞生长因子具有高亲和力,在细胞中与磷脂酰肌醇3-激酶和黏附斑激酶发生级联反应,有助于肿瘤细胞形态发生、存活和增殖[49]。c-Met 受体在肝癌中表达增加,被用于小分子酪氨酸激酶抑制剂进行药理学干预的靶标[50]。研究dynasore 与几种c-Met 抑制剂的联合作用显示dynasore 增强这些抑制剂对肝癌细胞增殖和迁移的抑制作用[51]。研究证明阻断急性髓系白血病中的发动蛋白依赖性内吞作用(dynamin-dependent endocytosis,DDE)可以有效地阻止多种生长因子刺激的信号通路的激活,对阻止肿瘤进展有重要意义,DDE 抑制剂对急性淋巴细胞白血病和急性髓系白血病的治疗有效[52]。上述研究显示dynasore不但本身具有抗癌作用,与其他抗癌药物的联合使用也具有良好效果。
2.5 dynasore 在其他疾病治疗中的应用 2 型糖尿病的特征是线粒体功能障碍、高水平的ROS 产生和低ATP 水平等。dynasore 可以防止氧化应激和线粒体分裂,提高心肌细胞在缺血/再灌注条件下的存活率。dynasore 还可以在氧化应激条件下维持线粒体功能和形态,提高ATP 水平,从而预防心脏衰竭并减少细胞损伤[53]。以上研究表明dynasore 在治疗糖尿病患者以及心血管并发症方面发挥重要作用[54-57]。
dynasore在疾病治疗中作用的总结见表1。

表1 dynasore对不同疾病的作用Table 1. The effect of dynasore on different diseases
3 dynasore的不良反应
与许多小分子抑制剂一样,dynasore具有不良的非特异性结合,其与血清蛋白和常用的去垢剂Tween-80 会发生非特异性结合,失去动力抑制功能,限制了其在实验中的使用[58-59]。dynasore 除了抑制发动蛋白外,还具有广泛的脱靶效应。在dynamin 1、2 和3 三重条件敲除小鼠成纤维细胞中,dynasore不仅能抑制网格蛋白介导的内吞作用,还能抑制液相内吞作用,而其预期靶标dynamin 已被消除,证明了脱靶效应。dynasore 对膜波纹也有强大的阻断作用,并且这种作用也不依赖于dynamin[60]。因此应谨慎给出dynasore结论性评估。
4 结语与展望
综上所述,dynasore 在细胞的生命活动、信号传导和分化发育中,通过介导内吞作用、铁死亡和线粒体自噬等发挥关键调节作用,并能够积极治疗多种疾病。然而,dynasore的靶点dynamin 1、dynamin 2和DRP1在细胞活动中也具有重要作用,对其相关不良反应要重点关注。未来的研究方向应着重于更具靶点特异性的dynasore 类似物研发,进一步优化dynasore 的结构,提高其抑制效率和安全性,并进一步探索dynasore和一线治疗药物的联合使用效果,以实现最优的治疗效果。
