1-磷酸鞘氨醇调控血管功能在动脉粥样硬化中的研究进展*
2024-01-17施媛萍
吴 婧,施媛萍
(苏州大学附属第三医院临床医学研究中心,江苏 常州 213003)
在日常生活中,高血压、代谢综合征、吸烟和缺乏运动等条件可能诱发血管内皮细胞障碍[1],具体表现为内皮舒张功能受损、血管通透性增加、氧化应激和炎症等病理现象[2],正常内皮细胞的一个关键功能是防止血管黏附,内皮屏障异常导致内膜中形成包括各种细胞、脂质和组织碎屑在内的斑块,推动动脉粥样硬化的发展[1]。以往研究表明,1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)和伴侣蛋白通过激活S1P 受体(S1P receptor,S1PR)开启下游信号通路,在多方面调控血管功能,通过药物介导S1P 的代谢过程可改变血管内皮细胞的状态,从而影响动脉粥样硬化进程。本综述将具体阐明S1P 及其伴侣蛋白的相互关系,以及它们在稳定血管屏障中发挥的功能和具体机制。
1 S1P来源、代谢及功能
1.1 S1P 的来源及代谢 S1P 来源于磷脂,在鞘磷脂代谢途径中,由神经酰胺经神经酰胺酶裂解形成鞘氨醇后,再经鞘氨醇激酶(sphingosine kinase,SPHK)磷酸化产生[3]。在机体健康的情况下,血浆S1P 主要由红细胞和内皮细胞分泌,在病理状态下,血小板也参与分泌[4]。S1P 在胞内形成后由特定转运蛋白快速转运至细胞外环境,通过自分泌或者旁分泌的方式,激活自身细胞或其它细胞表面特异性G 蛋白偶联受体,对靶细胞功能进行调节[5]。红细胞和血小板细胞中输出S1P的转运蛋白为Mfsd2b (major facilitator superfamily transporter 2b),而内皮细胞中为鞘脂转运蛋白2(sphingolipid transporter 2,Spns2)[6]。细胞输出S1P 后,磷脂转运蛋白(phospholipid transfer protein,PLTP)可转运血浆中S1P 至脂蛋白颗粒,过表达PLTP 改变S1P 在不同脂蛋白类型中的分布情况[7]。由于S1P 在胞内易被内质网驻留的S1P 裂解酶(S1P lyase,SPL)迅速降解,另有部分被内源性S1P 磷酸酶(S1P phosphatase,SPP)去磷酸化形成神经酰胺,还可以被转运体转运至细胞外,因此导致细胞内S1P浓度非常低[5]。
S1P 水平的调控主要依靠SPHK、SPL 以及SPP间的平衡,SPHK1 或SPHK2 磷酸化鞘氨醇产生S1P。SPHK1是负责S1P合成的主要酶,产生的S1P主要定位于细胞内或分泌到细胞外基质[8-9],由SPHK2 产生的S1P 则定位于细胞核[10]。SPL 不可逆地降解S1P,它是S1P分解代谢过程中重要的酶,缺乏SPL可诱导炎症反应[3,11]。SPP1、SPP2 是定位于内质网的鞘脂特异性磷酸酶,SPPs 或脂磷酸磷酸酶(lipid phosphate phosphatases,LPP)可逆地去磷酸化S1P,LPP可在胞外发挥作用,进一步调控S1P的水平[2,12]。
1.2 S1P 生理功能 在发育、生理和病理环境中,S1P 具有多种功能。胞外S1P 主要存在于血液中,由于凝血过程中血小板释放了S1P,血清S1P 水平比血浆高2~3 倍[13]。淋巴中的S1P 浓度大约相当于血浆水平的25%[14],组织间液中S1P 浓度处于更低水平[15],因此产生了跨生物区室的S1P 空间梯度。S1P在血液和淋巴中的水溶性不高,在胞外它需要与各种伴侣蛋白质分子结合,以便在胞间转运并接近靶细胞表面受体[13]。S1P 梯度严格地控制造血细胞和免疫细胞的转运,对于维持内皮细胞屏障功能、淋巴细胞从淋巴结和胸腺中排出至关重要[16]。在血管系统中,S1P 有助于维持血管中的机械转导,稳定血液流动对血管产生的摩擦阻力,保护内皮屏障[17]。S1P梯度机制确保血管外细胞暴露于低水平的S1P,防止巨噬细胞、肥大细胞、基质成纤维细胞等被S1P 持续激活[18]。除了胞外作用,S1P 还可在胞内发挥功能,已有研究报道了S1P 可与细胞内靶标,如过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)和组蛋白去乙酰化酶结合,从而调节细胞的转录活性[10,19]。
除了体内的S1P 梯度外,S1PR 的空间分布是S1P在心血管系统中多功能作用的主要决定因素[20]。在哺乳动物中,S1PR1-3 存在于所有组织中,且S1PR1占主导地位,与其他S1PR相比,S1PR1对配体介导的受体内化更敏感,细胞表面S1PR1 水平是细胞S1P暴露状态的一个指标[21],S1PR4在淋巴组织和肺中高表达,S1PR5 存在于自然杀伤细胞和中枢神经系统中[22]。S1P 与S1PR 结合时,S1PR 相关G 蛋白磷酸化启动胞内信号传递,诱导S1P-S1PR 复合体内化[23],调节广泛的生理功能,例如:S1PR1 和S1PR2介导血管系统的生成与成熟、血管通透性调节;S1PR2 介导血压调节、组胺清除和过敏反应恢复;S1PR1 和S1PR5 介导免疫细胞从淋巴器官排出;S1PR1 和S1PR4 介导细胞因子产生等[3]。有研究表明,血管细胞中S1PR 在基因表达水平上是动态调节的,与静止的血管相比,S1PR1 的表达在肿瘤血管内显著增强,用siRNA 技术抑制新生血管上 S1PR1 的表达,可有效抑制体内肿瘤生长[24]。
2 S1P伴侣蛋白
2.1 载脂蛋白M(apolipoprotein M,ApoM) ApoM是S1P 主要的伴侣蛋白,ApoM 的疏水骨架和头部极性磷酸基团可限制S1P 的膜通透性,S1P 与伴侣蛋白结合后顺利实现信号转导[25]。ApoM 分子的疏水结合区口袋可结合S1P 并保护其免受降解,且ApoM 在脂蛋白中对高密度脂蛋白(high-density lipoprotein,HDL)更有偏向性[23],可介导HDL 的多种独特的S1P依赖性作用,如保护血管功能[26]。研究证明,ApoM不仅是S1P 的载体,而且还刺激S1P 含量增加,以调节体内S1P的稳态[27]。ApoM单核苷酸多态性与动脉粥样硬化有关,缺乏ApoM的小鼠血浆中S1P 含量降低约50%[28]。
ApoM 与S1P 结合形成ApoM-S1P 复合物,再依靠S1P 特性与靶细胞表面特异性S1PR 结合,调节下游分子的磷酸化水平,形成级联放大效应,平衡血管屏障的稳态和糖脂代谢(表1)[1]。ApoM-S1P 复合物与靶细胞S1PR 特异性结合后开启下游信号传递[29],Miura 等[30]研 究 表 明,HDL 相关的S1P通过激活MAPK 级联促进内皮细胞管状结构的形成,诱导Akt和MAPK 磷酸化保护内皮屏障,但在高糖条件下,S1PR2 通过PI3K/Akt 途径介导内皮细胞功能障碍[31]。Liu 等[32]证明ApoM 将S1P 传递给S1PR,从而激活PI3K/Akt/mTOR 信号通路,抑制核因子κB(nuclear factor-κB,NF-κB)的核转位,抑制多种促炎因子的表达水平,减轻TNF-α 诱导的人脐静脉内皮细胞损伤和炎症。

表1 ApoM-S1P复合物结合各受体靶点产生的下游机制及功能Table 1. The downstream mechanism and function of ApoM-S1P complex binding to each receptor target
2.2 白蛋白及其他伴侣蛋白 约有65%的S1P 存在于HDL 颗粒中,与HDL 中ApoM 组分结合,另有约30%的S1P存在于白蛋白中,还有极少量的S1P结合于极低密度脂蛋白(very low-density lipoprotein,VLDL)或低密度脂蛋白(low-density lipoprotein,LDL)[33],另外,在缺失ApoM 和白蛋白的情况下,S1P还可与其他载脂蛋白如ApoA4 结合[34]。白蛋白与ApoM 具有相似的递送S1P 功能,但ApoM 递送S1P比白蛋白递送更具有保护屏障和抗炎作用[35],表明ApoM 载体更有利于S1P 受体的激活和信号传导。体外研究表明,HDL-S1P 与白蛋白-S1P 都能刺激细胞内酶的激活等短期反应,而在调节细胞存活率等长期功能方面,HDL-S1P 更占优势[29],且HDL-S1P 比白蛋白-S1P 相对稳定性更高,HDL-S1P 的半衰期约为白蛋白-S1P 的4 倍[2]。另外,白蛋白与ApoM 相比具有下调S1PR 表达的特殊作用,白蛋白-S1P 激活受体后诱导S1PR 表达下调,抑制S1P 对血管的进一步刺激作用,S1PR1 内吞过程由G 蛋白偶联受体激酶2、发动蛋白和膜突蛋白精确控制[36]。ApoM-S1P 减少S1PR1的降解,促进细胞表面受体循环[37]。
3 S1P对血管功能的调节
内皮细胞屏障对于血液和周围组织之间液体和溶质的选择性运输至关重要[38]。内皮屏障功能损伤诱导急性炎症性疾病发生,可促进癌细胞的侵袭、转移或导致动脉粥样硬化发生[39-40]。血管内皮障碍表现为血管通透性改变、血管生成异常、血管舒张-收缩失衡等。
3.1 S1P 调节血管通透性 S1P 根据其浓度对血管通透性产生不同的影响,在生理条件下,S1P 保护血管内皮屏障,刺激细胞产生小G 蛋白Rac-1依赖的屏障保护作用,而在高浓度时,S1P 将介导小分子G 蛋白RhoA 依赖的屏障破坏作用[2]。内皮细胞间稳定连接的特点是Cdc42 和Rac1 的基础活性大于RhoA[41]。研究表明在S1PR 中,S1PR1/RAC 是S1P屏障保护作用的关键信号因子[42],S1PR2、S1PR3 和下游Rho被激活后血管通透性增加[2],导致血管屏障损伤。S1P 结合S1PR1 可增强血管内皮细胞之间含有钙黏蛋白的黏附连接的组装,从而抑制异常的血管通透性[43]。另外,S1P激活S1PR1通路可减弱凝血酶的作用,有助于保护血管屏障[41]。而在高糖诱导的体外内皮功能障碍的细胞模型中,S1P抑制内皮一氧化氮合酶(endothelial nitric oxide synthase,eNOS)活性,增加血管通透性,诱导内皮细胞障碍[44],这一结果可能与S1P浓度以及结合的S1PR有关。
伴侣蛋白在S1P 调节血管通透性过程中有重要作用,ApoM基因敲除小鼠肺血管通透性增加40%,后续用ApoM-S1P 复合物进行血浆重建,或用S1PR1受体激动剂处理可降低肺通透性[45],内皮细胞特异性缺失S1PR1 将导致小鼠肺血管通透性增加[46],表明内皮细胞ApoM-S1P 复合物联合S1PR1 参与控制肺血管通透性。
3.2 S1P调节血管生成 血管通透性的改变与出生后血管生成异常有关[47]。血管生成主要发生在胚胎发育期间,缺氧诱导因子(hypoxia-inducible factor,HIF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)在缺氧组织中被激活,从原有血管的基础上生成新血管,内皮细胞中S1PR 通过封闭内皮屏障来抑制VEGF 的过度信号传递,终止血管萌发[48],有研究结果显示,S1PR1基因敲除小鼠胚胎的多个部位出现内皮过度出芽表型,胚胎S1PR1缺失导致主动脉异位分支过多[49]。S1P-S1PR1 信号形成黏附连接和细胞-细胞外基质黏附以维持血管稳定[50],从而形成血管屏障[36]。血管过度生成将诱导癌症和其他疾病发生[51]。
3.3 S1P 调节血管舒张和收缩 HDL 对血管舒张与收缩起着调节作用,S1P 可显著增强这种作用[52]。S1P 结合不同的S1PR 类型介导不同的血管生理反应,S1P 激活内皮细胞中的S1PR1/3 信号促进内皮依赖性血管舒张。有研究证明,与HDL 相关的S1P 诱导eNOs 生成NO,从而促进血管舒张,他汀类药物如辛伐他汀和匹伐他汀上调内皮细胞S1PR1 的表达,增加eNOs的活性[29]。相反,S1P浓度较高时,在内皮损伤的条件下,血管平滑肌细胞中表达S1PR2/3 介导血管收缩[2]。研究显示,S1PR2基因敲除小鼠局部血管的血流量增加,血管阻力降低[53]。S1PR3 诱导血管收缩还是舒张效应取决于不同的血管床[21]。
4 S1P对动脉粥样硬化的影响
4.1 S1P 影响动脉粥样硬化 S1P 在机体调节动脉粥样硬化过程中具有重要作用,动脉粥样硬化是一种血管增生性疾病,其特点是凝血级联的激活和血小板活化,这两个过程都提高了局部S1P 浓度,S1P则将凝血因子系统与血管炎症联系起来[54]。异常或受损的内皮细胞生成NO 及活性氧簇(reactive oxygen species,ROS)比例失衡,eNOs解偶联导致ROS过度生成[55]。ROS 可导致LDL 氧化形成oxLDL,oxLDL诱导内皮细胞过表达炎症因子如黏附分子,使血管通透性增强和内皮舒张过程受损,导致穿透内膜的脂质颗粒积聚形成斑块,随后形成血栓,血管壁增厚并硬化,促进动脉粥样硬化形成[56]。S1P 通过下调NF-κB 活性以抑制血管细胞黏附分子1 和细胞间黏附分子1 等黏附分子在内皮过表达[57]。经研究证实,在LDLR-/-小鼠中使用特异性S1PR1 激动剂KRP203 治疗,与对照组相比,KRP203 治疗后内皮细胞黏附因子表达下降,显著减少了早期和晚期动脉粥样硬化病变[58]。
单核细胞在血管聚集后分化形成巨噬细胞,巨噬细胞的凋亡促进了坏死核心的发展,从而增加了血管斑块的脆弱性[59]。Feuerborn等[60]研究表明,S1P可以抑制巨噬细胞凋亡,抑制动脉粥样硬化斑块的发生。另外,S1P 可诱导巨噬细胞极化以减轻oxLDL诱导的脂质积 累 的能力[61]。S1P 当通过S1PR1 和S1PR3 介导时,其作用主要是抗动脉粥样硬化,阻止单核细胞衍生的巨噬细胞在动脉壁募集的有害作用,减轻动脉粥样硬化病变程度[56],而当通过S1PR2介导时产生的作用通常相反[62-63]。在动脉粥样硬化内皮损伤区域中,炎症细胞因子和机械流动应力作用于血管内皮细胞时,将显著提升S1PR2 的水平[64]。S1PR2 一般被认为促进动脉粥样硬化进程,但也有研究显示巨噬细胞中的S1PR2-G12/13 信号轴上调保护性B淋巴细胞数量以改善动脉粥样硬化[65]。
4.2 伴侣蛋白增强S1P 功能 HDL 主要通过胆固醇逆向转运来降低动脉粥样硬化风险[66],HDL 逆转运胆固醇过程受到S1P的影响,内源性S1P的产生和信号转导是ABCA1 介导的胆固醇外排的主要调节因素[67]。S1P 伴侣蛋白ApoM 是HDL 的重要因子,ApoM 可增 强HDL 胆 固醇 外 排和 抗 氧化 作 用[32]。Christoffersen 等[68]证实,人体血浆中约有5%的HDL颗粒含有ApoM,携带ApoM 的HDL 颗粒比其他HDL颗粒含有更多的胆固醇。在体外研究中,ApoM 还可能影响LDL 氧化过程,含有ApoM 的HDL 比不含ApoM 的HDL 能更有效地阻止Cu2+诱导LDL 氧化为oxLDL,从而抑制动脉粥样硬化形成[69]。
有研究探讨了ApoM 结合的S1P 和内皮来源游离的S1P 的血管功能的差异,结果表明ApoM 的缺失会同时影响到S1P 效能的正常发挥,导致血管通透性增高,导致血管炎症和动脉粥样硬化,而ApoM 水平的升高可以减缓疾病的进展[28,70]。ApoM 过表达会携带更多的S1P,增强S1PR1 的表达,将结合信号正反馈给下游通路,从而起到保护血管内皮细胞的作用,ApoM 还可以将S1P 经血浆室运输到内皮细胞和免疫细胞来减轻动脉粥样硬化[71]。
5 总结与展望
动脉粥样硬化由多种因素诱发,已有大量研究对动脉粥样硬化形成的分子机制进行阐明,并通过调控中间代谢物质干预动脉粥样硬化的发展,从而降低该病的患病率。虽然动脉粥样硬化的深层致病机制有待进一步研究,但经广泛研究已证实S1P 及其伴侣蛋白如ApoM、白蛋白在动脉粥样硬化中具有重要作用。S1P 与伴侣蛋白结合并相互促进功能发挥,S1P在调节血管生成、内皮细胞通透性、血管张力等方面均具有重要作用,其功能异常将导致内皮功能障碍,形成动脉粥样硬化斑块,最终导致血管闭塞和血栓的生成(图1)。
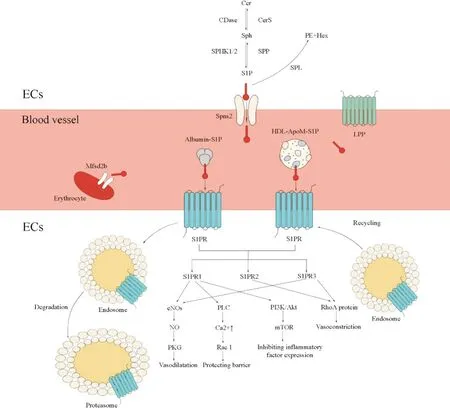
Figure 1. The metabolic mechanism of S1P and its chaperone proteins in vascular barrier. After being generated in endothelial cells or erythrocytes,S1P enters blood vessels through specific transporters,binds to chaperone proteins and acts on S1P receptors on the surface of endothelial cells,then opening a variety of downstream pathways and regulating vasoactivity. Cer: ceramide; Sph: sphingosine; S1P: sphingosine-1-phosphate; Cers: ceramide synthase; CDase: ceramidase; SPP: S1P phosphatase; SPHK1/2: sphingosine kinase 1/2; PE: ethanolamine phosphate; Hex: hexadecenal; SPL: S1P lyase;Spns2: sphingolipid transporter 2; Mfsd2b: major facilitator superfamily transporter 2b; LPP: lipid phosphate phosphatase; HDL: high-density lipoprotein; ApoM: apolipoprotein M; S1PR: S1P receptor; NO: nitric oxide; eNOS: endothelial NO synthase; PKG: protein kinase G; PLC: phospholipase C; Rac1: ras-related C3 botulinum toxin substrate 1; PI3K:Phosphatidylinositol 3 kinase; Akt: protein kinase B; mTOR: mammalian target of rapamycin.图1 S1P及其伴侣蛋白在血管屏障中的代谢机制
现有研究主要阐明伴侣蛋白与S1P 相互结合并放大二者共有的抗动脉粥样硬化效应,但作为重要效应大分子,S1P分子结合伴侣蛋白在血管系统中潜在的分子作用机制仍有待进一步研究,如ApoM、白蛋白等大分子作为伴侣蛋白除了携带S1P 的主要作用外是否还有更多增强S1P 功能的途径;S1P 结合S1PRs 产生的下游信号对心血管功能有时会产生矛盾的结果,因此需要对S1P 的信号转导过程进行更深入地探讨,将复杂的信号网络联系起来,全面研究S1P 的作用。此外,鉴于S1P 结合伴侣蛋白在调控血管功能方面具有重要作用,往后研究可对S1P 结合伴侣蛋白并传递至血管细胞内的效率进行探讨,从结合及传递方式的角度提升效率,最大限度地发挥S1P对心血管功能的有益调节作用。
