基于核心素养的高中化学探究性实验教学探索
2024-01-17毛海红洪兹田
毛海红 洪兹田


摘 要:倡导增进学科理解的教学是核心素养视域下促进课堂转型的应然要求,而探究性实验教学立足学科本源,将实验作为撬动教与学方式转变的重要支点。以人教版必修二“化学反应限度”的教学为例,探索基于探究性实验增进对“可逆反应”的理解。通过将实验探究与问题驱动、活动环节有效融合,提高学生基于探究实验情境解决真实问题的能力,进而增进学科理解、构建素养为本的思维课堂。
关键词:高中化学;探究性实验;核心素养;学科理解;可逆反应
1 问题的提出
素养为本的教学强调精选学科内容,使课程内容结构化、情境化。从“素养为本”的教学实际出发,掌握学科的核心内容、理解学习的过程是课程层面与教学层面理解的基础,是落实立德树人根本任务。基于学科理解视角,开展以生为本的探究性实验教学,强化了学生学科思想的形成及学科能力的培养,提升了学生的学科核心素养。
探究性实验教学活动,可使学生主动参与课堂学习,进行积极思考和探索,认真操作和实践,利用已有的化学知识和实验基本操作技能,引导学生构思和设计实验,并对化学知识和实验技能进行相互转化,呈现可行的实验方案来实现化学实验的目的和要求需要,从而进行培养学生核心素养目标的课堂改革[ 1 ]。基于对化学学科内容的认识视角与认识思路不同,将具体的实验探究内容与与教师引导有效结合,增强学生运用已有知识解决问题的能力,体验化学知识原理、思维方式在生产生活实际问题中的广泛应用。
2 探究性实验的核心素养功能[ 2 ]
2.1 培养“宏观辨识与微观探析”素养
探究性实验教学可强化学生利用宏观与微观、现象与本质相结合的方法分析和解决化学问题。例如,通过FeCl3溶液与KI溶液的试管实验,引导学生从宏观现象入手,分析微观过程,进而建立可逆反应的概念和反应模型,通过直观的现象,加深对可逆反应特点的认识,培养“宏观辨识与微观探析”的素养。
2.2 培养“变化观念与平衡思想”素养
探究性实验让学生真实参与到实验的探究、讨论分析过程中,动手实践,使抽象的概念可视化,切身经历知识的形成,进一步了解化学变化的本质特征,从不同角度认知化学反应,培养学生“变化观念与平衡思想”的素养。
2.3 培养“证据推理与模型认知”素养
探究性实验教学体现了“学为主体,教为主导”的理念。例如,可通过颜色变化、电流值的变化理解可逆反应,帮助构建化学平衡的模型,通过“宏观—微观—曲线—符号”四重表征理解化学反应的限度,帮助学生从多角度直观地进行概念的建构,培养学生“证据推理与模型认知”的学科核心素养。
2.4 培养“科学探究与创新意识”素养
探究性实验是指在教师的引导下,以学生为主体的实验教学策略。探究性实验教学活动使得学生的学习过程由被动接受变为主动参与、积极探究,但前提是学生能够预习、产生疑问,通过提出问题、设计实验、进行实验、收集证据、得出结论和反思总结等过程,获得认知,最终升华为科学探究與创新意识素养的提升。
2.5 培养“科学态度与社会责任”素养
探究性实验教学活动中所使用的药品和用量都必须严格按照要求进行,如果出现操作失误,可能会导致实验失败。这就需要学生自行分析失败原因,并对实验操作过程进行改进,从而培养学生实事求是的科学态度和严谨的科学精神。同时,实验过程中应绿色环保,尽量不污染环境,从而培养学生的社会责任。
3 探究性实验的教学模式
探究性实验的教学模式如图1所示。
4 探究性实验的教学实施——以“化学反应限度”教学为例
4.1 探究性实验教学的基本程序[ 3 ]
4.1.1 确定内容
以人教版必修二“化学反应限度”的教学为例,学生初次学习化学反应限度,重点在于对可逆反应的理解。在选修四《化学反应原理》的第二章第三节中重点通过可逆反应进行化学平衡模型的建构,进一步对化学平衡和影响平衡的因素进行认识,深化化学平衡原理。另作为本节内容,可对化学平衡的实际应用产生指导价值,同时深化对化学反应限度的理解和应用。
4.1.2 提出问题
从完全反应到可逆反应,学生的认知能力和实验能力会进行一次较大的跨越。在此过程中,实验探究是学习和理解可逆反应的重要途径,宏观实验现象与微观曲线图承载的功能截然不同。如何使学生运用实验进行探究、建立认知模型、运用模型解释化学现象等是本节课教学中重点要解决的问题。
4.1.3 设计方案
通过反应“2Fe3+ + 2I-?葑2Fe2+ + I2”,观察宏观现象(如:溶液颜色变化)与微观现象(如:电流方向的变化),让学生认识可逆反应以及可逆反应的特征,并进一步体会化学反应中限度的广泛存在,引导学生初步建立平衡的思想,让学生在探究性实验教学中深刻感受发现与分析问题、思考与解决问题的过程。
4.1.4 实验验证
基于对核心素养的理解与探究性实验教学进行整合,将学生带入实验,激发他们的学习兴趣,使他们能够积极主动地利用实验现象进行思考与质疑、分析与推理,最终解决问题。
4.1.5 得出结论
进行“定性实验”与“定量实验”相结合,加深学生对于可逆反应的理解,帮助建构化学平衡的模型,通过“宏观—微观—曲线—符号”四重表征理解化学反应的限度,帮助学生从不同角度进行概念建构。
4.1.6 实践应用
通过对可逆反应相关实验的探究性教学,知道可逆反应有一定限度。学生可将探究成果应用到生活实践中,有利于强化化学学科理解的探究性实验教学成果。
4.2 素养目标达成
从宏观实验现象入手,设计问题,分析问题,产生新的疑问,呈现微观电流方向变化曲线,得到实验现象背后的本质,并用离子反应方程式进行符号表征。学会将宏观与微观、现象与本质相结合的方法运用到实验所产生的现象中,从而发展“宏观辨识与微观探析”素养。
在对可逆反应进一步的实验探究教学中,自主发现问题,做出有依据的假设,通过实验现象,收集证据,书写离子反应方程式,建构认知模型,发展“证据推理与模型认知”素养。
4.3 教学简要流程
简要的教学流程如图2所示。
4.4 教学实施过程[ 4 ]
4.4.1 初步实验,引起思考
实验探究1:FeCl3溶液和KI溶液发生如下反应:2Fe3+ +2I- → 2Fe2+ + I2,请思考该反应是否为可逆反应?
实验药品:1 mol/L KI溶液、1 mol/L FeCl3溶液、CCl4、KSCN溶液等。
实验仪器:量筒、试管、胶头滴管等。
小组进行交流与讨论,设计实验可行方案。
分组实验:在试管中加入约10 mL 1mol/L KI溶液,再加入约1 mL 1 mol/L FeCl3溶液,充分反应后加入等体积的CCl4溶液,振荡且静置,在上层液中滴加硫氰化钾溶液,观察现象。
实验现象:分层;下层为紫红色;上层变血红色。
设计意图:经历该实验过程,让学生在实验中观察,在观察中分析问题,发展学生“科学探究与创新意识”的核心素养。
4.4.2 引发思考,提出问题
问题1:为什么CCl4层会变成紫红色,上层液滴加硫氰化钾会变血红色?
教师指导学生从实验现象分析实验产物,确定2Fe3+ + 2I- ?葑 2Fe2+ + I2是可逆反应。结合以上两点定性了解可逆反应。
问题2:究竟是Fe3+ 没有充分反应,还是反应逆向进行?
教師引导学生思考,引出下一个探究性实验。
设计意图:通过实验所产生的宏观现象,引导学生进行分析,培养学生的分析能力,同时要求学生注意发现实验中存在的问题。
4.4.3 实验探究,方法渗透
实验探究2:能否从定量的角度更直观的“看出”可逆反应的正向、逆向进行?
实验药品:0.1 mol/L FeCl2溶液、1 mol/L KI溶液、1 mol/L FeCl3溶液、碘单质、琼脂、饱和KCl溶液。
实验仪器:U形管、石墨电极、微电流传感器、数据采集器、计算机。
分组进行交流与讨论,设计实验方案。
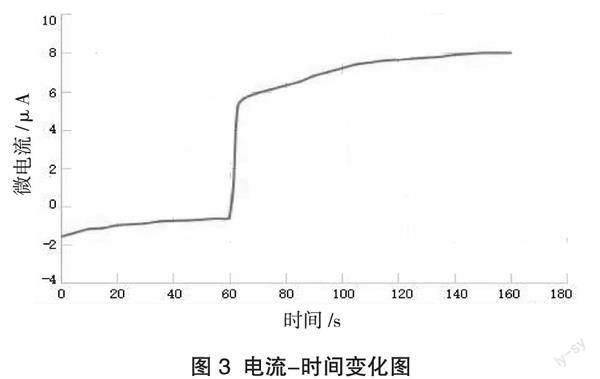
分组实验:连接装置,向U形管正极区加入约10 mL 0.1 mol/L FeCl2溶液,向负极区加入约10 mL 1 mol/L KI溶液和少量碘单质,开始实验,学生可观察到电流的变化。反应进行一段时间后,向正极区加入约1滴管1 mol/L FeCl3溶液,得到电流随时间的变化(图3)。
小组汇报实验结果。实验现象:电流曲线从开始时逐渐减小到平稳,加入FeCl3溶液后,电流由负变正,方向发生变化。
设计意图:经历“2Fe3+ + 2I- ?葑 2Fe2+ + I2”定性实验到“2Fe3+ + 2I- ?葑 2Fe2+ + I2”定量实验的分析过程,使学生感受探究性实验教学中发现与分析问题、思考与解决问题的过程,并且在实验探究活动中提升拓展,渗透育人价值,让学生在潜移默化中接受教育,培养学生的实验观察能力与解决问题的能力。
4.4.4 问题层层递进,促进深度理解
问题1:电流为负,说明2Fe3+ +2I- 2Fe2+ + I2正在向哪边进行?
电流传感器的红线连接石墨,浸人FeCl2溶液的一端;电流传感器的黑线连接石墨,浸入KI、I2混合溶液的一端。如果FeCl2溶液的一端为正极区,KI、I2混合溶液的一端为负极区,电流应该为正。现在电流为负,说明FeCl2溶液的一端为负极区,发生氧化反应,电极反应式为:2Fe2+ - 2e- = 2Fe3+;KI、I2混合溶液的一端为正极区,发生还原反应,电极反应式为:I2 + 2e- = 2I-。即反应向逆方向进行。
问题2:向FeCl2溶液的一端加入约1 mL 1 mol/L FeCl3溶液后,曲线出现如图3所示的突变,说明什么?
电流由负变正,说明该反应方向发生变化。原FeCl2溶液的一端由负极区变为正极区,发生还原反应,电极反应式为:2Fe3+ + 2e- = 2Fe2+;原KI、I2混合溶液的一端由正极区变为负极区,发生氧化反应,电极反应式为:2I- - 2e- = I2。实验中通过改变溶液浓度,实现了反应方向的逆转。
问题3:电流的负与正,说明什么?如果电流为0,表示什么?
电流为负,则说明逆反应速率大于正反应速率;电流为正,则说明正反应速率大于逆反应速率;电流为0,则表示正反应速率等于逆反应速率,即反应达到平衡状态。
设计意图:通过问题的层层递进,促使学生理解可逆反应,同时说明可逆反应有一定限度。
通过对可逆反应的探究性实验教学,学生知道可逆反应是有一定限度的;通过对可逆反应过程中电流方向变化曲线的分析,加深了学生对可逆反应的理解,在此基础上建立起化学平衡的概念。
设计意图:强化学生对本节知识的理解,从而产生强烈的探究意识和学习欲望,以真正达到学科育人、立德树人的效果,增进对化学学科的理解;同时进一步体现学生的主体性,扩大学生学习的自主权,发展自主学习能力。
4.5 教学效果反馈
本节课中实验探究环节探究充分,实验现象明显,学生探究积极性高,发现问题,解决问题快速、高效。利用实验的宏观现象引出问题,分析问题并设计实验进行探究,解决问题,突破难点,体现了探究性实验中问题引导的重要性。基于探究性实验构建化学平衡的认知模型。从宏观实验现象入手,引导学生收集信息,得出结论,发展学生多角度直观地进行概念和模型建构[ 5 ]。利用图像进行进一步的解释与印证,分析实验现象背后的本质,并用离子反应方程式、电极反应式进行符号表征,发展学生“宏观辨识与微观探析”“证据推理与模型认知”素养。
5 探究性实验教学的实施建议
5.1 从定性到定量,提升问题解决能力
探究性实验教学从定性分析到定量分析,不但更高效地完成教学任务,而且学生能熟练掌握并迁移应用本节课知识,应用到生产生活中实际问题的解决,培养学生独立思考的能力,提升基于学科理解的探究性实验教学模式。
5.2 深入挖掘探究性实验的教育教学价值
探究性实验教学有利于加深对化学概念性知识的理解,对于概念性知识,可以通过探究实验的形式使学生积极参与,并利用实验中所产生的现象去分析、解决问题,从实验中去认识学科性知识,再将这些知识运用到实践中,从而加深学生对学科知识的理解和认知。
5.3 增强“科学探究与创新意识”素养
基于探究性实验教学培养学生科学探究与创新意识、增强学生设计实验的能力,学生由宏观现象提出问题进行思考,并对实验进行讨论、设计,加以验证实验设计的可操作性,在进行探究时对遇到的实验现象随时记录,注意分析、思考实验现象,从而增强学生的求知欲望和创新能力。
参考文献:
[1] 周扬. 基于培养学科核心素养的高中化学探究性实验研究[D].北碚:西南大學,2020.
[2] 中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020:3-4.
[3] 毛海红,洪兹田,叶建伟.基于技术视角发展核心素养的“原电池”教学[J].实验教学与仪器,2020,37(2):17-20.
[4] 李南方,汲东昌.Fe3+与I-反应可逆性的数字化实验设计[J].实验教学与仪器,2018,35(5):39-40.
[5] 洪兹田,罗德炳,张贤金.基于学科核心素养培养的高三化学复习教学重构:以“有机制备实验”复习教学为例[J].化学教学,2019(6):60-65.
