磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定实验改进的研究
2024-01-16宋宵龙黄艺曹怡红庄俊城王大刚王雷
*宋宵龙 黄艺 曹怡红 庄俊城 王大刚 王雷
(深圳大学材料学院 广东 518071)
化学是一门富有实验性的学科,化学实验是化学研究过程中不可或缺的一部分。化学理论的建立和化学规律的发现都离不开严谨的实验验证。其中无机化学实验的内容覆盖广泛、丰富多彩,从基础的仪器洗涤与使用、物质的称量和溶液的配制、酸碱滴定,到化合物的制备与提纯、离子的分离与鉴定、常数的测定以及废液的回收处理和水的净化等。
在众多的化学实验中包括多种定量分析,如化学常数测定、物质组成分析和溶液浓度分析等,其中化学常数是指化学反应中一些常数的值,这些常数包括平衡常数、电离常数、溶度积常数等。这些常数的值是经过实验测定得出的,可以用来描述化学反应的规律和性质。在化学实验中,化学常数的值对于判断化学反应的方向、速率和平衡等具有重要意义。而磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定实验,是无机化学实验中化学常数测定的重要组成部分和经典实验[1-6]。该实验的基本原理是根据磺基水杨酸(简式为H3R)可以与Fe3+形成稳定的有色配合物,其组成随溶液pH值的变化而形成不同的颜色配合物,当pH<4时,H3R与Fe3+形成紫红色的配合物FeR;pH=4~9时,H3R与Fe3+形成红色的配合物[FeR2]3-;pH=9~11.5时,H3R与Fe3+形成黄色的配合物[FeR3]6-。在一定波长的单色光照射下,溶液的吸光度与配合物离子的浓度成正比例关系。利用紫外可见光分光光度计测定配合物溶液的吸光度,吸光度最大值所对应的离子浓度即可求出配合物的组成[7-10]。
然而,磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定实验存在一些问题和不足之处[5-12],其中药品的选择和用量是一个重要的考虑因素。常见的提供Fe3+离子的药品有硫酸铁铵和氯化铁。然而,硫酸铁铵的制备过程较为复杂,涉及多个步骤,导致其成本较高[13]。相比之下,氯化铁的制备过程相对简单,成本较低。基于绿色化学和节约用品的原则,选择成本更低廉的氯化铁作为试剂[14],然而,硫酸铁铵和氯化铁对于实验结果的影响是否存在区别,这是需要进行研究的问题之一。
此外,磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定实验是在酸性环境(pH≈2)下进行的,大多数实验通常使用高氯酸作为酸性介质。然而,高氯酸作为七大强酸之首,具有不稳定性和强氧化性,当存储条件不合适,或者与还原性有机物或易燃物混合会引起爆炸,另外高氯酸具有在强腐蚀性,与人体接触,会导致严重灼伤。因此,研究替代高氯酸的酸性介质,也是该实验需要改进的问题之一。秦向阳等[15]研究了用浓硝酸代替高氯酸来改进磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定实验。但是,浓硝酸同样具有强氧化性,属于易制爆的危化品。那么利用盐酸作为酸性介质就是我们研究的方向。
本文结合磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定实验,比较硫酸铁铵和氯化铁对实验效果的差异,并探讨盐酸是否可以作为替代高氯酸的酸性介质,以及不同酸性介质和Fe3+的搭配对于实验结果的影响。通过实验方案的改进,优化实验效果,提高大众对绿色化学和资源节约的意识[16]。
1.实验部分
(1)实验仪器和药剂
岛津UV-2450型分光光度计、FA2204B型电子天平(上海精密科学仪器有限公司);容量瓶(100mL,1000mL)、烧杯(50mL)、移液管(10mL,带刻度)、5-磺基水杨酸(广州化学试剂厂);十二水合硫酸铁(Ⅲ)铵(上海沪试化工有限公司)、氯化铁(上海麦克林生化科技有限公司)、高氯酸(国药集团化学试剂有限公司)、盐酸(上海沪试化工有限公司);实验过程配制溶液的试剂均为分析纯。
(2)实验方法
按以下4组酸性介质和提供Fe3+溶液的搭配依次进行4组实验。
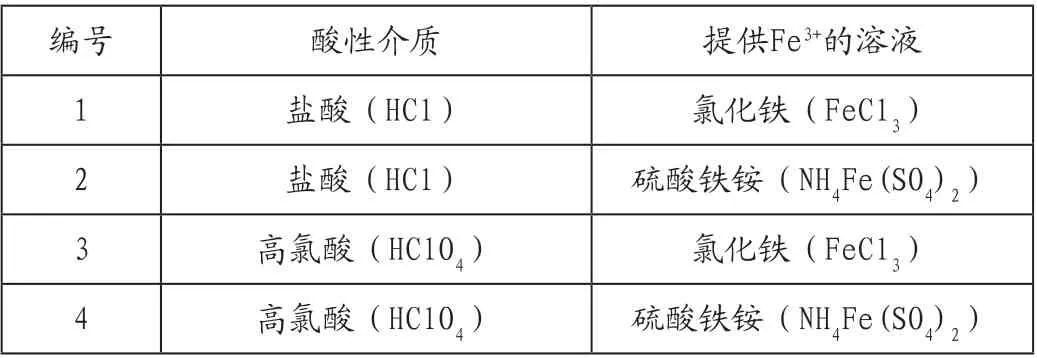
表1 不同酸性介质和Fe3+溶液组合
①0.0100mol/L预备溶液的配制
准确称取0.4822g十二水合硫酸铁铵,用去离子水溶解后将其全部转移至100mL容量瓶中并定容,混匀后得到0.0100mol/L硫酸铁铵溶液。
准确称取0.2702g六水合氯化铁,用去离子水溶解后将其全部转移至100mL容量瓶中并定容,混匀后得到0.0100mol/L氯化铁溶液。
准确称取0.2542g二水合5-磺基水杨酸,用去离子水溶解后将其全部转移至100mL容量瓶中并定容,混匀后得到0.0100mol/L磺基水杨酸溶液。
吸取1.38mL 70%的高氯酸于20mL去离子水中,然后将其转移至1000mL的容量瓶中定容,得到0.0100 mol/L高氯酸溶液。
吸取0.86mL 36%的盐酸于20mL去离子水中,然后将其转移至1000mL的容量瓶中定容,得到0.0100mol/L盐酸溶液。
②0.0010mol/L磺基水杨酸溶液的配制
吸量管移取10mL 0.0100mol/L磺基水杨酸溶液于100mL容量瓶中。用0.0100mol/L酸性介质溶液稀释定容至100mL,充分混匀后得到0.0010mol/L磺基水杨酸溶液。
③0.0010mol/L Fe3+溶液的配制
用吸量管分别移取10mL 0.0100mol/L Fe3+溶液于100mL容量瓶中。用0.0100mol/L酸性介质溶液稀释定容至100mL,充分混匀后得到0.0010mol/L Fe3+溶液。
④通过等摩尔系列法:用0.0010mol/L Fe3+溶液、0.0010mol/L磺基水杨酸溶液以及0.0100mol/L酸介质。
⑤在紫外可见光分光光度计上选择500nm波长的条件下[17-18],12号溶液作为参比溶液,分别三次平行测定每个混合溶液的吸光度(A)。
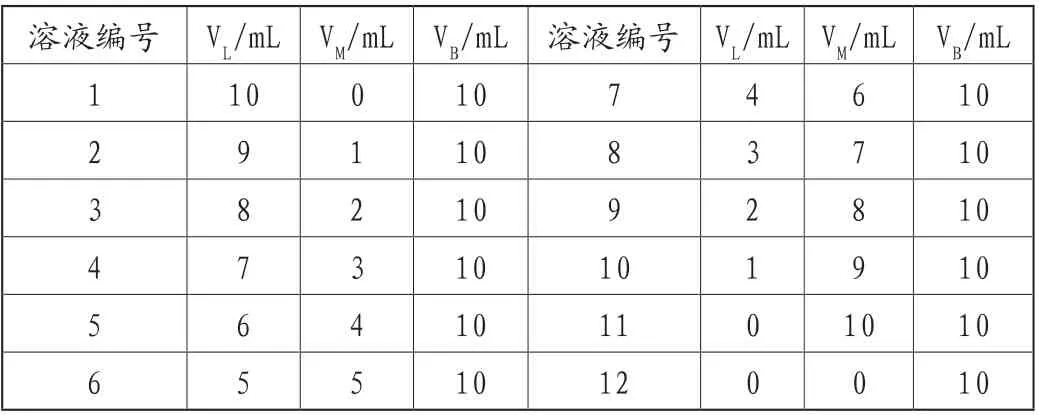
表2 混合溶液各组分体积
2.结果与讨论
每一个混合溶液的吸光度统计于表3。根据表3,以配位体的摩尔分数为横坐标,吸光度A为纵坐标,作配合物吸光度与配位体摩尔分数关系,如图1所示。
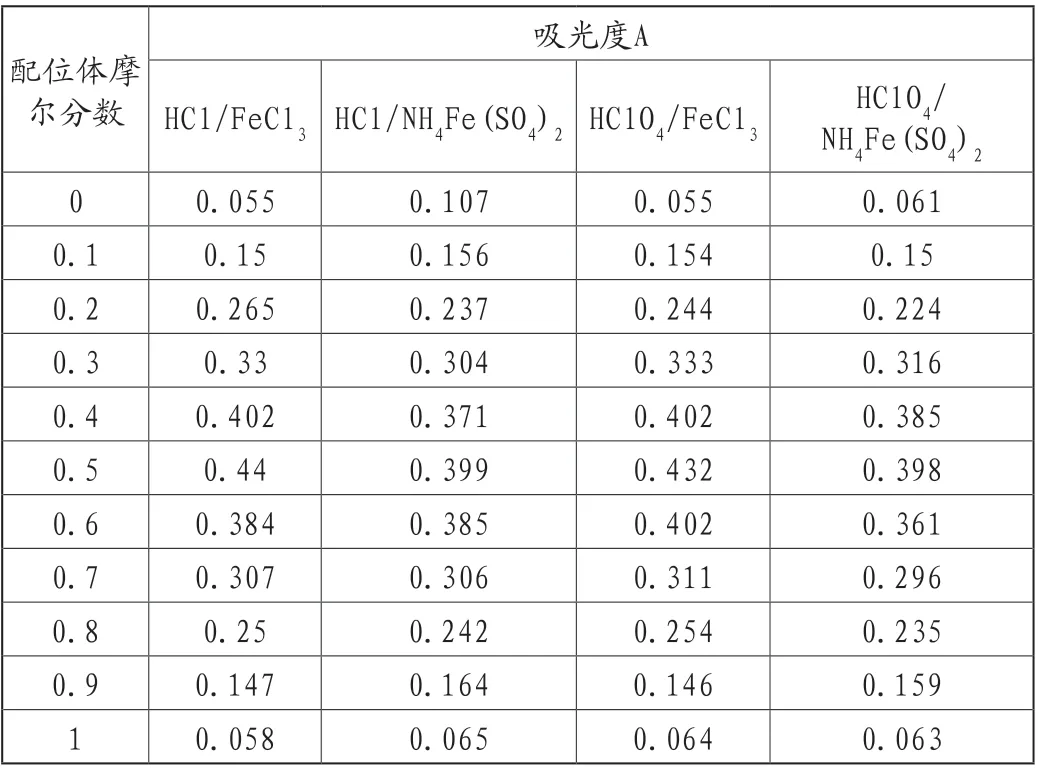
表3 各混合溶液的吸光度(A)
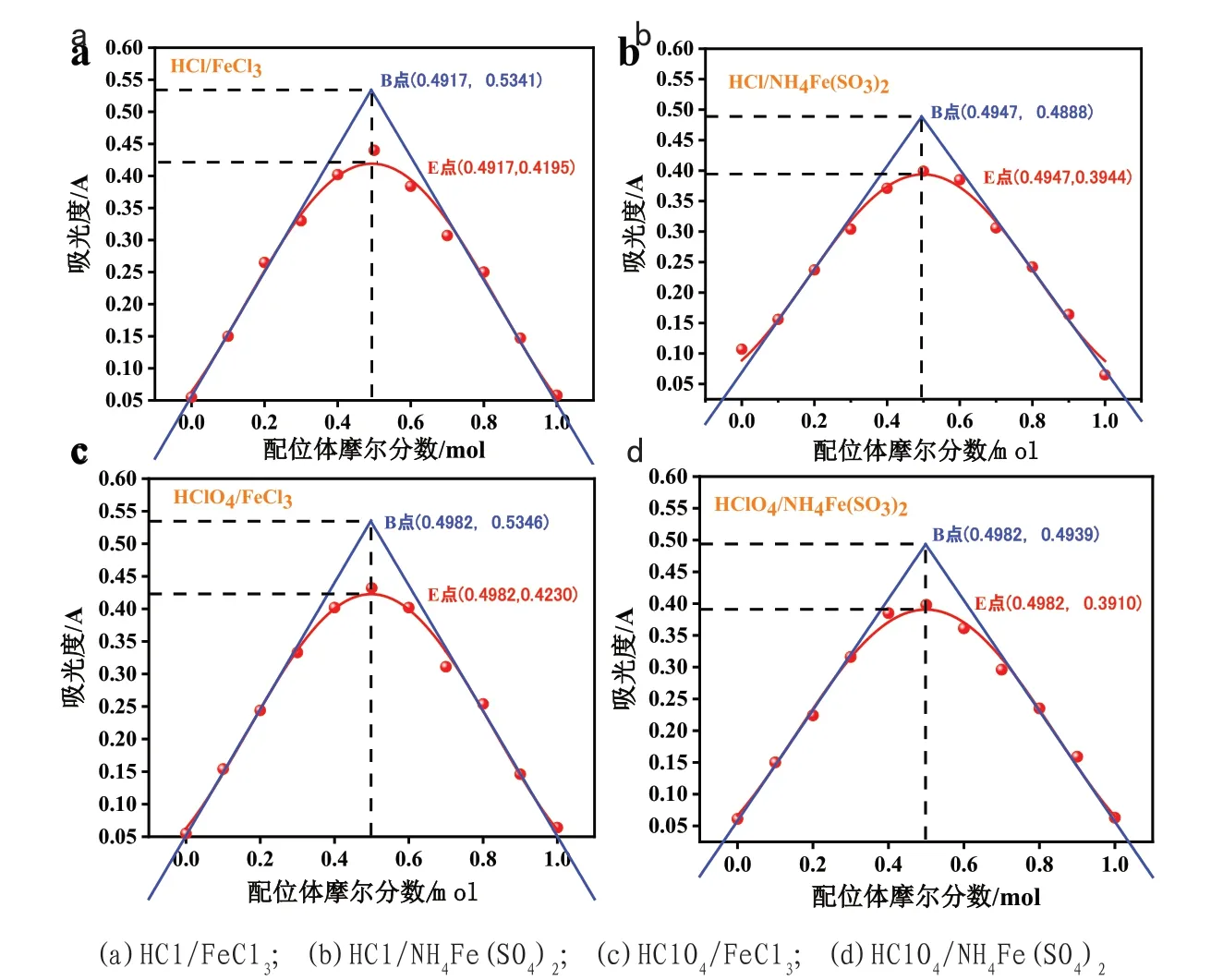
图1 配合物吸光度与配位体摩尔分数关系图
在图1(a~d)可以看出,当溶液的吸光度最大时,Fe3+与磺基水杨酸均构成1:1的配合物。而且四组溶液皆呈现紫红色。
解离度a为:
而5-磺基水杨酸合铁(Ⅲ)在水溶液中的解离平衡方程为:
而c为E点对应的金属离子浓度。将各个数据代入以上各式得到的解离度、稳定常数,如表4。
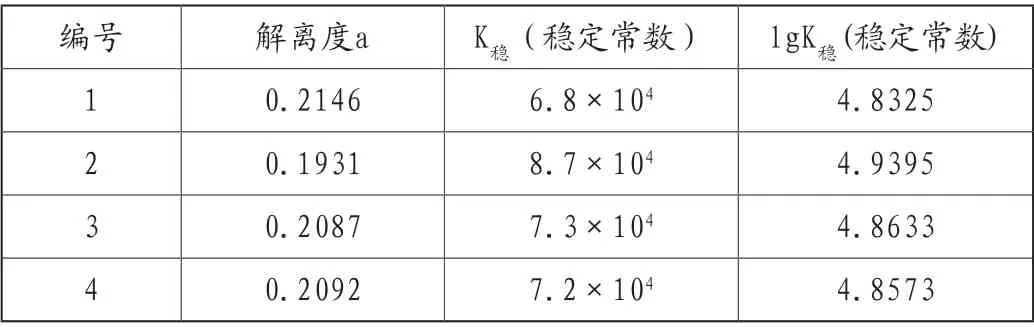
表4 不同酸性介质和Fe3+溶液组合的解离度和稳定常数
在已知的文献报道中,在温度为25℃和pH=2.00的条件下,磺基水杨酸合铁(Ⅲ)的热力学稳定常数为lgK=15.42[19]。然而,在实际反应中,酸效应以及络合效应常常会影响到热力学稳定常数。因此,实际测量的稳定常数就为条件稳定常数:
同时将上式两边取对数后可得:
由于在实验中只有磺基水杨酸配体,并没有其他配体的影响,所以lgaM(L)=0(lgK'MR即为K稳)。
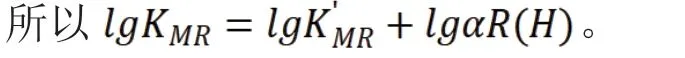
因而,进一步可得:
但是,磺基水杨酸的Ka1比较大,即Ssal非常容易解离成为H2Ssal-而存在于溶液中。因而,此时的磺基水杨酸可按二元酸H2Ssal-处理。查询文献可以得知[15],磺基水杨酸的解离常数为:Ka2=3.23×10-3(pKa2=2.49)、Ka3=1.81×10-12(pKa3=11.74)。
所以当pH=2.00时得到aR(H)=2.3×1010,lgaR(H)=10.36,代入lgKMR=lgK'MR+lgaR(H)中,得到配合物的lgKMR值如图2所示,在HCl/FeCl3中,lgKMR为15.19;在HCl/NH4Fe(SO4)2中,lgKMR为15.30;在HClO4/FeCl3中,lgKMR为15.22;在HClO4/NH4Fe(SO4)2中,lgKMR为15.22。与文献[3]报道值为15.42相比,使用盐酸作为酸性介质和氯化铁提供Fe3+的组合的实验误差仅为1.49%,小于5%的误差范围,因此可以认为是在合理的实验误差范围内。
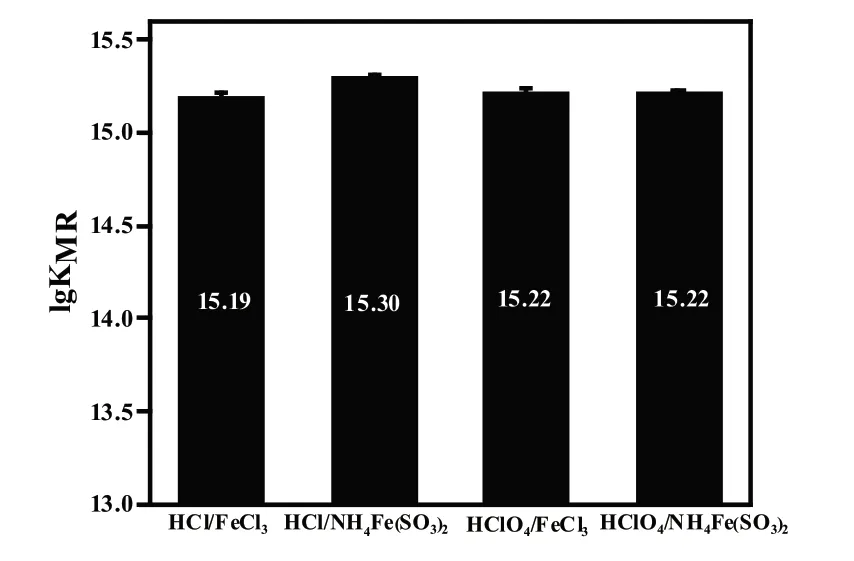
图2 配合物与值的对应图
因此,基于各个方案的实验现象也保持一致,加上综合考虑试剂的价格,我们可以得出结论:选择盐酸作为酸性介质和氯化铁提供Fe3+是一个经济且有效的方案。这个实验方案不仅节约了实验成本,而且在实验结果的准确性和可靠性方面也表现良好。
3.结论
在保持磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定实验的原理和现象不变,通过控制变量法,分别使用盐酸和高氯酸提供酸性介质,使用氯化铁代替硫酸铁铵提供Fe3+进行4组实验,实验结论如下:
(1)不同酸性介质,即盐酸或高氯酸,其稳定常数的测试结果相差都在5%以内,相对比试剂的危险性和试剂价格,使用盐酸代替高氯酸作为酸性介质更加合适。
(2)不同Fe3+的溶液,即硫酸铁铵或氯化铁,对实验测定结果的影响不大,相对比试剂价格和药品使用量,使用氯化铁提供Fe3+更加合适。
