FAPAS牛肉试样中掺鸡肉、马肉、羊肉、猪肉成分检测结果分析
2024-01-15刘单单苏妙贞梁颖思杨丹婷丁清龙
刘单单 苏妙贞 梁颖思 杨丹婷 丁清龙
基金项目:广东省市场监督管理局科技计划项目(2021ZS03)。
作者简介:刘单单(1990—),女,河南商丘人,硕士,工程师。研究方向:食品安全与检测技术。
通信作者:丁清龙(1990—),男,河北沧州人,硕士,工程师。研究方向:食品安全检测。E-mail:1129749459@qq.com。
摘 要:目的:参加英国FAPAS分析实验室组织的能力验证,了解验证并提高实验室对于特定项目的检测能力。方法:依据组织方提供的试样说明书处理试样,分别参照鸡肉、马肉、羊肉、猪肉的检测相关标准,全程采用人员比对方式,鸡源性成分同时采用方法比对的方式,对检出的源性成分进行测序并在NCBI上对测出序列结果进行比对。结果:在试样(29106)中分别检出马源性成分和猪源性成分,经测序比对与检出源性成分一致。结论:本次实验室能力验证结果为满意,可为同类检测机构提供参考。
关键词:牛肉;能力验证;动物源性成分;人员比对
Analysis of the Detection Results of Chicken, Horse Meat, Lamb and Pork Components in FAPAS Beef Samples
LIU Dandan, SU Miaozhen, LIANG Yingsi, YANG Danting, DING Qinglong*
(Guangdong Institute of Food Inspection, Guangzhou 510435, China)
Abstract: Objective: To participate in the proficiency testing organized by the UK FAPAS analytical laboratory, understand the validation and improve the laboratorys testing capabilities for specific projects. Method: Process the samples according to the sample instructions provided by the organizer, and refer to the relevant testing standards for chicken, horse meat, lamb, and pork. Personnel comparison is used throughout the process. Chicken derived ingredients are also compared using method comparison, and the detected source ingredients are sequenced and compared on NCBI. Result: Horse derived components and pig derived components were detected in this sample (29106), and they were consistent with the detected source components through sequencing comparison. Conclusion: The results of this laboratory capability verification are satisfactory and can provide reference for similar testing institutions.
Keywords: beef; capability verification; animal derived ingredients; personnel comparison
近年来关于食品中肉类制品掺假的报道层出不穷,例如引起全球关注的欧洲马肉事件,及国内报道出的其他动物源性掺假事件等[1],肉制品掺假越来越引起人们对食品安全的关注。随着技术的发展,分子检测技术也越来越多地应用到动物源性成分的检测,尤其是各种实时荧光PCR,可对样品进行定性或定量检测[2];近年來,新型核酸检测技术的广泛应用,如环介导等温扩增(Loop-Mediated Isothermal Amplification,LAMP)、微流控芯片、分子信标技术等,使得快速恒温以及高通量检测动物源性成分成为可能[3-6]。DNA分子生物学方法为目前首选的用于肉制品源性成分鉴定的方法,其中应用最广泛的是实时荧光PCR技术[7-8]。能力验证是体现实验室检测能力和实现实验室质量控制的有效手段[9],参加能力验证对于持续提高实验室检测能力和质量控制水平具有重要意义。广东省食品检验所连续两年参加了食品中动物源性成分生物鉴定,分别于2022年5月参加了中国检验检疫科学研究院测试评价中心(Analysis Capability Assessment System of Chinese Academy of Inspection & Quarantine,ACAS)组织的食品中牛、羊、猪、马源性成分检测能力验证ACAS-PT1397(2022)[10]和2023年2月参加了英国FAPAS(Food Analysis Performance Assessment Scheme)组织的食品中鸡肉、马肉、羊肉或者猪肉一或多个成分检测能力验证FAPAS-29106(2023)。现将2023年FAPAS Proficiency Test 29106的能力验证情况报告如下,并对两年的能力验证结果进行分析讨论,以期为同类检测机构提供参考。
1 材料与方法
1.1 仪器与试剂
ME203天平(美国梅特勒-托利多科技有限公司);AB2-3S1生物安全柜(新加坡ESCO公司);Nano核酸蛋白分析仪(日本岛津企业管理有限公司);CFX-96实时荧光PCR仪(美国伯乐公司);T100-PCR仪(美国伯乐公司);Sub-cell GT电泳仪(美国伯乐公司);GelDoc XR+凝胶成像仪(美国伯乐公司);Quant Studio 6 Flex实时荧光PCR仪(美国赛默飞世尔科技公司);Centrifuge 5430离心机(德国艾本德公司)。
DNA提取试剂盒(德国QIAGEN公司);Premix Ex TaqTM(Probe qPCR)(日本TaKaRa公司);Premix Ex Taq(日本TaKaRa公司);羊源性成分检测试剂参照标准SN/T 2051—2008,选用试剂为Real Time PCR Ovine DNA Detection Kit(日本TaKaRa公司);内参基因、猪源性成分的上游引物、下游引物及探针按照SN/T 3730.8—2013提供的序列信息合成;内参基因(或需要检测)、鸡源性成分的上游引物、下游引物、探针(或有)按照SN/T 2978—2011和GB/T 38164—2019提供的序列信息合成;马源性成分的上游引物、下游引物、探针按照SN/T 3730.5—2013提供的序列信息合成。以上序列信息合成和PCR产物测序均由生工生物工程上海股份有限公司完成。
1.2 样品来源
英国FAPAS分析实验室能力验证样品(FAPAS Proficiency Test 29106),牛肉(冻干)试验材料1份,塑料瓶装,重约20 g;阳性样品为市场上购买的鸡肉、马肉、羊肉和猪肉,阴性样品为牛源性标准品;实验用水为无菌ddH2O。
1.3 实验方法
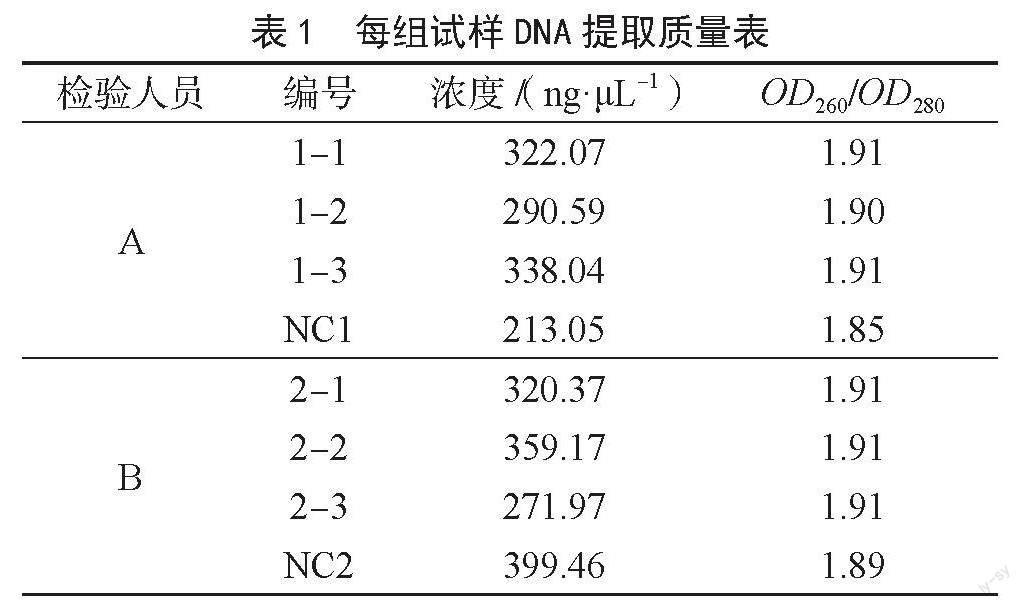
鸡源性成分检测参照SN/T 2978—2011和
GB/T 38164—2019;马源性成分检测参照
SN/T 3730.5—2013;羊源性成分检测试剂和方法参照标准SN/T 2051—2008;猪源性成分检测参照
SN/T 3730.8—2013;样品前处理参照组织方提供的试样说明书。全程采用人员比对(检验员A和检验员B),部分源性成分采用方法比对的方式。根据各标准要求,对各对照结果进行判定。
1.3.1 NDA提取和检验过程质量控制
按照组织方提供的试样说明书处理试样后,均匀称取约200 mg的试样于1.5 mL离心管中,制备3份平行样,并取2份牛源性标准品作为提取阴性对照,另取200 mL无菌水作为提取过程控制的空白对照,这两种对照全程参与试样提取,参照德国QIAGEN DNA提取试剂盒说明书进行提取并测定DNA浓度。试剂空白对照即用水代替模板;参与比对人员分别在不同的实验室取样提取,以防止交叉污染。
1.3.2 提取DNA质量测定
采用核酸蛋白仪测定所提取DNA的浓度和纯度(OD260/OD280),将DNA浓度统一用无菌水稀释至50 ng·μL-1进行后续实验,并于-20 ℃保存备用。
1.3.3 鸡源性成分PCR扩增
按标准方法GB/T 38164—2019,用Quant Studio 6 Flex实时荧光PCR仪进行鸡源性内参照成分检测。25 μL总反应体系包括12.5 μL的2×premix、上下引物(10 μmoL·L-1)各0.5 μL、探针(10 μmoL·L-1)
0.5 μL、提取的模板DNA 5 μL及ddH2O 6 μL。反应条件为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环,在每次循环的退火时收集荧光。
按标准方法SN/T 2978—2011,用T100-PCR仪进行鸡源性成分方法比对检测。25 μL总反应体系包括2×PCR缓冲液12.5 μL、dNTPs(2 mmol·L-1)
5 μL、上下引物对(10 nmol·L-1)各0.5 μL、DNA聚合酶(1 U·μL-1)1 μL、提取的模板DNA 5 μL及ddH2O
0.5 μL。反应条件为94 ℃预变性1 min,94 ℃变性45 s,63 ℃退火40 s,72 ℃延伸45 s,35个循环,72 ℃延伸5 min,4 ℃保存。
PCR扩增产物电泳检测:称取1.5 g琼脂糖于100 mL电泳级冲液中,加热,充分溶化后,加入染色劑至终浓度为0.5 μg·mL-1制胶,在电泳槽中加入电泳级冲液,使液面刚刚没过凝胶。将8 μL各PCR扩增产物分别和3 μL加样缓冲液混合,点样。
9 V·cm-1恒压,电泳至染色指示剂迁移至凝胶中部。凝胶成像仪下观察电泳结果并记录。
1.3.4 马源性成分实时荧光PCR扩增
按标准方法SN/T 3730.5—2013,用CFX-96实时荧光PCR仪进行马源性成分检测。25 μL总反应体系包括12.5 μL的2×premix、上下引物(10 μmoL·L-1)各1 μL、10 μmoL·L-1探针1 μL、提取的模板DNA
2 μL及ddH2O 7.5 μL。反应条件为94 ℃预变性1 min,
1个循环;94 ℃变性34 s,60 ℃退火延伸45 s,40个循环,60 ℃收集荧光。
1.3.5 羊源性成分实时荧光PCR扩增
按标准方法SN/T 2051—2008,用CFX-96实时荧光PCR仪进行羊源性成分检测,25 μL总反应体系包括2×羊源性检测预混液12.5 μL、羊源性检测引物混合液(10 μmoL·L-1)1 μL、羊源性检测探针混合液(10 μmoL·L-1)1 μL、提取的模板DNA 2 μL及ddH2O 8.5 μL。反应条件为95 ℃/10 s,1个循环;95 ℃/5 s,60 ℃/30 s,40个循环,在每次循环的退火时收集荧光。
1.3.6 猪源性成分实时荧光PCR扩增
按标准方法SN/T 3730.8—2013,用Quant Studio 6 Flex实时荧光PCR仪进行猪源性成分检测。
25 μL总反应体系包括12.5 μL的2×premix、上下引物
(10 μmoL·L-1)各1 μL、10 μmoL·L-1探针1 μL、提取的模板DNA 2 μL及ddH2O 7.5 μL。反应条件为
50 ℃/2 min,95 ℃/10 min;45个循环为95 ℃/15 s,58 ℃/1 min,在每次循环的退火时收集荧光。
1.3.7 測序
当PCR检出可疑阳性时,对PCR扩增产物进行DNA测序。
2 结果与分析
2.1 试样DNA提取质量
检验人员A取试样29106(牛肉)3份,分别标记为1-1、1-2、1-3,另取一份阴性样品(牛源性标准品)标记为NC1;检验人员B另取试样29106(牛肉)3份,分别记为2-1、2-2、2-3,另取一份阴性样品(牛源性标准品)标记为NC2。每组实验过程中设置空白对照(KB)、提取对照(TK)、阳性对照(PC)。每组试样提取DNA后经核酸蛋白分析仪检测,结果见表1。经测定试样OD260/OD280值,比值均处于1.8~2.0,提取效果良好。
2.2 鸡、马、羊、猪源性成分检测结果
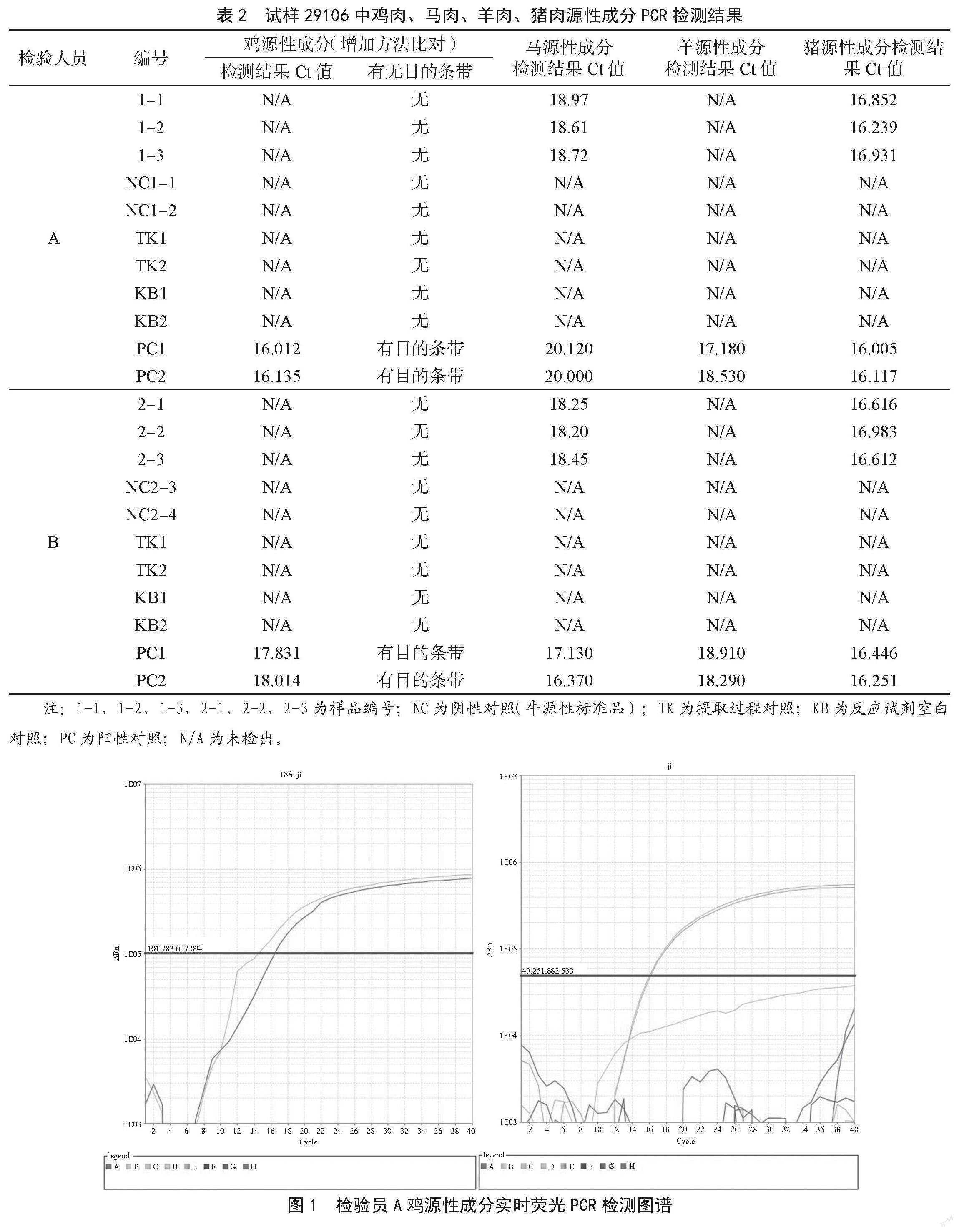
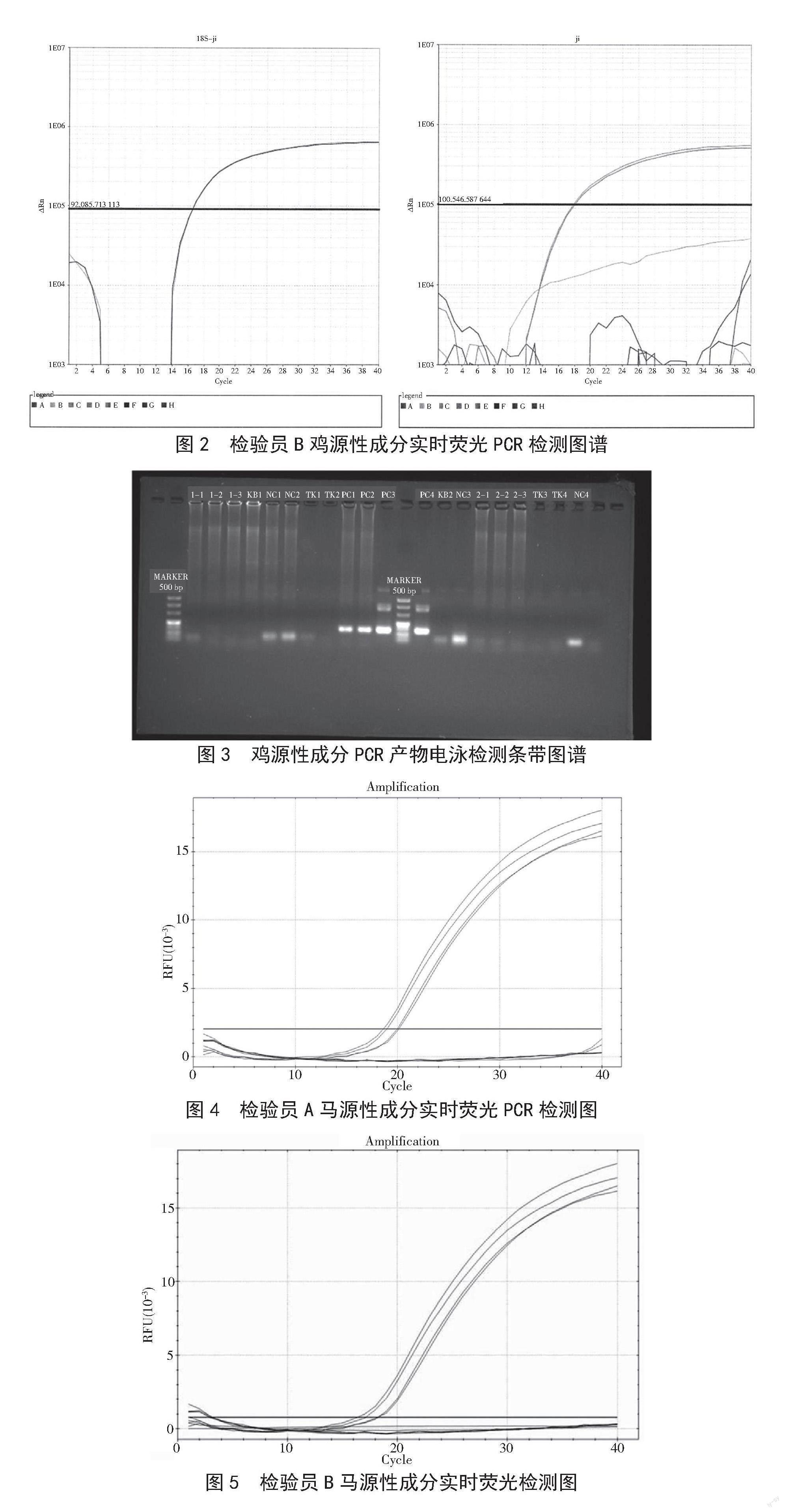
试样29106鸡、马、羊、猪源性成分检测结果见表2。A、B两位检验员检测鸡源性成分的实时荧光PCR见图1和图2,可知两人检测结果一致,均为未检出鸡源性成分。在鸡源性成分的检测中同时用到SN/T 2978—2011进行检测,通过电泳结果(图3)可知与实时荧光PCR检测结果一致。
A、B两位检验员检测马源性成分的实时荧光PCR见图4和图5,可知两人检测结果一致,均检出马源性成分。A、B两位检验员检测羊源性成分的实时荧光PCR见图6和图7,可知两人检测结果一致,均未检出羊源性成分。A、B两位检验员检测猪源性成分的实时荧光PCR见图8和图9,可知两人检测结果一致,均检出猪源性成分。
2.3 检出源性成分测序结果
将检测出猪源性成分和马源性成分的PCR产物送至生工生物工程上海股份有限公司广州分公司进行测序。将马源性测序结果序列与SN/T 3730.5—2013附录A中序列比对,同源性为100%,并将测序结果序列上传到NCBI数据库中进行比对,比对结果为马源性成分;将猪源性测序结果序列与
B/T 38164—2019附录A中序列比对,同源性为97%,并将测序结果序列上传到NCBI数据库中进行比对,比对结果为猪源性成分。
3 结论
根据FAPAS公布的能力验证结果,实验室此次能力验证结果为“满意”。为保证检测结果的准确性,本次能力验证全程用人员比对的方式进行,并在不同的实验室取样和提取试样核酸,有效防范了取样和提取过程中的交叉污染,避免了检测结果异常情况的出现[11]。同时,在鸡源性成分的检测中加入方法比对的方式,两种方法结果一致,进一步证明了检测结果的准确性。对检出的猪源性、马源性成分分别进行了测序,比对结果良好,均与检出的源性成分相一致。
本实验室在2022年5月参加了ACAS组织的食品中牛、羊、猪、马源性成分检测能力验证ACAS-PT1397(2022),与之相比,此次检测中增加了人员比对、方法比对和测序比对的方式,两次能力验证结果均为“满意”,由此可见本实验室在分子技术方面有较高的成熟度。
随着人们生活水平的不断提高,肉类掺假问题也越来越备受关注,分子检测技术已成分第三方检测实验室不可或缺的一部分。此次能力验证采用多种方式进行,不仅保证了结果的准确性,也对实验室整体综合能力进行了验证,包括人员能力、技术方法等。随着检测技术的不断发展,实验室在能力验证、盲样考核等方面,可选择不同的方式方法,采用新技术、新手段以不断提升实验室的综合能力。本次能力验证采用的各方面技术为第三方检测机构的能力考核提供了重要参考价值。
参考文献
[1]路宇轩,翟睿,吴帆,等.肉类掺假检测方法及研究进展[J].计量学报,2023,44(6):1000-1008.
[2]易艳,刘明东,蒋子敬,等.基于分子生物学原理技术检测肉制品中动物源性成分研究进展[J].食品与发酵工业,2023,49(4):288-294.
[3]陈晓宇,陆利霞,熊雄,等.实时荧光PCR技术鉴别流通环节的掺假牛肉及其制品[J].生物加工过程,2021,19(2):214-226.
[4]徐轶飞,王泽祥,赵禹,等.几种动物肉源性成分膜芯片检测方法的建立[J].动物医学进展,2023,44(3):73-76.
[5]石丰运,朱广琴,顾开朗,等.基因芯片法鉴别饲料中猪、牛、鸡和鸭等动物源性成分分析[J].中国猪业,2021,16(3):51-54.
[6]承海,朱洪亮,姚振明,等.基于分子信标技术的肉类食品动物源性成分多重筛检方法[J].中国食品学报,2023,23(6):378-384.
[7]MAGIATI M,MYRIDAKI V M,CHRISTOPOULOS T K,et al.Lateral flow test for meat authentication with visual detection[J].Food Chemistry,2019,274:803-807.
[8]李文绮,李自芹,贾文婷.2019—2021年食品微生物能力验证的结果分析与讨论[J].农产品加工,2023(3):
67-71.
[9]徐帅,郝琴,代艳发,等.LAMP法与PCR法在食品动物源性成分检测中的应用[J].中国食物与营养,2020,26(10):20-23.
[10]苏妙贞,杨丹婷,丁清龙,等.食品中牛、羊、猪、马源性成分检测能力验证结果与分析[J].现代食品,2023,29(5):136-139.
[11]陈雨欣,朱荣,石建华.牛肉粉末中猪源性成分定性检测FAPAS能力验证结果与分析[J].食品安全质量检测学报,2018,9(20):5324-5327.
