鸡PGCs 及基因编辑技术
2024-01-13赵宗仪张文慧聂瑞雪
赵宗仪,张文慧,聂瑞雪,张 博,张 浩
(中国农业大学动物科学技术学院,北京 100193)
鸡是全球饲养数量最多的畜禽,联合国粮农组织统计数据(FAO)表明全世界鸡只存栏量超过330 亿只,每年出栏660 亿只以上,是人类肉、蛋产品的主要供应源之一,对全球农业经济做出了巨大贡献。同时,鸡在发育生物学、免疫研究和生物反应器等研究中具有举足轻重的地位[1]。基因编辑是21 世纪最大的生物技术发现之一,为人类医疗与健康、生物育种、环境生态修复等方面带来了深刻变革。鸟类胚胎在体外发育,很难对位于蛋壳和卵黄膜内的受精卵进行基因操作,鸡胚中具有独特迁移能力的原始生殖细胞(Primordial germ cells,PGCs),分离和体外培养的PGCs 仍然具有分化配子的能力。因此,PGCs 是对鸡进行基因编辑的理想材料。本文综述鸡PGCs 的生物学特性及其基因编辑技术的应用,为禽类基因编辑研究提供参考。
1 鸡PGCs 是进行基因编辑的理想载体
1.1 鸡PGCs 的基本生物学特性
鸡PGCs 最早由1870 年Waldeyer 观察到[2],1993 年Kuwana[3]首次采用电子显微镜观察到了鸡PGCs 细胞。鸡PGCs 在光学显微镜下一般呈现出饱满的圆形,细胞膜呈现清晰的边缘,可以看到细胞质中的糖原颗粒和细胞核[4](图1)。
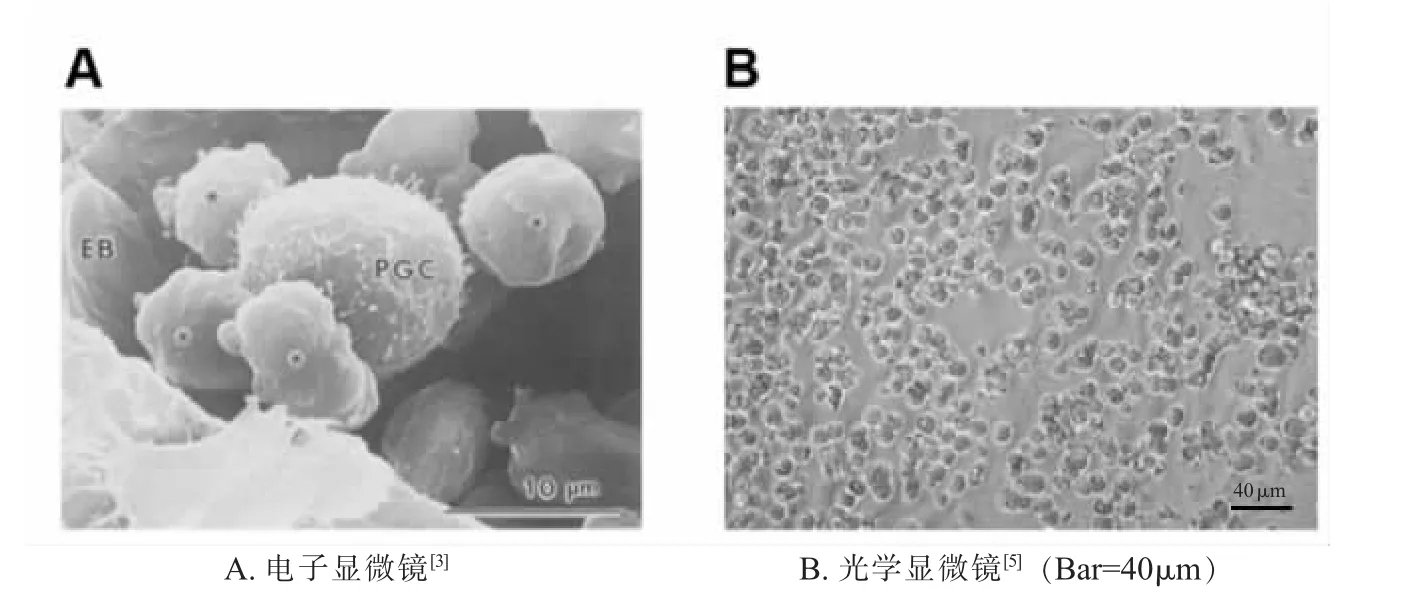
图1 显微镜下观察到的鸡PGCs 细胞形态
鸡PGCs 的形成比哺乳动物更早。鸡胚胎的发育阶段主要采用HH(Hamburger Hamilton stages)方法来描述,这种方法将孵化第0~21 天胚胎发育划分为HH 1~46 时期[6]。Tsunekawa 等[7]采用PGCs 标记蛋白(CVH),证明最早在HH 2~3 阶段存在40~60 个PGCs,同时证明了PGCs 中一个被称为种质(germplasm)的结构,不仅可以传递遗传物质,还可以被定位于精子细胞和卵母细胞,说明PGCs 可以在世代间传递遗传信息。
鸡PGCs 具有从血液迁移到生殖嵴的独特特性。随着胚胎发育,PGCs 逐渐从中心透明区域转移到生殖新月[8,9]。在HH 12~14 阶段,大部分PGCs 轴向集中于血管终窦,并通过前卵黄静脉轴向转运进入胚胎循环系统[10]。在HH 15~18 阶段,PGCs 从血管进入生殖嵴区域。对于PGCs 迁移进入生殖嵴的过程,研究表明,卵黄前静脉[10]、多种基因[11]和细胞因子[12]等在PGCs 正确进入生殖嵴的过程中发挥重要作用。在HH 26~28 阶段,PGCs 在生殖嵴中定殖,被称为性腺生殖细胞(Gonad germ cells,GGCs)。直到HH 35 开始,PGCs 逐渐分化为其他生殖相关细胞(包括精子和卵母细胞)。根据PGCs 在不同发育阶段的特点,我们可以针对HH 2~3、HH 13~17 以及HH 26~35 的PGCs 进行分离和获取,并在基因编辑后进行植入等相关操作(图2)。

图2 鸡PGCs 的迁移特性 [13]
1.2 鸡PGCs 作为基因编辑载体的优越性
将外源基因直接引入受精卵是一种常规且成熟的改变遗传物质的方法,但在鸡中存在诸多困难。在鸡中,Love[14]、Kwon[15]等成功利用了一种与小鼠相似的方法[16],通过病毒将外部DNA 引入受精卵,从而成功制备了生殖嵌合体鸡。但由于鸟类难以单独获取胚胎,并且难以对位于蛋壳和卵黄膜之内的受精卵进行显微操作,这种技术面临挑战。特别是鸡胚的原核被充满蛋黄的不透明细胞质所覆盖,且膜上有大量的精子核[17,18],使得显微操作愈发困难。另外,由于引入的DNA 始终以游离的形式存在,即使利用流式细胞分选法(FACS)分选的胚盘细胞进行注射也避免不了DNA 在后代中降解[19]。所以直接向受精卵中注射外源DNA 不是一个好的可行方法。通过对精子进行基因编辑也是哺乳动物中一个常用的基因编辑方法,但在鸡中没有在附睾中成熟的过程,使得直接编辑精子的机会窗口大幅缩短[20],同时存在体外受精困难、效率低等[21]问题,因此,对精子进行基因编辑同样不适用于鸡。
对PGCs 起源的研究表明,在鸡胚胎早期(HH 1)[22],胚层中已经存在50~100 个鸡原始生殖细胞[23,24]。鸡PGCs 中的种质(germplasm)区域可以在世代间传递遗传物质[25]。此外,PGCs的独特迁移能力也为其分离和体外培养提供了可能性。因此,鸡PGCs 是进行基因编辑的理想材料,鸡的基因编辑研究主要聚焦于PGCs。
1.3 PGC 的获得和培养面临的挑战和解决方案
PGCs 的分离和培养过程充满了挑战。在体内自然分离所得的PGCs 数量相对较少。在单个胚胎的HH 1 时期,PGCs 的只有50~100 个。从孵化4.5d 的鸡胚中分离出的生殖嵴PGCs 数量只在2000~5000 个。PGCs 对于渗透压、生长因子和培养基成分等环境条件非常敏感[26,27],难以大量长期培养。血管中的PGCs 是非黏附的,造成了分离PGCs 困难。雌雄PGCs 所需的渗透压和营养物质不同[28-30],当移植的PGCs 与受体鸡的性别不一致时,种系嵌合体的成功率可能会降低[31],这些因素给PGCs 分离培养和后续基因编辑造成了困难。PGCs 分离方法主要有3 种:①从HH 1时期胚盘中分离;②从第2.5~3 天胚胎血液中分离;③从第5.5~6 天胚胎生殖嵴中分离。
1.3.1 HH1 时期胚盘中PGCs 的分离
由于一个HH 1 时期的鸡胚只含有50~100个PGCs,当前的主流方法并不对这一早期胚胎的PGCs 进行分离。在早期研究中,研究人员利用HH 1 期PGCs 制作嵌合体。Petitte 等[32]将未分期胚胎的中心区域的胚盘细胞团块转移到胚盘的中心区域,产生了体细胞嵌合体公鸡,首次证明了转移的PGCs 在受体鸡中能产生功能性精子。
1.3.2 循环系统中PGCs 的分离
在禽类胚胎中,PGCs 利用血液循环系统向生殖嵴迁移,HH 12~17 期胚胎成为从血液中采集PGCs 的理想窗口期。Tajima 等[33]研究表明,HH 14 时循环系统中PGCs 浓度达到峰值,是采集血液的最佳时期。PGCs 的分离纯化方法经过多次改进已发展出了多种方法。第1 类为梯度密度离心法:Yasuda 等[34]通过Ficoll 密度梯度离心法成功将血液PGCs 从0.048%提高到3.9%,利用该技术生产的种系嵌合体鸡的平均种系传递效率达到4.3%。Zhao 等[35]利用Nycodenz 梯度密度离心将PGCs 的浓度提高到70%以上。第2 类为基于抗原抗体反应的磁珠分选法:Ono 等[36]利用鸡PGC 标记蛋白QCR1(ubiquinol-cytochrome c reductase core protein 1)的单克隆抗体建立了免疫磁珠分选(MACS)。Mozdziak 等[37]采 用SSEA-1 抗体通过流式细胞分选法(FACS)将PGCs 浓度提高到92%。第3 类方法为去除血液中的红细胞进而增加PGCs 的浓度:Yamamoto等[38]建立了一种使用氯化铵钾缓冲液裂解红细胞的试验方法,使全血PGCs 的回收率达到90.3%。除以上3 种方法外,Jung 等[39]利用血液中PGCs的直径大于其他细胞这一特点,开发了Transwell介导的大小依赖性分离方法,使PGCs 的分离变得更加方便和快速。
1.3.3 生殖嵴中PGCs 的分离
生殖嵴中的PGCs 数量相比其他时期更多,且分离更加简单,因此也是运用的较为广泛的一种分离方法。生殖嵴中的PGCs 虽然已经过了迁移阶段,但仍然具有重新迁移和发育为配子的能力[40]。Kim 等[41]通过SSEA-1 抗体采用MACS 方法纯化生殖嵴PGC 后将其移植到X 期胚胎的皮下腔中,成功培育种系嵌合体鸡。同样,Mozdziak 等[42]采用QCR1 抗体通过FACS 纯化生殖嵴PGC,并成功移植到17 期胚胎血液中培育出了种系嵌合体鸡。Nakajima 等[43]开发了一个方便、快捷的方法,从孵化7d 的胚胎中采集的发育中的性腺在37.8℃的无Ca2+和Mg2+磷酸盐缓冲盐水中培养90min 后,PGCs 会从性腺中排出,纯度约为50%。
1.3.4 体外PGCs 的长期培养
研究人员对PGCs 的发育机制和体外培养进行了深入研究,并已经实现了较长时间的培养,为进一步的基因编辑提供了细胞材料。虽然哺乳动物和鸡的PGCs 形成机制有差异,但脊椎动物(哺乳动物和鸡)中控制PGCs 自我更新、生长和分化的机制相似,因此,许多常见的多能性因子和蛋白(DDX4、DND、PRDM1、OCT4、NANOG和SOX2)可以维持鸡PGCs 的多能性和发育。
哺乳动物PGCs 只能在敲除特定基因并且添加生长因子如BMP4、LIF、SCF 和视黄酸等条件下培养较短的时间,而鸡的PGCs 可以培养较长的时间并维持分化能力和种质特性。Lavoir 等[44]成功分离了鸡生殖嵴PGCs,并证明了PGCs经过209d 的培养后进行基因修饰后仍然具有干性和分化为配子的能力。后续研究在提高PGCs培养的数量和质量上取得了许多新的突破:Whyte 等[26]系统研究了PGCs 的培养基,为鸡PGCs 的培养提供了重要的理论基础和实践指导;Collarini 等[5]建立了PGCs 分离建系长期培养的体系;Ezaki 等[4]在PGCs 中添加了包括Blebbistatin 在内的3 种小分子稳定剂,使用Blebbistatin可以在10d 内从250 个细胞中诱导出4.21×105个细胞,使用H-1152 则诱导出2.68×105个细胞,使用Z-VAD诱导出2.50×105个细胞,该方法长期(177d)培养的PGC 获得的后代鸡的效率也很高(93%)。
然而,目前PGCs 培养的雌雄差异问题还需要进一步探究。雌雄PGCs 所需的培养条件不同,产出后代鸡的能力也存在差异。Whyte 等[26]指出了雌雄PGC 所需渗透压不同;Ichikawa 等[29]发现,雌雄PGCs 具有不同的RNA 表达。事实上,雄性PGCs 培养为细胞系的概率在10%~22%[45,46],而雌性PGCs 培养成为细胞系的概率则低得多。PGCs 的性别和受体鸡的性别不同也会造成种系嵌合体成功率降低[31]。因此,雌雄PGCs 的差异培养问题是一个有趣的方向,弄清楚PGCs 之间的差异问题有助于进一步提高基因编辑的效率。
2 基因编辑在PGCs 中的应用
2.1 早期基因编辑工具在PGCs 上的尝试
高效的基因编辑工具是生产基因编辑鸡的先决条件。在最开始的尝试中,Schusser 等[46]在PGCs 中利用同源重组首次靶向敲除了Ig 重链,成功培育出基因修饰鸡。但PGCs 基因组中的同源重组效率极低(约0.1%),且该方法取决于模板基因的同源性[47],因此限制了其应用。
2.1.1 锌指核酸酶和转录激活因子样效应物核酸酶技术在PGCs 上的应用
随着对DNA 酶理解的不断加深,先后出现了锌指核酸酶(Zinc finger nucleases,ZFNs)和转录激活因子样效应物核酸酶(Transcription activator-like effector nucleases,TALENs)等精确基因编辑工具。这2 类工具主要由特异性DNA 结合模块与DNA 核酸酶构成,它们通过DNA 断裂诱导基因组修复,通过非同源末端连接(NHEJ)或同源定向修复(HDR)使得目的片段连入基因组中。Fan 等[48]测试了ZFNs 技术在鸡中具有较高的活性。2014 年首次有报道指出,TALENs 成功介导的鸡靶向卵清蛋白缺失,PGCs 的基因组缺失效率高达33.3%,种系传递效率在22.3%~53.2%[49]。相比于同源重组技术,TALEN 技术在鸡中的成功应用大幅提高了基因编辑效率。
2.1.2 CRISPR/Cas9 技术在PGCs 上的应用
自CRISPR/Cas9 技术问世以来,它凭借其高效和简洁,为各种生物研究带来了革命性的突破和改变。利用此技术能在几乎任何生物体中引导特定靶DNA 序列的切割,再通过NHEJ 或HDR进行修复,实现精确基因编辑[50,51],且更简单更快速[13,52]。PGCs 介导的种系传播系统的成功应用为CRISPR/Cas9 技术的有效应用奠定了必要的理论基础和操作基础,同时,鸡中系统性基因组转录起始位点的深入研究也为基因编辑技术在鸡中的应用提供了有力支撑[53]。
CRISPR/Cas9 技术的应用大大加快了家禽产业化和医学科研等领域的速度。在家禽业中CRISPR/Cas9 技术可以改良现有性状产生经济价值。Dimitrov 等[54]利用PGCs 成功对鸡蛋中的主要过敏原卵清蛋白(OV)和卵粘蛋白(OVM)进行敲除,与传统的同源重组相比,采用CRISPR/Cas9 技术的重组效率显著提高至9%。肌肉质量在家禽产业中是一个重要的经济性状,先后有研究编辑出了通过靶向控制组织生长发育的肌肉生长抑制素(MSTN)基因和调节脂肪沉积的G0/G1 开关基因(G0S2)生产具有更好肌肉质量的鸡[55,56]。禽类疾病控制和预防是家禽业可持续发展的必要先决条件,多数疫苗对禽白血病毒没有效果,而采用CRISPR/Cas9 技术产生的ALV-J 抗性鸡阻断和干扰了禽白血病毒的传播[57];在医学领域,鸡蛋中有大量的优质蛋白,是一个理想的生物反应系统[58]。人类干扰素β(hIFN-β)可以整合到蛋清中用于生产hIFN-β 的鸡卵清蛋白位点中[59]。在免疫学研究领域,为了探究内源性IFAR1 对免疫系统的影响,研究人员成功利用Cas9-HF1 技术制备了干扰素α 和β 受体亚基(IFAR1)敲除的鸡,为研究免疫系统提供了有力支持[60]。
2.1.3 基因编辑工具转染鸡PGCs 的挑战
将基因编辑工具成功引入鸡PGCs 中仍面临诸多挑战,这主要是由于鸡细胞与哺乳细胞在脂质[61]和亲水特性[62]等方面的差异,尽管如此,研究者已尝试了多种转染方法。Lavoir 等[44]最早使用电穿孔的方法进行转染,而Shin 等[63]则采用了慢病毒转染。后来Tyack 等[64]采用脂质体转染的方法(Lipofectamine 2000)进行转染,但这种方法的转染效率仅为23.4%以下[65],Jiang 等[66]采用病毒转染,效率达到了50.0%~66.7%。为了进一步优化,Park 等[67]在鸡PGCs 上利用piggyBac 转座子系统,提高了转染的效率和有效性。Schusser 等[46]采用同源重组介导的CRISPR/Cas9 技术显著提高了基因编辑后的精确性和有效性。
2.2 生殖器官嵌合体的生产
在完成PGCs 的基因编辑后,需要选取合适的受体鸡进行移植。为了使受体鸡更好地接受编辑过的PGCs,需要尽可能减少其自身的PGCs 数量。最早的实验中采用白消安产生不育鸡,消除了大部分受体鸡本身的PGCs[68]。Nakamura 等[69]研究证明,向经白消安处理的不育鸡注射供体PGCs 后,其供体PGC 的占比(98.6%)明显超过对照组(6.4%)。此外,使HH 1 时期胚盘暴露于60 Co 源产生的500~700 rads 伽马辐射也可得到不育鸡。Trefil 等[70]通过该方法产生的不育鸡,经过移植生殖细胞,约有50%的不育鸡得以恢复,这证明了伽马辐射的有效性。Taylor 等[72]通过TALENs 方法成功敲除DDX4 位点,使得PGC无法形成,最终产生成年雌性不育鸡。Ballantyne等[71]采用iCaspase-9 技术成功制造纯种不育鸡,彻底消除了内源PGCs 对基因编辑后代鸡的干扰,为基因编辑鸡的发展奠定了重要基础。
当受体鸡准备好后,选择恰当的时机对其注入已编辑的PGCs 至关重要。根据PGCs 在鸡中的发育迁移特点,现有大多数研究一般选择在胚胎早期阶段(HH 14~16)进行注射。通常在鸡胚背主动脉进行注射,优点是入侵性较小,但并非所有的PGCs 都能到达性腺[28]。也有研究直接将编辑后的PGCs 直接注射到生殖嵴中以生产生殖嵌合体[72]。尽管这种方法可能提高PGCs 的稳定定植率(6%),但其侵入性较高,技术要求也更为严格。
在PGCs 注入受体鸡后,选择正确的孵化方法变得尤为关键。随着技术的不断演进,孵化方法也经历了诸多创新。如Lavoir 等[44]选择先将鸡胚倒出进行操作,完成后使用塑料膜封住蛋壳。早在1987 年,Perry 等[73]和Rowlett 等[74]对代孕孵化系统进行了研究,试图通过模拟鸡蛋外壳结构来孵化鸡胚,但为每一个鸡蛋提供定制的蛋壳结构费时费力。Kamihira 等[75]采用了人工容器对鸡胚进行孵化,并报道了使用聚四氟乙烯作为胚胎培养系统。而Tahara 和Obara 等[76]则使用了食品包装材料——聚甲基戊烯膜作为孵化容器。最近的研究还发现,在无蛋壳的孵化系统中添加钙离子孵化率由19.4%提高到了48.9%,显著提高孵化效率[77]。
2.3 鸡PGCs 基因编辑展望
鸡PGCs 和基因编辑技术仍存在若干问题,需进一步研究和解决,但其应用具有广阔的前景。用基因编辑制作鸡蛋壳腺生物反应器,生产药用蛋白或人源抗体,对人类疾病治疗和疫苗开发具有深远影响。鸡PGCs 介导的基因编辑在应对禽类疾病也具有重要潜在应用价值,有研究在禽肉瘤和白血病病毒(ASLV)方面已经取得了显著突破[78]。最新的研究表明,使用CRISPR/Cas9 系统编辑宿主蛋白ANP32A 可以阻止禽流感病毒在鸡体内的复制。我们可以通过遗传手段预防和控制禽类的多种传染病,为养殖业带来更大的经济效益。在种质资源保护方面,使用基因组编辑技术使其不育的雌性鸡用作移植冷冻保存生殖细胞的替代宿主,并且只产下移植的稀有鸡品种的鸡蛋[79],这为稀有鸡品种的保存和繁殖提供了新的途径,确保了种质资源的长期维护。总之,鸡的PGCs和基因编辑技术为禽业、医药和种质资源保护等领域带来了新的机遇,值得进一步研究和探索。
