鸡马立克氏病抗性机制及抗病品系研究进展
2024-01-13杨玉琴杜玉双
郑 钢,杨玉琴,杜玉双,连 玲
(中国农业大学动物科技学院,动物遗传资源与分子育种实验室,北京 100193)
鸡马立克氏病(Marek's disease,MD)是一种由疱疹病毒科-马立克氏病病毒(MDV)引起的家禽传染性疾病,严重影响鸡的健康和家禽生产,该病由József Marek 于1907 年首次描述,最初定义是“鸡瘫痪病”,后续Biggs 建议使用马立克氏病(MD)命名该病,并将其定义为由疱疹病毒引起的淋巴组织增生性疾病。患病鸡的生长发育受到抑制,肉质和产蛋能力下降,死亡率增加,对家禽养殖业造成重大经济损失[1,2]。为了研究抗马立克氏病的遗传机制,学者们一直致力于了解该病的发病机制和免疫反应,并且通过培育抗性鸡品系和开发疫苗等手段来控制该病。
目前,马立克氏病的预防和控制主要依赖疫苗,所开发的疫苗从HVT 到SB-1 以及目前最广泛使用的CVI988 疫苗,已经更迭三代,现国内外正在积极开发和推广超强毒株(Very virulent,vv)MDV meq 缺失疫苗,以应对MDV 毒力的不断增强。疫苗的使用对于减少马立克氏病的发生和传播起到了重要作用,但也侧面助推了MDV 的变异和演化,使得马立克氏病的控制变得更加复杂。因此,从宿主自身的抗性以及易感机制入手研究马立克氏病,培育MD 高抗品系一直是研究热点。近年来,随着基因组学、免疫学和生物学等领域技术的进步,针对马立克氏病的研究得以加速。研究人员通过组学测序能分析病毒序列的多样性和致病机制。有研究发现,MDV感染后会操纵宿主细胞的基因表达,干扰细胞的免疫应答以实现免疫逃逸,且宿主鸡的免疫系统会出现损伤,增加鸡感染其他病原微生物的风险。多项研究表明,马立克氏病的抗性和易感性受遗传因素的影响,通过遗传分析和基因组评估,研究人员已鉴定出多个鸡MD 抗性相关基因位点和遗传标记,这些发现为进一步培育抗性鸡品系提供了重要依据。
总的来说,马立克氏病是一种严重危害鸡养殖业的疾病,通过利用基因组学、免疫学和生物学等领域的技术,我们能更好地理解马立克氏病的发病机制和抗性形成的遗传基础,为防控该病以及选育抗病系提供了有效的策略,对保障禽类健康生产意义重大。本文综述了目前鸡马立克氏病抗性机制及抗性品系选育进展,为深入探究该病的抗性基础以及抗性系选育提供参考。
1 主要组织相容复合体与鸡马立克氏病的相关性
主要组织相容复合体(Major Histocompatibility Complex,MHC)是一组高度多态的基因群,发挥着抗原呈递作用。鸡的MHC 基因簇位于16号染色体上,其中核心区域(BF/BL 区域)包含了一组编码MHC-I 类和MHC-Ⅱ类分子的基因[3]。研究表明,特定的MHC 单倍型与鸡的马立克氏病抗性/ 易感性存在显著相关,在鸡上MHC 单倍型又被称为B 单倍型。早在20 世纪80 年代,依据血清学分型共鉴定了27 种MHC-B 血清单倍型,包括11 个常见单倍型(B2、B4、B5、B6、B7、B12、B13、B14、B15、B19 和B21)和16个低频单倍型(B1、B3、B8、B9、B10、B11、B17、B18、B22、B23、B24、B25、B26、B27、B28 和B29)以及8 个重组单倍型(以上数据78%来自白来航鸡),其中B21、B2、B6 单倍型被认为对MD 具有抗性,B5、B13、B19 单倍型对MD 易感[4]。研究人员通过对BF/BL 区域的基因多态性进行分析,发现不同MHC 单倍型的鸡体内能产生不同的抗体反应、细胞免疫反应和免疫调节反应,从而影响其对MD 的抵抗力[5]。进一步研究发现,鸡MHC-B 区域(209kb)具有高度多态性,其中包含45 个基因[6]。不同的MHC单倍型会通过其所编码的MHC 分子与MDV 抗原结合能力不同,影响免疫系统对病毒的应答。如B2 单倍型的MHC-Ⅱ分子抗原肽结合区基序是10 个氨基酸[7],而B19 MHC-Ⅱ类分子为9 个氨基酸,这可能是B2 较B19 单倍型有MD 抗性的原因之一;针对B15 和B19 的鸡MHC-I 类分子结构的研究发现,BF2*1501 具有更宽和更深的肽结合槽,这可能是B15 相较于B19 单倍型有更强抗性的原因[8];B21 单倍型被认为对MDV 具有抗性,研究发现B21 单倍型的MHC-I 类分子BF2*2101 的结合槽有一个大的中心腔,且根据初步的肽段配体模型,预测出BF2*2101 分子可以结合更多来自MDV 的抗原肽,比B4、B12 和B15 等的MHC-I 类分子预测结合的肽段更多,这可能是B21 单倍型具有更强抗性的原因[9];Zhang等[10]发现B4 单倍型的BF2*0401 分子显示出在其他MHC 分子中未观察到的高度正电荷表面,以及由于等位基因特异性残基带有臃肿侧链而导致的异常狭窄的抗原结合槽,这可能是B4 单倍型鸡具有MD 易感性的原因之一。
需要注意的是,MHC 单倍型对马立克氏病抗性的影响并非绝对的,因为MDV 具有遗传多样性和适应性进化能力,可以借此逃避宿主免疫系统的监视。除了MHC,其他基因和免疫系统组分的相互作用也会在马立克氏病的抗性或易感性中发挥作用。因此,需要进一步研究揭示MHC 与其他基因和免疫系统组分的相互作用,以及这些相互作用与MD 抗性的关系,才能更好地解释抗性/易感性的遗传基础。
2 与MD 相关的群体遗传标记
除了目前公认的主效基因MHC 基因簇外,研究人员还在寻找与MD 抗性/ 易感性相关的其他遗传标记[11],其中包括基于微卫星标记、单核苷酸多态性(Single nucleotide polymorphism,SNP)标记,以及拷贝数变异(Copy number variation,CNV)等。
微卫星标记是一种常用的分子标记,是DNA序列中的短重复序列,其重复次数在不同个体中可能不同。早期研究发现了17 个与MDV 感染后的存活率有关的微卫星标记(表1)[12]。通过微卫星标记的分析,鉴定可能与MD 抗性相关的候选基因或基因座,检测这些基因座的遗传变异,并与MD 抗性进行关联,可以进一步分析MD 相关的变异位点。
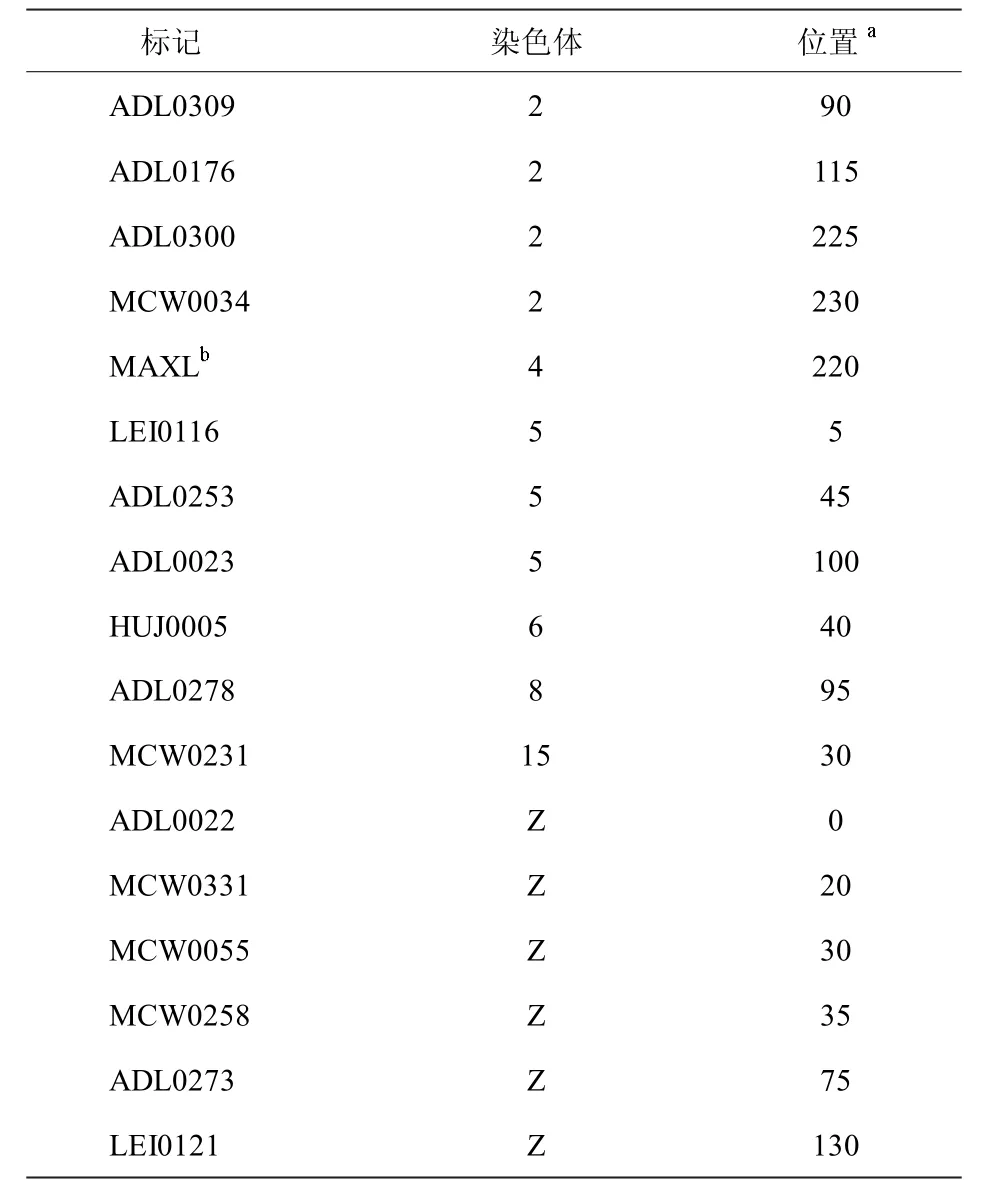
表1 与感染马立克氏病病毒后的存活率相关的标记[12]
单核苷酸多态性是基因组中常见的遗传变异形式,SNP 芯片和测序技术的广泛应用使研究人员能全面分析鸡的基因组。目前,已有多项研究发现SNP 和结构变异与MD 相关。Li 等[14]对67只MDV 感染鸡进行了全基因组关联分析(Genome-Wide Association Studies,GWAS),搜索了38655 个有效基因组标记后,发现2 个SNPs与宿主的MD 抗性有关,分别是rs14527240(位于SPARC 相关模块钙结合蛋白1,SMOC1 基因上)和GGaluGA156129(位于非受体型蛋白酪氨酸磷酸 酶3,PTPN3 基因上),其中SMOC1 在MDV 感染后的易感鸡脾脏中表达上调,表明其在MD 肿瘤发生中起到重要作用。Perumbakkam等[15]在具有抗性差异的肉鸡群体(Cobb-Vantress纯系鸡或其F1 代鸡)和MD 抗性63 系、易感72系杂交后的F1 代鸡中分别识别了与MDV 抗性相关的等位基因特异性表达(Allele-specific expression,ASE)的SNPs 6132 个和4528 个,分别位于4768 个和3718 个基因中,其中只有72 个SNPs 和850 个基因在2 个群体中同时显示等位基因特异性表达,且上述两群体在MDV 感染后分别有548 个和434 个基因差异表达,其中只有20个基因是两群体共有的,富集分析发现Toll 样受体(Toll-like receptors,TLR)以及JAK/STAT 信号通路等在2 个群体中都出现富集。Cheng 等[16]利用上述4528 个ASE SNPs 中的1824 个,以及3097 个随机选择的SNPs 设计芯片,结果显示,1824 个在MDV 感染后表现出ASE 的SNPs 可以解释83%以上的遗传变异,且ASE SNP 预测育种值的准确度(0.736)比传统基于血缘关系的最佳线性无偏预测(Best Linear Unbiased Prediction,BLUP)方法(0.325)高很多。笔者课题组针对3 只63 系个体,3 只72系个体进行全基因组重测序,在马立克氏病抗性系中共找到4904832 个SNPs 和742041 个小片段插入以及缺失(Insertion and Deletion,InDels),在马立克氏病易感系中共找到4882010 个SNPs 和744783 个InDels;其 中1676196 个SNPs 和242126 个In-Dels 是抗性品系特有的,1510499 个SNPs 和227013 个InDels 是易感品系内特有的。
Yan 等[17]随后利用全基因组重测序对MD 抗性63 系和易感72 系进行了CNV 分析,共鉴定到5680 个CNV 区域(Copy Number Variation Region,CNVR),其中1546 个和1866 个分别在MD 抗性和易感系中特异存在(被认为已固定),易感性系内固定的CNVRs 所涉及的基因显著富集在MAPK 信号通路上。Xu 等[18]使用Affymetrix Axiom HD 600 K SNP 基因分型芯片检测了MD抗性6 系、易感7 系以及它们的重组同类系(Recombinant Congenic Strain,RCS)一共10 个纯系鸡中的CNV,共检测到393 个CNVs 片段,其中12 个CNVs 为72 系鸡中特有,有2 个CNVs(chr10:5716844-5717897 和chr26:1927477-1931663)的缺失很可能对MD 易感性起到贡献作用,同时还发现66 个CNVs 与MD 相关的数量性状基因座(Quantitative Trait Loci,QTL)区域重叠。Bai 等[19]基于MD 抗性63 系和易感72系以及它们的F1 代和6 个具有不同易感性的重组同类系共9 个群体,鉴定出1649 个CNVRs,其中90 个CNVRs 在所有鸡系中共享,共涉及1360 个基因。此外,在63 和72 系中分别特异性地鉴定到包含62 个基因的55 个CNVRs 和包含57 个基因的44 个CNVRs。
为了更好地理解MD 抗性的遗传机制,研究还将遗传标记与表型数据进行关联分析,如全基因组关联分析和基因组选择信号分析。通过结合遗传标记和表型数据,可以鉴定出与MD 抗性相关的遗传变异,并了解这些变异如何影响抗性的表现。在鸡马立克氏病抗性研究中,已经鉴定和报道了多个与该抗性相关的QTLs。Smith 等[20]基于2 个MD 抗性不同的商业白来航品系杂交产生的F6 群体进行600k 芯片的GWAS 分析,找到与MD 相关的38 个QTLRs,如表2 所示。这些QTLs 位点的鉴定和研究对理解鸡马立克氏病抗性的遗传机制起到了重要作用。除上述QTLs 位点之外,Lipkin 等[21]挖掘得到了7 个位于Z 染色体上的与MD 关联的QTLs,通过生物信息学分析找到了一些可能的候选基因,如磷酸二酯酶8B(PDE8B)、一般转录因子IIH 亚基2(GTF2H2)等,这些基因与免疫和疾病相关,这也是MDV在公母鸡上的感染存在差异性的原因之一。

表2 与马立克氏病相关的QTL 位点信息[20]
3 宿主与病毒基因互作
大量研究表明,宿主与病毒基因之间的相互作用在马立克氏病的发病和抗性中起着重要作用。这些互作调控过程包括病毒入侵宿主细胞、病毒基因的表达与调控、免疫逃逸和免疫抑制、宿主的免疫应答以及病毒复制和释放等。MDV感染的第一步是病毒入侵宿主细胞,MDV 依赖于其表面的糖蛋白与宿主细胞膜上的特定受体结合,一旦病毒与宿主细胞结合,它可以通过膜融合或内吞过程进入细胞。具体来说,MDV 的入侵过程可能涉及多种细胞表面受体。CD30 是T细胞表面分子,也称CD30 抗原,可能作为MDV的受体之一。研究发现,MDV 主要感染T 淋巴细胞,且肿瘤细胞表型从低表达CD30(lo)转变为高表达CD30(hi)[22]。有研究报道,鸡CD30启动子具有15 个预测的高严格MDV 主要致瘤基因(meq)结合转录因子识别基序,Meq 可在体外增强CD30 启动子的转录[23]。Zhang 等[24]研究发现,热休克蛋白-70(Heat shock protein 70,HSP-70)可能是MDV 糖蛋白gH 的潜在细胞受体,体外实验验证了HSP-70 参与MDV 进入鸡胚胎成纤维细胞(CEF)的早期阶段。因不同MDV亚型可能利用不同的受体,也可能存在侵入不同类型细胞时利用不同受体的情况,目前MDV 的入侵机制仍在研究中。
一旦MDV 进入宿主细胞,其基因组会被释放,而后病毒基因开始被表达和调控。MDV 的基因组是一个将近180kb 的双链DNA,不同毒株略有不同,强毒株GA 株全基因长174kb[25],超强毒株Md5 株约178kb,编码了100 多个基因。MDV 感染后通过多种方式逃避宿主的免疫反应。Meq 基因编码的蛋白是MDV 的主要致癌蛋白[26],其本身是一种转录因子[27],参与细胞溶解性感染,并且对于体内淋巴细胞的转化至关重要。研究表明,Meq 与干扰素刺激因子(STING)和干扰素调节因子7(IRF7)结合,中断STING-TBK1-IRF7 复合物的形成,从而抑制干扰素β(IFN-β)的表达。US3 是单纯疱疹病毒中的一个多功能基因,其编码的病毒蛋白激酶通过靶向IRF7 抑制IFN-β 的产生促进MDV 复制,阻断cGAS-STING信号通路[28],同时也有研究显示,US3 蛋白激酶可磷酸化鸡组蛋白去乙酰化酶(HDAC)1 和2并调节病毒复制和发病机制[29];另外病毒基因RLORF4、UL46 和VP23 也能通过调节cGASSTING 信号通路来抑制一型干扰素(IFN-I)的产生。
vIL-8 基因编码的蛋白是宿主白细胞介素-8(IL-8)的同源物,编码一种CXC 趋化因子,能募集B 细胞和CD4+CD25+T 细胞,分别是病毒复制和MDV 诱导转化的靶细胞,vIL-8 在肿瘤发生中发挥着重要功能,从MDV 基因组中删除vIL-8基因后,几乎完全消除了疾病和肿瘤的形成[30]。vTR 基因编码一种非编码RNA-vTR RNA[31],其被认为是一种转座酶RNA(Telomerase RNA),vTR 和鸡源的端粒酶RNA(TR)具有88%的同源性,vTR RNA 在MDV 感染过程中起到调节细胞端粒酶活性的作用,其与宿主细胞的端粒酶逆转录酶(TERT)相互作用,帮助形成端粒酶的活性复合物,从而促进端粒延长以提高MDV 的生存能力和感染能力。vBCL-2 基因编码的蛋白是宿主BCL-2 的同源物,BCL-2 是一种重要的抗凋亡蛋白,MDV 通过表达vBCL-2,抑制细胞凋亡,从而提高病毒的生存能力[32]。
在MDV 进入宿主细胞后,宿主免疫系统会对MDV 感染作出反应,这包括先天免疫反应以及适应性免疫反应。先天免疫应答是宿主对病毒感染的第一道防线,宿主的免疫系统会通过识别病毒的病原相关分子模式(Pathogen-associated molecular patterns,PAMPs)来激活先天免疫应答。这个过程主要涉及TLR 和RIG-I 样受体(RLRs)等基因的表达,这些受体可以识别PAMPs,激活下游的信号通路,产生干扰素和炎性细胞因子,从而抑制病毒的复制和扩散。研究发现,血清淀粉样蛋白A 能参与MDV 诱导的宿主先天免疫,在感染期间血清淀粉样蛋白A(Serumamyloid A,SAA)激活Toll 样受体2/4(TLR2/4)下游通路中的IFN-β 和IRF7 基因的启动子活性[33]。适应性免疫应答是宿主对病毒感染的第二道防线,在MDV 感染之后,宿主的免疫系统会产生针对病毒的特异性免疫应答。这个过程主要涉及B 细胞和T 细胞等免疫细胞的活化和增殖,以及抗体和细胞毒性T 细胞(CTLs)等免疫效应分子的产生。这个过程涉及多种基因的表达,包括抗原呈递基因(MHC)、T 细胞受体(TCR)、B 细胞受体(BCR)、细胞因子基因(如白细胞介素2(IL-2)、IFN-γ 等)等。
在易感个体中,病毒感染的最终过程是病毒大量复制和释放,这个过程涉及许多基因的调控,主要体现在毛囊中病毒粒子的释放。病毒的装配和成熟过程涉及许多结构蛋白的表达,如VP5、VP13/14 等,其中Jarosinski 等[34]研究发现,早在感染后8d 的羽毛囊上皮细胞中就能检测到MDV 的晚期蛋白UL47 表达。
值得注意的是,MDV 是一种细胞结合型病毒,其传播主要依赖于细胞间的直接接触。在病毒复制和释放过程中,病毒粒子并不直接从宿主细胞中释放出来,这些新的病毒颗粒会被包裹在核膜和细胞膜之间,形成成熟的病毒粒子。通过细胞膜的融合,将病毒直接传递给相邻的宿主细胞。这种传播方式可以避免病毒暴露在宿主免疫系统的攻击下,有利于病毒的持久性感染。而在单纯疱疹病毒的感染过程中,病毒的鞘膜蛋白(如gB、gH、gL 等)和宿主细胞受体(如HVEM、Nectin 等)的相互作用是促使疱疹病毒进入宿主细胞的一种机制[35,36],但对于MDV 来说,目前还不清楚具体是哪些病毒蛋白和宿主细胞受体参与了病毒的细胞间传播。
以上感染过程涉及病毒与宿主基因间复杂的互作,系统解析了马立克氏病的发病机制、免疫应答,有助于探明鸡MD 抗性形成的分子基础。
4 基因表达调控与MD 遗传抗性
4.1 宿主相关抗性基因表达
在宿主对MD 的研究中,除MHC 和免疫相关基因外,还有一些差异基因的表达值得关注。白来航鸡中生长激素1(GH1)的多态性与MHC B2/B15 单倍型的个体感染后MD 肿瘤数量有关,推断GH1 是与MD 相关的抗性基因。Sarson 等[37]比较MD 抗性单倍型B21 和易感单倍型B19 个体感染MDV 后的基因表达谱,发现一些差异表达基因,包括趋化因子AH221、B 细胞标记物1(Bu-1)、免疫球蛋白家族(IgG、IgA、IgM)、MHC-II β 链、颗粒酶A(GZMA)和信号转导与转录激活因子2(STAT2)编码基因。Smith 等[38]分析了抗性61 系和易感72 系鸡在感染MDV 后的反应以及感染后2 个系之间的基因表达差异,发现感染后4d 含有HIC ZBTB 转录抑制因子1(HIC1)结合位点的基因表达下调,同时将基因表达数据与先前的QTL 数据进行比较,确定了候选基因AVD、IFNA、MX1、IL-6、FN1、IRG1、DDT、DNAJC3、SFTPA2、GNG12 可能与MD 抗性有关。在未感染状态下,一些已知的先天免疫反应基因的表达量在61 系和72 系上存在差异,如DNAJC3、DDT、NMU、GSTO1、VIP、HPS5、MMP7、FGFR3、HSCB、E2F4、SFTPA2 和GNG12 在61 系高表达,在72 系低表达,这暗示易感和抗性系之间存在基因表达的固有差异;感染后,两系之间也观察到基因的差异表达(脾脏中有539 个差异表达基因,胸腺中有156 个差异表达基因)。在抗性系中,IgG-H、AMIGO2、MMP13 和CLEC3B 等免疫基因表达更高,在易感系中,AVD、IRG1、HSP25、ART1、IL-18、NOS2A、CXCL13、CCLi2、MX1、SOCS1 和IL-6基因表达更高,说明在感染后2 个系存在不同免疫基因的表达上调。Subramaniam 等[39]通过比较来自MD 抗性6 系和易感性7 系的CEF 对MDV感染的反应,鉴定了以下可能与MD 遗传抗性相关的候选基因:凋亡相关基因(如Caspase3、Caspase6、Caspase8 等)在抗性6 系中上调;抗凋亡基因(如BIRC2 和Bcl-2 家族成员)在抗性6 系中下调;MAPK 信号通路相关基因,如MEK2 在抗性6 系中下调,Ras 在易感7 系中上调;JAK-STAT 信号通路相关基因在易感7 系中上调。IRG1 基因在易感7 系中下调;还发现了直接受meq 调控,且具有变异位点的24 个基因,如BRAF、GPS1 等;还有其他可能参与细胞凋亡、增殖调控的转录因子编码基因,如AP1M1、OPTN 等。同样分离6 系和7 系CEF 攻毒后,Haunshi 等[40]发现,MDV 感染明显提高了易感性和抗性鸡中Toll 样受体3(TLR3)、IL6 和白细胞介素8(IL8)的mRNA 表达水平。此外,在未感染状态下,TLR3、Toll 样受体7(TLR7)等基因在抗性鸡CEF 中的基础表达水平高于易感鸡。还有很多研究鉴定得到了与MD 抗性相关的基因位点,如淋巴细胞抗原6 复合物(LY6E)[41],干扰素调节因子(IRF2)[19],髓细胞白血病1 基因(MCL1)[42]等。
4.2 DNA 甲基化调控
表观遗传学是研究遗传信息的表达和调控的科学,主要涉及DNA 甲基化、组蛋白修饰和RNA 干扰等方面。DNA 甲基化在MD 遗传抗性中的作用是多方面的。一方面,DNA 甲基化可影响宿主对MDV 的抵抗能力。Tian 等[43]发现在MDV 感染后,抗性63 系的甲基化水平下降,研究共鉴定了11512 个感染诱导的差异甲基化区域(iDMRs),其中易感72 系的iDMRs 数量较抗性63 系更多,进一步证明,体外甲基化水平与MDV 复制直接相关,通过药物抑制DNA 甲基化可以限制感染细胞中的MDV 传播,推断宿主的DNA 甲基化可能与MD 抗性或易感性相关。Li等[44]研究发现,CD30 在MDV 感染的脾脏中显示出较低的DNA 甲基化水平和较高转录水平。Wang 等[45]研究发现,MDV 感染后细胞抗原受体复合物相关蛋白β 基因(CD79B)表达的降低很可能是DNA 甲基化水平升高所导致。Luo 等[46]发现MDV 感染引起的DNA 甲基化波动在MD 抗性63 系和易感72 系鸡之间不同,一些候选基因在72 系鸡中具有比63 系鸡更高的启动子甲基化水平,其中参与细胞成分、刺激响应、细胞黏附和免疫过程的高甲基化基因可能通过调控表达在疾病易感性中发挥重要作用。Yuan 等[47]结合甲基化、转录组数据分析发现60%差异表达基因与差异甲基化区域中CpG 位点的甲基化水平显著相关,其中CD4 和HMBG1 基因在肿瘤组织中异常高表达,体外过表达试验发现其能促进淋巴瘤细胞的增殖。另一方面,MDV 的DNA 也可能被甲基化。在肝脏原发性肿瘤中,Brown 等[48]研究发现,在感染后不到2 个月,CpG 甲基化主要集中在ICP4 基因内,并提出非随机新生DNA 甲基化发生在淋巴瘤发生的早期。Rasschaert 等[49]研究发现,ICP4 的远端启动子在裂解期和潜伏期与基因表达相关,而近端启动子在再激活阶段与该基因的表达相关,2 种启动子在病毒周期中都受到DNA 甲基化的调节,并且在潜伏期中被高甲基化。这些研究表明,DNA 甲基化在MD 的抗性机制中起着重要作用。
4.3 组蛋白修饰调
组蛋白修饰是调控基因表达的重要方式,通过改变染色质的结构影响转录因子和RNA 聚合酶等调控因子对基因启动子的识别和结合,从而影响基因的转录过程。MDV 感染过程中,组蛋白修饰可能起到关键作用[50]。Luo 等[51]针对MDV抗性和易感系鸡进行了全基因组组蛋白修饰的研究,发现组蛋白H3 赖氨酸4 三甲基化(H3K4me3)与蛋白编码基因及microRNA(miRNA)基因的表达呈正相关,而组蛋白H3 赖氨酸27 三甲基化(H3K27me3)与蛋白编码基因及microRNA(miRNA)基因的表达负相关,另外还发现抗性鸡中被激活的免疫应答和细胞黏附相关基因存在独特的H3K4me3 修饰区域。
Brown 等[48]研究发现,meq 和非编码RNA 的启动子周围的染色质与H3K9 乙酰化和H3K4 三甲基化相关,这些是转录活跃的染色质标记,而溶解基因pp38 的溶解复制起始点(OriLyt)附近区域缺乏活性标记,这与其周围存在抑制性组蛋白修饰(H3K27 和H3K9 三甲基化)有关。因此,组蛋白修饰在MD 中可能发挥着重要作用,包括促进病毒的复制和扩散,以及调控宿主的抗病毒免疫反应等。
4.4 非编码RNA
MDV-1 基因组可以编码产生26 种miRNAs[52]。Mdv1-miR-M4-5p[53,54]是MDV 编码的最为重要的miRNA 之一,它可以靶向宿主的免疫相关基因,如IFN-γ,抑制宿主的免疫反应。此外,mdv1-miR-M4-5p 还可以靶向宿主细胞周期相关基因,如CDK6,从而促进病毒复制;Mdv1-miR-M11-5p 靶向宿主MAFB、LOC776816 和RFX7 基因[55],miR-M11-5p 敲除可显著增强MDV 致病性及致瘤性,表明其可能是MD 肿瘤抑制因子;研究发现编码3 个miRNAs(mdv1-miR-M8-M9-M10)的MDV 基因簇缺失不影响细胞培养中的病毒复制和噬斑大小,但增加了母鸡MDV 的早期细胞溶解复制,且缺失后导致外周血淋巴细胞的病毒再激活的量显著增加,此外还会导致淋巴器官更严重的萎缩和平均死亡时间的缩短[56];Zhu等[57]研究发现,MDV-1 编码的miR-M2-5p 同时通过RBM24 和MYOD1 介导的信号通路促进细胞增殖并抑制细胞凋亡,潜在参与病毒诱导的T细胞淋巴瘤发生。有关MDV 编码lncRNA 的报道相对较少,研究人员发现了一个名为ERL 的lncRNA 基因[58],它可能作为MDV 的致癌基因meq 和miRNA 簇的自然反义转录本(NAT);通过转录组研究发现ERL lncRNA 在MDV 感染过程中受到高度编辑,可能对MDV 的感染和致病过程具有重要影响。Alexis 等[59]对MDV 感染的不同阶段(溶细胞感染、潜伏期、再激活期)进行分析,挖掘得到了由meq、潜伏相关转录物(LATs)、pp14、ERL 以及一些重复序列区域表达的circRNA 分子,推测这些环状RNA 分子可能发挥着重要的生物学功能。
在鸡MD 抗性研究中,一些宿主非编码RNA在MDV 感染后表达量也会发生改变,这些非编码RNA 可能通过调控宿主基因表达,影响宿主对MDV 的抵抗能力。Stik 等[60]研究发现,病毒癌基因meq 可与TMEM10 基因启动子结合,从而反式激活gga-miR-21 表达并靶向鸡程序性死亡细胞4(PDCD4),进一步促进肿瘤细胞生长和细胞凋亡及免疫逃逸。Lian 等[61]发现gga-miR-181a在MDV 诱导的淋巴瘤中下调,其靶基因是类骨髓增生病毒癌基因同源物1(MYBL1),体外试验表明gga-miR-181a 对MDV 转化淋巴瘤细胞系(MSB1)细胞增殖具有抑制作用。Lian 等[62]还发现,gga-miR-199-3p、gga-miR-140-3p 和gga-miR-221 对MSB1 细胞增殖也有抑制作用,表明这些miRNAs 可作为MD的肿瘤抑制因子;Yao 等[63]通过芯片分析了7个不同MDV 转化细胞系中的miRNA 表达谱,研究发现,miR-155 在MDV 转化的肿瘤细胞中特异表达下调。该现象被认为是MD 肿瘤细胞的独特表达特征;Xu 等[64]发现miR-26a 在许多禽淋巴瘤细胞中均处于全局下调状态,且miR-26a 有直接靶向鸡IL-2 的潜力,肿瘤细胞中miR-26a 的下调可以减轻对IL-2 表达的抑制作用,有助于转化淋巴细胞系的增殖特征;Li 等[65]发现miR-26a 还能靶向NEK6,抑制MSB1细胞增殖。lncRNA GAS5 和lncRNA MALAT1在MDV 感染后的鸡体内表达量发生改变。He 等[66]研究发现,linc-GALMD1 通过调节MDV 基因和肿瘤相关基因的表达以及调节对MDV 感染的免疫反应来促进肿瘤抑制的功能,另外He 等[67]还发现,linc-satb1 通过调节附近的蛋白编码基因SATB1 在MD 免疫反应中发挥关键作用,对MDV 诱导的T 细胞肿瘤产生很大影响。You 等[68]针对马立克氏病肿瘤的全转录组分析发现,差异表达的 lncRNAs(MSTRG.360.1、MSTRG.6725.1、MSTRG.6754.1、MSTRG.15539.1 和MSTRG.7747.5)与MD 抗性候选基因(如IGFI、CTLA4、HDAC9、SWAP70、CD72、JCHAIN、CXCL12 和CD8B)之间存在强烈的相关性,表明lncRNAs 可能通过它们的靶基因影响MD 抗性和肿瘤发生。Wang 等[69]在攻毒脾脏组织中鉴定得到有113 个差异表达的circRNAs,发现gga-miR-155 不仅与circGTDC1 和circMYO1B 相互作用,还靶向免疫相关基因,如Gata4,提示非编码RNA 在介导免疫响应基因中的重要作用。
4.5 m6A 修饰
N6-甲基腺苷(m6A)是一种在真核生物mRNA 中普遍存在的内源性修饰,已被证明在包括细胞分化、发育、应激反应和免疫反应在内的过程中起到重要作用。Zhuang 等[70]研究了体内MDV 感染期间病毒和mRNA 水平m6A 修饰的变化,结果发现,甲基转移酶样3/14(METTL3/14)复合物在MDV 生命周期的裂解和再激活阶段受到抑制,而在潜伏期和MDV 诱导的肿瘤中表达增加,且过表达METTL3/14 会抑制MDV 基因的表达和复制,而敲低METTL3/14 则增强MDV 基因表达和复制。Sun 等[71,72]通过对MDV 体外感染的CEF 细胞中lncRNA 和circRNA 的m6A 修饰进行了分析,发现lncRNA 和circRNA 的m6A 修饰在MDV 感染中高度保守;MDV 感染增加了lncRNA m6A 修饰位点的表达,且与MDV 感染相关的信号通路密切相关,而circRNA m6A 修饰与胰岛素信号通路调控相关。这些研究表明m6A 甲基化可能在MD 抗性中发挥作用。
5 抗性品系培育进展
5.1 美国农业部抗性6 系/易感7 系培育
从1939 年开始,美国农业部(USDA-ARS)Nelson[73]使用9 个不同来源的白来航蛋鸡群作为基础群体,通过300d 存活率等指标进行选育,经过5 年形成15 个近交系,初步将1、4、6、7、8、10、12、13 号定义为较高的抗性,2、3、5、9、11、14、15 号系定义为易感。1940 年将来自于1、2、5、7 号系的公鸡与来自于2、3 号系的母鸡杂交,后代是6 系选育的基础,开始系谱记录,每个家系中选留对淋巴瘤发展有抗性的种鸡进行交配,到1961 年近交程度是95%,1962 年停止疾病选择,开始每个近交系内使用同胞交配。因为6 系是几个抗性系中生产性能最好的,所以用来供研究使用,自1980 年以来,63 系通过选择产蛋性能高的母鸡后代中的1~2 只公鸡,与同胞(sib)或堂/ 表(first cousin)交配的方式繁育后代。与此同时1940 年将1 号和7 号系公鸡与2 号和7 号系母鸡杂交,作为7 系的基础,选择家系中对马立克氏病肿瘤最易感的鸡进行育种。经过温和到强烈的近交,1961 年7 号品系近交率达95%,同样在1962 年停止疾病选择,开始每个近交系内使用同胞交配,产生71 系和72系。7 系长期用于研究马立克氏病易感性研究。从血清单倍型的角度来说,6 系和7 系均是B2 单倍型,这常常被用来佐证除MHC 外还有其他的因素与MD 抗性有关。
5.2 海兰公司抗MD 品系培育
针对美国育种公司的抗病品系培育工作资料有限,仅有赵淑娟等[74]报道中提到美国先锋公司用抗一般不良环境的B2 品系和幼雏生活力强的B14 品系培育了生活力强的B18 品系,用抗MD的B21 品系和抗一般不良环境的B2 品系培育了生活力强、抗MD 的934E 品系;另外美国海兰公司用B2 和B21 培育出抗病性强的HL W36 蛋用商品鸡品系。可能受限于商业育种公司的行业机密,目前并没有公开的资料报道这些培育品系进MDV 感染后的抗病效果。
5.3 俄罗斯雪白鸡培育
俄罗斯育种工作者在俄罗斯白鸡的基础上,自1978 年起,经过20 年的遗传选择,育成了一个蛋鸡新品种-俄罗斯雪白鸡(Russian Snow-White),该新品种抗MD 能力强。选择前,基础群1439 只鸡在攻毒的情况下带有临床MD 症状的鸡占12.4%。通过抗MD 选择到第7 代,在3180 只鸡中MD 的发病率降到2%。最终培育出两个MD 抗性品系-16 系和10 系。在第7 代,16系MD 发生率为0.3%,10 系为3.5%。在俄家禽科学研究所实验室进行的强毒PBIB1 攻毒实验证实了新品种的抗MD 的特性,在这项实验中,16系淋巴瘤发生率为4%,10 系为14%,对照组为41.7%(表3)[75]。
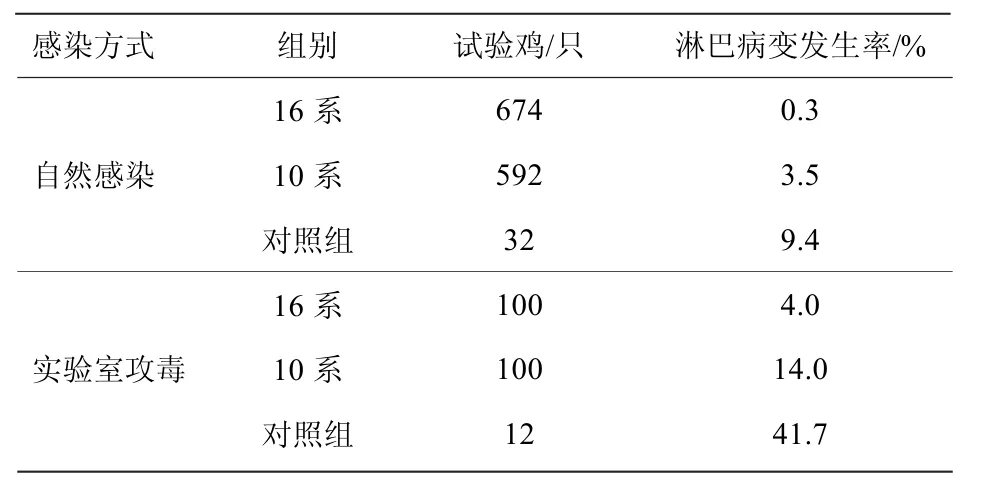
表3 16 系和10 系抗马立克氏病能力的比较[75]
5.4 国内抗MD 品系培育工作
为了有效控制马立克氏病的发生,保证养鸡业的发展,李康然等[76]经过3 年的研究,采用MDV 强毒株攻击霞烟鸡雏鸡,选留幸存者作为零世代进行繁育,其F1 代不经疫苗接种,以自然感染衡量其抗病性能,同时结合后裔攻毒测定,通过后代MD 发生情况评估其父母即F1 代的抗病性能,根据上述指标进行选育直至第3 世代。第3 世代雏鸡1 日龄攻毒后,10 周龄总保护率为74%(对照组35%),其中自然死亡鸡的肿瘤阳性率为16%(零世代为48.1%,对照组37.5%)。1 日龄鸡经火鸡疱疹病毒疫苗(HVT)免疫,14 日龄以强MDV 攻毒,MD 总保护率为96.9%(对照组87%)。该研究经过三个世代的选择,初步培育出抗马立克氏病的霞烟鸡品系,填补了我国家禽抗病育种的空白。
国内科研工作者在构建疾病研究群体上也取得很好的进展,Gao 等[77]成功利用微卫星标记从BWEL 鸡群(中国养禽遗传资源实验动物国家中心培育并发展的无特定病原体(SPF)鸡)中建立了6 个MHC-B 单倍体鸡群体,分别命名为BW/G(1、2、3、5、6、7)系,并将其基因型与6 个血清学定义的MHC-B 单倍体(B13、B15、B2、B5、B21、B19)相对应。通过比较MD 引起的死亡率、组织病变以及病毒负荷,证实相比于BW/G3 系(B2 单倍型),BW/G7(B19单倍型)对MDV 表现出更大的易感性。
6 展望
鸡马立克氏病抗性的研究已经取得了重要进展,一些影响鸡马立克氏病抗性的关键基因和遗传因素已被识别,这些发现为揭示马立克氏病抗性机制,创制抗马立克氏病品系提供了理论依据。未来的研究方向包括:①鸡马立克氏病抗性关键基因功能验证和分子机制解析;②免疫系统与病毒的互作机制解析,探索利用免疫调节提高鸡马立克氏病抗性的可能性;③鸡马立克氏病抗性品系培育;④通过基因编辑手段,创制鸡抗马立克氏病育种新素材。
