基于微流控技术的肺芯片体外模型构建的研究进展
2024-01-12潘博凤罗子纯
潘博凤,罗子纯,师 菁,庞 龙
(1西安医学院公共卫生学院,西安 710021;2西安医学院基础医学部人体解剖学教研室,西安 710021;*通讯作者,E-mail:panglong_1986@163.com)
微流控技术是一种精确控制和操控微尺度流体,以在微纳米尺度空间中对流体进行操控为主要特征的生物技术[1,2],微流控芯片(microfluidic chip)可以构建各种微环境,实现多种细胞间共同培养,为细胞生长提供一种与人体高度近似的环境[3,4],如肺芯片[5,6]、血管芯片[7]、肠芯片[8]、肝芯片[9]、肌肉芯片[10]等。芯片上的器官(organs-on-a-chip,OOC)是指使用3D培养技术对干细胞进行分化诱导进而形成类似于目标器官或组织的技术[11],相比于广泛使用的Transwell方法[12],它不需要使用专门设计的流动腔来模拟流体剪切力等生理特征,可以取代动物实验模型,降低药物开发成本,为药物递送和毒性筛选提供更好的平台[13]。
肺器官作为气体交换的工具,含有肺内支气管的各级分支及其终末的大量肺泡,其中I型肺泡细胞与表面活性物质层、毛细血管基膜和内皮细胞等构成气血屏障[14],是肺泡与血液之间进行气体交换所通过的结构。肺部疾病如肺纤维化或肺水肿[15,16],会致气血屏障加厚,造成肺气体交换功能障碍。目前,人们常采用人肺泡上皮细胞(human pulmonary alveolar epithelial cells,HPAEpiC)、基底膜和人肺微血管内皮细胞(human pulmonary microvascular endothelial cells,HPMEC)来构建气血屏障,以展开对肺结构的相关研究。
肺芯片(lung-on-a-chip, LOC)可以通过与细胞生物学、生物材料学和工程学等多种方法相结合,用于模拟肺的主要结构和功能特征,进而再现人肺泡-毛细血管界面的关键结构、功能和机械性质,具有试剂成本低、微环境可控的优点[17],LOC成为了呼吸系统疾病发生机制研究和相关药物研发的有力工具,被广泛应用于哮喘、肺结核、肺炎等疾病的研究[18,19]。本文将基于微流控技术的LOC体外模型分为2D型和3D型两种。与2D不同的是,基于微流控芯片的3D体外肺模型中多孔膜变成了细胞外基质或水凝胶构成的基底膜,以使器官芯片中的细胞生长更接近于体内微环境(见图1)。本文从肺器官芯片模型的构建及应用角度出发对近年来基于微流控技术的肺器官芯片进行了综述,着重探讨了器官芯片在医学研究方面的应用。
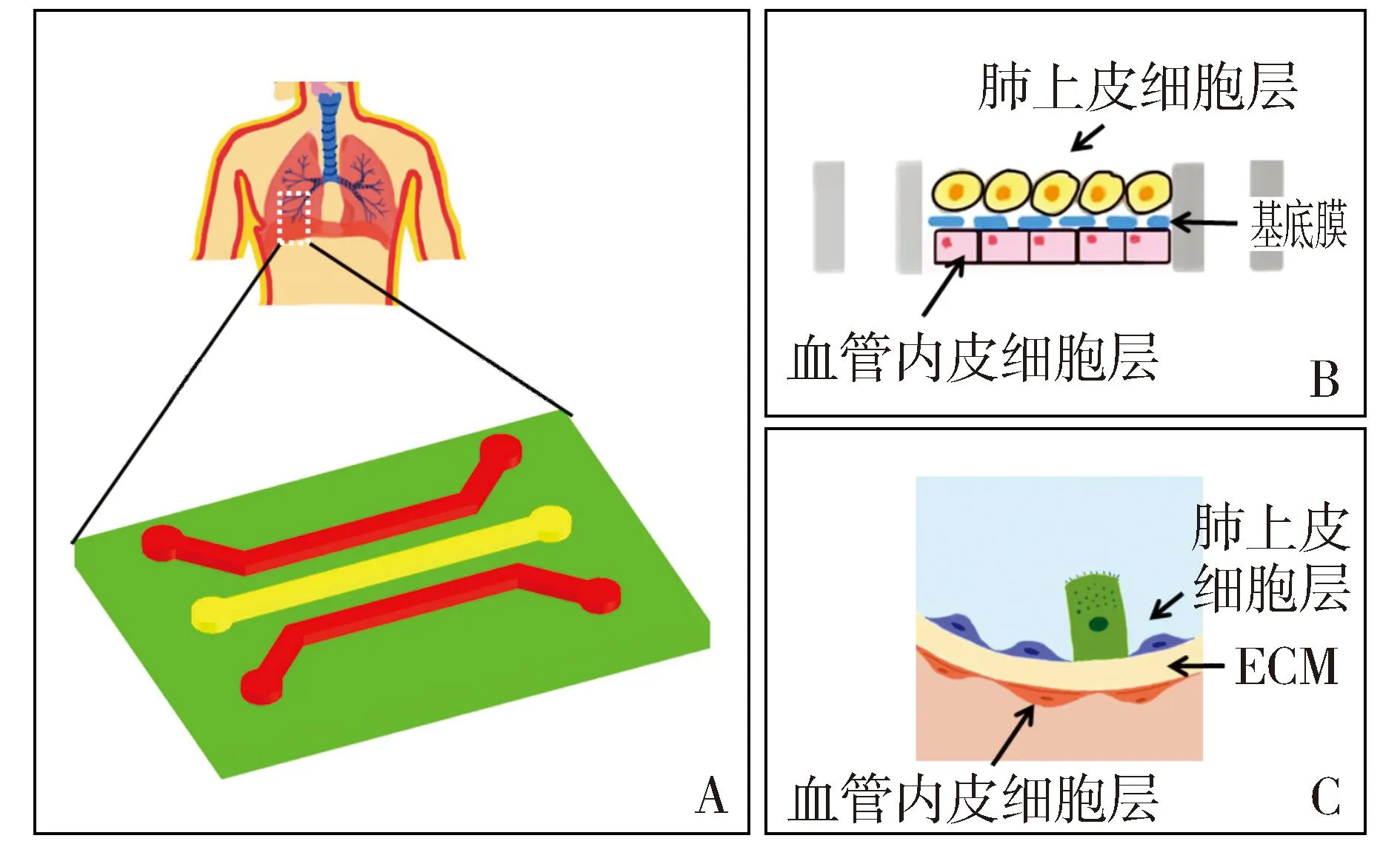
A.微流控器官芯片的示意图,该芯片为器官芯片中经典的三通道芯片,其中两侧管道为细胞生长管道,中间管道或通入生物胶及其他可以形成多孔膜的物质以模拟体内的肺泡结构;B.基于微流控芯片的2D型垂直型体外肺芯片模型,肺上皮细胞和血管内皮细胞分别培养在多孔膜的上下两面,其中上面的微管道通入气体模拟空气进入肺泡,下面的微管道通入液体模拟肺毛细血管;C.基于微流控芯片的3D体外肺模型,该模型中基底膜和细胞生长面都呈弯曲状,使器官芯片中的细胞生长更接近于体内肺泡微环境图1 基于微流控技术的肺器官芯片
1 基于微流控芯片的2D体外肺模型
微流控芯片主要依赖于光刻和刻蚀技术,通过在单晶硅、玻璃等材料上进行刻蚀得到不同的图案[20,21],再利用模塑法结合高分子聚合材料制作而成。聚二甲基硅氧烷(polydimethylsiloxane,PDMS)为常用的高分子聚合材料,具有良好的透气性、光学透明性和疏水性[22,23]。2D型LOC体外模型通常在垂直和水平两个维度上进行微流控肺芯片的模拟。垂直型和平行型微流控LOC体外模型在具有微流控芯片共有优势的基础上又各具特点。本文将按照设计微结构的不同将基于微流控模型的2D肺芯片分为平行型肺芯片体外模型和垂直型肺芯片体外模型2种,并以此为分论点进行介绍。
1.1 平行型LOC体外模型
平行型LOC体外模型通常由左右两侧的两条微通道及中间的PDMS微柱阵列构成(见图2A),其中左右侧微通道用于培养上皮细胞和内皮细胞中间的微柱阵列模拟气血屏障。该模型避免了流体灌注不易操作的缺点,在研究微小颗粒对细胞炎症的损伤、探索细胞间相互作用等方面提供了可控的平台。

A.平行型肺器官芯片 B.垂直型肺器官芯片图2 基于微流控技术的2D肺器官芯片
Zhang等[24]开发了一种研究纳米颗粒的肺毒性的平行型肺芯片,该模型包含3个平行通道,血管通道的宽度和高度分别为400 μm和150 μm,中心层的基质膜使用凝固的基质胶,被夹在人肺泡上皮和人血管内皮层之间,用来模拟肺泡-毛细血管屏障的功能及其结构特征。通过细胞间相互作用、细胞-基质相互作用等来促进芯片上肺模型的屏障功能。荧光10 kD葡聚糖的渗透性变化表明屏障具有低通透性,通过连接蛋白表达的变化表明该芯片可应用于纳米颗粒及药物对人类肺部健康和安全评估等多方面。
同样采用平行型通道的设计,Xu等[25]开发了一种可评估PM2.5毒性的平行型体外LOC模型,以有机类型的方式评估细颗粒物暴露的肺部风险,用于重现肺泡-毛细血管屏障的结构特征。芯片由3个通道构成,中间的通道宽度和高度分别为300 μm和80 μm,两侧的通道宽度和高度分别为350 μm和400 μm,通道中间用于灌注细胞外基质(extracellular matrix, ECM)来达到分隔腔室的效果,横向通道之一用于培养HPAEpiC,另一个侧通道用于培养人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),细胞均培养在基底膜两侧融合成细胞层。通过检测荧光示踪剂FITC-dextran从肺泡通道向血管通道的扩散速率表明该芯片具有低渗透性,上皮细胞钙黏素(E-cadherin)和血管内皮钙黏蛋白(VE-cadherin)的表达结果表明该芯片可形成完整的肺泡-毛细血管屏障。
平行型LOC体外模型的优点及应用见表1,它可以重现体内微环境,使流体操作更为简便。基于聚合物薄膜的贴壁模型支持细胞的附着和分隔,但却忽略了细胞与ECM间的相互作用,细胞与ECM间相互作用在细胞分化和功能等方面起到关键作用,使用凝固的基质胶分离细胞可以更好地模拟细胞与ECM间相互作用,重现体内微环境。在2D型LOC体外模型中,通过测量其体外模型所用基底膜的通透性来评定模型的实用价值,被选择的多孔膜应具有和基底膜相似的通透性。评估通透性时,常用的试剂有异硫氰酸荧光素葡聚糖[26],荧光素钠[27]等。
1.2 垂直型LOC体外模型
垂直型LOC体外模型通常由上下相同的两条微流控通道组成,两条微流体通道由生物膜分隔形成气体通道和血液通道(见图2B)。如图2B所示,多孔膜起到物理屏障作用,将两个腔室分隔开,实现不同细胞的共培养[28]。两腔室通过膜的渗透进行物质传递,同时在结构上更加接近人体微环境。分隔的通道使得能够独立地操纵液体流动以及细胞和营养物质向上皮细胞和内皮细胞的输送。与平行型相比,垂直型模型具有一定的机械特征,可以更好地模拟体内由于呼吸所引起的机械变化;与垂直型相比,平行型模型在分析图像、实时运动跟踪等方面具有显著优势(见表1)。

表1 肺芯片体外模型构建及其应用
Huh等[29]最早设计了一种垂直型微流控肺芯片,被称为芯片构建的经典模型。该芯片为垂直双层结构,包含两个紧密相对的微通道,中间由一层PDMS材料制成的多孔膜分隔上下腔室,HPAEpiC和HPMEC分别培养在ECM包被膜的顶部和底部,在该装置中加入2个更大的横向微腔室,向其中施加真空作用来模拟呼吸运动引起的肺泡-毛细血管界面机械变化。细胞培养的2个腔室具有的出口和入口可以满足流体灌注,允许对气血屏障的任一侧进行操作,进行药物传递和运输。这种仿生微系统能够分析这些生理相关的机械力对多种生理和病理肺功能的影响,为更好地模拟体内微环境提供了一种新的研究方法。
依据经典模型设计的垂直型通道,Jain等[30]开发了一种垂直型微流控芯片,用于研究肺的栓塞,中间由一层薄的多孔柔性膜分隔,膜上涂有ECM,上通道用于培养HPAEpiC,下通道的四壁都培养HUVECs,形成一个连续的内皮管道,使人的全血可以在一定条件下灌注到通道而不诱发血栓形成,同时可实现在微环境中实时研究细胞间相互作用,该芯片可用于定量分析炎症诱导血栓形成的相关研究。同年Humayun等[31]开发了一种基于热塑性的微流控肺气道芯片模型,用于模拟肺气道组织微环境,该微装置由3个垂直堆叠的微流体腔室组成,中间由一种独特的悬浮水凝胶隔开,上通道用于培养气道上皮细胞,下通道用于培养气道平滑肌细胞,以实现气液界面细胞的共培养。具有可排列设计的热塑性设备结构便于大规模制造,使细胞共培养系统可以达到高通量,在慢性肺病等疾病开发中发挥重要作用。
肺器官疾病模型的建立一般通过将有效促炎物质引入至上肺泡通道和血管通道中,进而引起一些炎症反应来模拟疾病的发生[40]。芯片上的肺部模型为疾病建模和吸入物毒性研究提供了一个高效、强大、有力的平台,在研究人类肺部的生理学和疾病病因、药物筛选方面表现出巨大潜力。
Huh等[33]开发了一种可以模拟正常和疾病状态下人类肺功能的垂直型微流控器官芯片,对通道两侧施加真空循环以模仿肺部的呼吸运动,通过研究在相似剂量和相同时间范围内用白细胞介素-2(interleukin-2,IL-2)治疗药物毒性诱导的肺水肿,表明血管生成素-1的添加能够稳定内皮间连接,抑制由IL-2诱导的血管渗漏。使用一种新的药理学药物来测试肺疾病模型,结果表明该药物可以阻断由机械应变激活的某些离子通道并抑制渗漏。Guan等[34]开发了一种肺泡-毛细血管交换(alveolar-capillary exchange,ACE)芯片,将HUVEC和人肺腺癌细胞A549在由PDMS室组成的ACE芯片中培养,分别模拟血管内皮细胞层和肺泡上皮层,多孔膜采用微孔聚碳酸酯薄膜将2个腔室分开,以允许在芯片中的HUVECs和A549细胞之间交换可溶性物质。通过探索PM2.5诱导的毒性作用,研究内质网在PM2.5诱导下氧化损伤导致细胞凋亡,结果证明PM2.5会增加A549细胞中的活性氧产生,并改变内质网应激相关蛋白质的水平。该芯片成功利用ACE芯片确定产生PM2.5损伤的机制,为研究在异型细胞共培养系统中PM2.5诱导的毒性反应提供有效的平台。
随着全球新型冠状病毒肺炎爆发[41,42],研究显示病毒主要通过攻击人的肺泡从而引起严重的肺部感染。而微流控芯片作为高通量的细胞培养平台,在疾病建模等方面具有巨大优势,为阐明新型冠状病毒的作用机制,使研究方向更加明晰,基于该病毒的器官芯片被广泛开发出来。
Si等[35]开发了一种可模拟病毒感染的人气道芯片,该模型包含2个平行的微通道,由ECM涂层的多孔膜隔开,原代人肺支气管气道基底干细胞和原代人肺内皮细胞被分别培养在多孔膜的上下两侧,“新冠病毒假颗粒”被引入气道芯片的空气通道,以模拟人类通过空气传播导致的新冠病毒感染,接下来在血液通道中模拟口服抗感染药后在人体血液中分布的最大浓度,连续灌注多种抗感染药48 h,实验结果表明阿莫地喹、托瑞米芬、克罗米芬这3种药物可以显著减少病毒的进入,没有产生可检测到的细胞毒性。该芯片可以高水平地重现气道上皮细胞分化和器官水平的病理生理学,为快速筛选抗病毒药物提供了快速通道。
同年,Zhang等[32]通过采用一种垂直型微流控LOC体外模型,研究开发了一种人肺泡芯片共培养系统,来重现肺部的结构,模拟真实的体内微环境。垂直型微流控LOC模型提供了一种高效稳定的平台,允许模拟细胞炎症反应和重建体内微环境。通过将HPAEpiC、HPMEC和循环免疫细胞共培养在PDMS多孔膜的两侧,对炎症反应后的细胞进行免疫印迹、RNA转录组测序、透射电子显微镜、免疫荧光、酶联反应吸附测定等一系列实验进行探究。结果表明,被病毒感染时上皮细胞更容易引发炎症反应,造成免疫细胞聚集、内皮脱落、炎症释放因子增加等结果。
垂直型LOC体外模型提供了一种仿生微系统,可以重现人类的多种生理功能,提供了一种低成本、高通量的筛选平台,为多个微型器官模型系统转移到单个设备中提供可能,以再现不同器官、不同模型间的相互作用。但此类模型依旧存在一定局限性,在细胞培养和流体灌注等方面,PDMS膜是此类模型中使用最广泛的多孔膜,具有毒性小、价格便宜、允许清晰的细胞可视化操作等优点,但由于其表面具有高度疏水性,需要使用表面改性等方法进行改性以提高其细胞亲和力[43],并且这些膜的厚度相比于人体内真实微环境的基底膜厚度相对较高,限制了细胞间的相互作用,难以真正实现体内微环境的重现。
2 基于微流控芯片的3D体外肺模型
3D型LOC体外模型不同于普遍的双通道芯片,它是基于肺泡基本结构而设计出的形式多样的微流控肺芯片,可以模拟肺泡的结构和功能,为生理和病理条件方面提供了信息模型。2D型LOC体外模型和3D型LOC体外模型各具优缺点。与3D型LOC体外模型相比,2D型LOC体外模型的制备方面较为简便;与2D型LOC体外模型相比,3D型LOC体外模型的结构更贴近于人体表面肺泡处的生理结构。以下将按照常见的制作肺模型的生物材料,将基于微流控模型的3D肺芯片分为PDMS基底材料和其他基底材料。
2.1 PDMS材料
PDMS材料作为一种固化型的高分子有机化合物,具有良好的光学透明度、生物相容性(见表1)。与水凝胶材料相比,PDMS材料成本低廉、操作简单,在器官芯片的制作中被广泛使用[44]。
Zhu等[36]受肥皂泡彩虹现象的启发开发了一种新的具有呼吸可视化功能的仿生3D球状微生理肺芯片。该芯片利用球状PDMS薄膜上二氧化硅纳米涂层可根据薄膜的伸缩性反射产生不同光谱颜色的原理制备了一种人体肺芯片装置。该芯片可以将人体肺泡呼吸的过程可视化,可用于探索特发性肺纤维化的发生机制及评估相关药物的治疗作用。
基于微流控技术的LOC体外模型能够在组织器官水平研究肺部疾病的致病机制及药物对疾病的影响,Asmani等[37]开发了一种3D纤维化微组织阵列系统,以模拟肺纤维化过程中发生的生理活动,对这种纤维化组织阵列进行多参数的表型分析。利用该系统预测抗纤维化药物的疗效,表明在进行预防性治疗过程中,使用抗纤维化药物可降低组织收缩力,防止组织僵硬和组织依从性下降,表明该芯片模型在一些病理生理学相关建模方面具有一定潜力。多种通过微流体装置的通道泵流体的系统,包括渗透微泵、微流体毛细管系统和微液滴输送系统,都易受到不稳定流速和短期使用的限制[45,46]。Shrestha等[38]通过3D打印技术开发一种简单的开放式肺芯片模型,用来模拟动态条件下气液界面气道的体内环境。人肺腺癌细胞Calu-3被培养在PDMS芯片中,该模型复制了三维培养特异性形态,保持了良好的屏障完整性,结果表明该体外模型在渗透性测定、毒理学试验和给药研究方面具有广阔前景,通过研究香烟烟雾提取物(cigarette smoke extract,CSE)对培养的Calu-3细胞中炎症因子释放的影响,表明经CSE处理过的细胞炎症因子分泌更旺盛,并能降低E-cadherin作为黏附连接蛋白的表达[38]。此外该研究将肺芯片与结构颜料相结合,使肺泡具有特定的颜色,有助于在不同气流压力下评估细胞动态,具有成本低、难度小等优点,PDMS材料所制作单细胞水平的研究对肺部疾病的建模和研究也至关重要,通过使用相关的细胞类型来模拟其功能特征,向腔室内通入烟雾气溶胶,提取物通入的剂量可控,展现出肺泡片上肺模型的高灵敏度、高精确度和生理相关性,为毒性检测、生物学研究等方面提供了有效平台。
2.2 生物水凝胶
水凝胶材料是一种具有三维网络结构的功能型高分子材料,具有良好的生物相容性,实验中常用的水凝胶材料有明胶、海藻酸盐、透明质酸等[47,48]。与PDMS材料相比,它不需要使用表面改性的方法以提高对细胞的亲和力,更加接近于天然的基底膜形态,更能模拟细胞-细胞、组织-组织间相互作用(见表1),对肺芯片的制备提供了更好的方向[2]。
Huang等[39]开发了一种LOC模型,由具有反蛋白石结构的明胶甲基丙烯酰制成的三维多孔水凝胶组成,并与分隔的PDMS芯片结合。用HPAEpiC填充囊形成功能性上皮单层,将循环应变集成到设备中,以允许肺泡的仿生呼吸循环。该模型成功地重建了肺泡的微结构、基底膜特性、空气-细胞界面和呼吸特性,为展示体外肺泡单元的完整功能提供了基础,对肺和肺部疾病建模和研究提供有效平台。
3D型LOC体外模型可以实现细胞培养过程的实时监测,且不缺乏ECM成分,具有良好的调节和评估组织力学性能的能力;可以实现形态学控制和刚度测量,提高对药物疗效的预测能力和准确力,为疾病研究和烟尘提取物毒性探究奠定了基础。
3 小结与展望
本文综述了部分基于微流控技术的体外LOC模型,并对不同模型的优势与不足进行概括,这些模型具有微环境可控、试剂消耗低、可模拟3D组织结构、易集成等优点。相比于普通的细胞培养模型相比,基于微流控技术的体外LOC模型具有血流动力学系统,在生理生物力学研究中具有显著优势,在模拟体内微环境、建立疾病模型、药物开发等方面发挥着重大作用。同时它也存在一定的局限性,例如在实验操作方面,肺芯片的制作规格并没有标准协议,且操作复杂,对实验人员的技术要求较高,难以扩大规模等[5]。在临床应用之前,LOC仍面临挑战,在选择合适的细胞支架和基底膜方面,多孔膜构建所需的材料有待于进行更加深入的探索,PDMS已不能完全满足实验的需要,表面的疏水性会影响细胞黏附性和活力,并阻碍了这种材料的更广泛使用,且多孔膜的厚度和渗透性能仍然不能够完全模拟体内微环境,水凝胶开始在多孔膜构建中发挥重大前景,不同材料的水凝胶可以对细胞的生长、免疫反应等产生显著影响,对于适合体外LOC构建的水凝胶材料的制备仍有待继续研究。
随着对微流控技术研究的不断深入,LOC体外模型构建的方法也在不断进步和发展。微流控芯片通过与化学、流体物理、微电子、新材料、生物学和生物医学工程等多学科结合,可以模拟体内的一些关键特征,在体外实现组织和器官水平的生理功能。LOC平台有助于研究体内细胞-细胞和组织-组织相互作用的复杂动态特性,使药物开发更加快速和高效,通过科技的不断革新与发展,也将在体外建模、基础研究等方面发挥出重要作用。
