槐杞黄对高糖诱导HK-2细胞损伤的保护效应及机制
2024-01-12王军伟马桂巧张佩佩马婵娟
王军伟,马桂巧,张佩佩,邵 婧,马婵娟,3*
(1山西中医药大学第三临床学院肾内科,晋中 030600;2山西医科大学第五临床医学院肾内科;3山西省人民医院肾内科;*通讯作者,E-mail:mcj5670206@163.com)
糖尿病肾病(diabetic kidney disease,DKD)作为糖尿病的严重并发症,对患者的健康构成了严重威胁,影响了数亿人的生活质量[1]。DKD是糖尿病患者进展为终末期肾病(end-stage renal disease,ESRD)的主要原因之一,最终需要肾脏透析或移植[2]。长期高血糖会诱导氧化应激和线粒体功能障碍,破坏细胞内氧化还原平衡,并引起胰岛素抵抗,从而导致多种并发症[3]。高糖(high glucose,HG)诱导的肾小管上皮细胞氧化应激和凋亡在DKD的发病机制中起重要作用。高糖不仅增加了细胞内ROS水平,而且削弱了抗氧化酶系统的能力,从而加重了机体的氧化应激状态[4]。氧化应激对肾小管的损伤包括凋亡、肥大、纤维化等病理改变。肾小管损伤被认为是DKD的重要病理改变[5]。因此,预防和治疗肾小管损伤,阻断高糖诱导的细胞凋亡和氧化损伤已成为DKD治疗的重要靶点之一。
AKT/GSK3β信号通路是一个重要的细胞信号传导途径,它参与调节多种生物学过程,包括细胞增殖、存活和凋亡等。这个信号通路由蛋白激酶B(protein kinase B,PKB又称AKT)和糖原合成酶激酶-3β(glycogen synthase kinase 3β,GSK3β)2个主要蛋白质组成[6]。AKT通过直接抑制GSK3β的磷酸化来增强细胞生存的信号。GSK3β具有促进细胞凋亡的作用,活化的AKT通过抑制GSK3β的活性,降低了其对凋亡相关蛋白的磷酸化,从而抑制细胞凋亡[7]。因此AKT的激活抑制了GSK3β的活性,从而减轻细胞凋亡。细胞氧化应激是细胞内氧化还原状态失衡引起的一种病理过程。AKT的激活可以通过抑制GSK3β减少细胞内活性氧自由基的产生,并增强抗氧化能力,从而减轻细胞的氧化应激损伤。
槐杞黄(Huaiqihuang, HQH)是一种传统中药复方制剂,由槐耳、枸杞子、黄精组成。包括黄酮类化合物、多糖、多酚类化合物等有效成分[8]。槐杞黄具有多种药理作用,包括抗氧化、抗炎、抗纤维化等,在中医药临床实践中被广泛应用于治疗肾脏病等其他疾病[9]。然而,槐杞黄对肾小管上皮细胞(human kidney-2,HK-2)氧化应激和凋亡的作用鲜有报道。因此,本研究将聚焦槐杞黄对肾小管上皮细胞氧化应激和凋亡的作用及其调控机制,通过高糖处理HK-2细胞,观察槐杞黄对细胞氧化损伤和凋亡的保护作用,并以AKT/GSK3β抗氧化抗凋亡途径为切入点探索其作用机制,为临床防治肾脏病提供新的思路及支持。
1 材料与方法
1.1 主要试剂
卡托普利购自美国MCE公司;CCK-8试剂盒购自美国APExBIO公司;SOD和MDA检测试剂盒购自南京建成生物工程有限公司;活性氧检测试剂盒购自北京索莱宝科技有限公司;BCA蛋白定量试剂盒购自上海雅酶生物医药科技有限公司;cleaved-Caspase-3抗体购自美国CST公司;p-GSK3β抗体和GSK3β抗体购自美国Santa Cruz公司;蛋白提取裂解液、TUNEL检测试剂盒、p-AKT抗体、AKT抗体、Bax抗体、Bcl-2抗体、Caspase-3抗体和GAPDH抗体,以及HRP标记的山羊抗兔、山羊抗小鼠二抗购自武汉三鹰生物技术有限公司。
槐杞黄清膏是槐耳菌质、黄精、枸杞的提取物,为棕褐色稠厚的半流体,由江苏启东盖天力医药有限公司馈赠;将2 g的槐杞黄溶解在20 ml的基础培养基中,作为浓度为100 mg/ml的原液,通过0.22 μm滤膜灭菌,密封后-20 ℃保存。
1.2 细胞株及细胞培养
HK-2细胞购自湖南丰晖生物科技有限公司。HK-2细胞使用含有5.5 mmol/L葡萄糖、10%胎牛血清、1%青霉素和链霉素的DMEM培养基在37 ℃、95%湿度和5%CO2的培养箱环境条件下进行培养。
1.3 细胞分组和处理
HK-2细胞分为5组:正常对照组(Control,CON)、甘露醇组(Mannitol,MAN)、高糖模型组(high glucose,HG),槐杞黄组(HQH),卡托普利组(Captopril, CAP)。正常对照组使用含有5.5 mmol/L葡萄糖的DMEM培养基正常培养;甘露醇组在正常组的基础上加入终浓度为34.5 mmol/L的甘露醇刺激48 h;高糖模型组使用含有40 mmol/L葡萄糖的DMEM培养基刺激48 h;槐杞黄组在高糖模型组的基础上加入终浓度为8 mg/ml的槐杞黄共同刺激48 h;卡托普利组在高糖模型组的基础上加入终浓度为100 μmol/L的卡托普利共同刺激48 h。甘露醇组用于排除渗透压对细胞的影响,另外,卡托普利是一种血管紧张素转换酶抑制剂,能缩小肾小球滤过膜孔径,修复其通透性,进一步减少蛋白尿和肾小管损伤[10],因此本研究选择了卡托普利作为阳性对照。
1.4 CCK-8检测细胞活力
将细胞以1×104个/孔的密度接种到96孔培养板中,当细胞融合度达到70%时,将细胞分为正常对照组、高糖模型组和不同药物浓度槐杞黄组,正常对照组使用含有5.5 mmol/L葡萄糖的DMEM培养基正常培养;高糖模型组使用含有40 mmol/L葡萄糖的DMEM培养基培养48 h;槐杞黄组在高糖模型组的基础上分别加入终浓度为2,4,6,8,10,12和14 mg/ml的槐杞黄共同孵育48 h。在干预结束后,向每孔中加入10 μl CCK-8试剂,并在37 ℃下继续孵育2 h,使用酶标仪检测450 nm的吸光度。
1.5 活性氧检测试剂盒检测ROS生成
将HK-2细胞接种到6孔板中,细胞按照1.3分组处理后,用PBS洗涤,并用10 μmol/L 2′,7′二氯二氢荧光素二乙酸酯(DCFH-DA)在37 ℃下避光孵育20 min。用无血清培养基洗涤细胞3次,在倒置荧光显微镜下观察ROS的生成并采集图像,随后用Image J软件分析图像的平均荧光强度。
1.6 HK-2细胞中SOD和MDA含量测定
超氧化物歧化酶活性检测试剂盒、丙二醛测定试剂盒测定HK-2细胞中SOD和MDA含量。细胞分组和处理后,去除培养液,收集细胞。使用超声波细胞破碎器对收集的HK-2细胞进行匀浆,离心收集上清。将上清液和工作试剂转移到96孔板中,通过计算的蛋白质浓度对SOD和MDA浓度归一化。分别在450,532,562 nm处的吸光度检测SOD、MDA和蛋白含量。
1.7 RT-qPCR检测KIM-1、NGAL mRNA表达水平
使用RNA细胞快速提取试剂盒从细胞中提取总mRNA。用PrimeScript RT reagent Kit将其逆转成cDNA。用TB Green premix Ex TaqⅡ在CFX96系统进行定量PCR分析。反应条件:95 ℃预变性30 s、95 ℃变性5 s,60 ℃退火延伸30 s,变性和退火延伸进行40个循环。以β-actin作为内参,使用2-ΔΔCt方法计算基因表达量差异。PCR引物见表1。

表1 RT-qPCR引物序列
1.8 Western blot检测Bax、Bcl-2、cleaved-Caspase-3、Caspase-3、p-AKT、AKT、p-GSK-3β、GSK-3β蛋白表达水平
将细胞在含有1%磷酸酶抑制剂和蛋白酶抑制剂混合物的RIPA缓冲液中裂解。通过BCA蛋白测定试剂盒检测蛋白浓度。通过SDS-PAGE分离所研究的蛋白质并转移至PVDF膜,将PVDF膜在室温下在含有5%脱脂奶粉的TBST中封闭2 h,加一抗(cleaved-Caspase-3、Caspase-3、p-GSK-3β、GSK-3β的稀释比例为1∶1 000,Bcl-2、p-AKT、AKT的稀释比例为1∶2 000,Bax、GAPDH的稀释比例为1∶5 000),4 ℃孵育过夜。用TBST缓冲液洗涤后,将膜与二抗(山羊抗兔二抗、羊抗小鼠二抗的稀释比例为1∶8 000)在室温孵育1 h。均匀滴加ECL显色液,于凝胶成像仪中曝光和拍照。使用Image J软件分析蛋白质灰度值,以GAPDH作为内参对照。
1.9 统计学分析
使用GraphPad Prism 8.0软件进行统计分析。实验数据以平均值±标准差表示,两组间比较使用成组t检验进行分析。多组间比较采用单因素ANOVA分析,组间两两比较用Tukey检验。以P<0.05为差异有统计学意义。
2 结果
2.1 槐杞黄对高糖诱导的HK-2细胞存活率的影响
CCK-8结果显示,与正常对照组比较,高糖模型组细胞存活率显著降低(P<0.001);与高糖模型组相比,不同浓度槐杞黄(2,4,6,8,10,12,14 mg/ml)组HK-2细胞存活率明显改善,并且当槐杞黄浓度为8 mg/ml时达到峰值(P<0.001,见图1),因此选择8 mg/ml槐杞黄用于后续实验。与正常对照组相比,高糖模型组肾小管损伤标志物KIM-1和中性粒细胞相关载脂蛋白NGAL mRNA的表达水平显著增加(P<0.001),与高糖模型组比较,槐杞黄组和卡托普利组KIM-1和NGAL mRNA的表达水平均显著降低(P<0.001);而槐杞黄组与卡托普利组相比差异无统计学意义(见图1)。
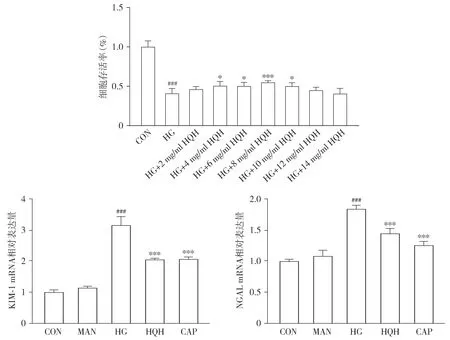
与CON比较,###P<0.001;与HG比较,*P<0.05,***P<0.001图1 HQH对高糖诱导的HK-2细胞存活率和KIM-1、NGAL mRNA水平的影响 (n=3)Figure 1 Effect of HQH on the survival rate of high glucose-induced HK-2 cells and the levels of KIM-1 and NGAL mRNA (n=3)
2.2 槐杞黄减少高糖诱导的HK-2细胞ROS的产生
与正常对照组相比,高糖模型组细胞内ROS水平显著升高(P<0.001);与高糖模型组相比,槐杞黄组和卡托普利组药物干预后ROS水平显著降低(P<0.001,见图2);而槐杞黄组与卡托普利组相比差异无统计学意义。结果表明,槐杞黄对ROS的过量产生具有显著的抑制作用。
2.3 槐杞黄抑制高糖诱导的HK-2细胞氧化应激
与正常对照组比较,高糖模型组HK-2细胞MDA含量显著升高,SOD活性显著下降(均P<0.001);与高糖模型组比较,槐杞黄组和卡托普利组MDA含量显著下降,而SOD活性显著上升(均P<0.001);而槐杞黄组与卡托普利组相比差异无统计学意义(见图3)。表明槐杞黄可以降低高糖环境下HK-2细胞中脂质过氧化反应,并提高细胞的抗氧化能力。
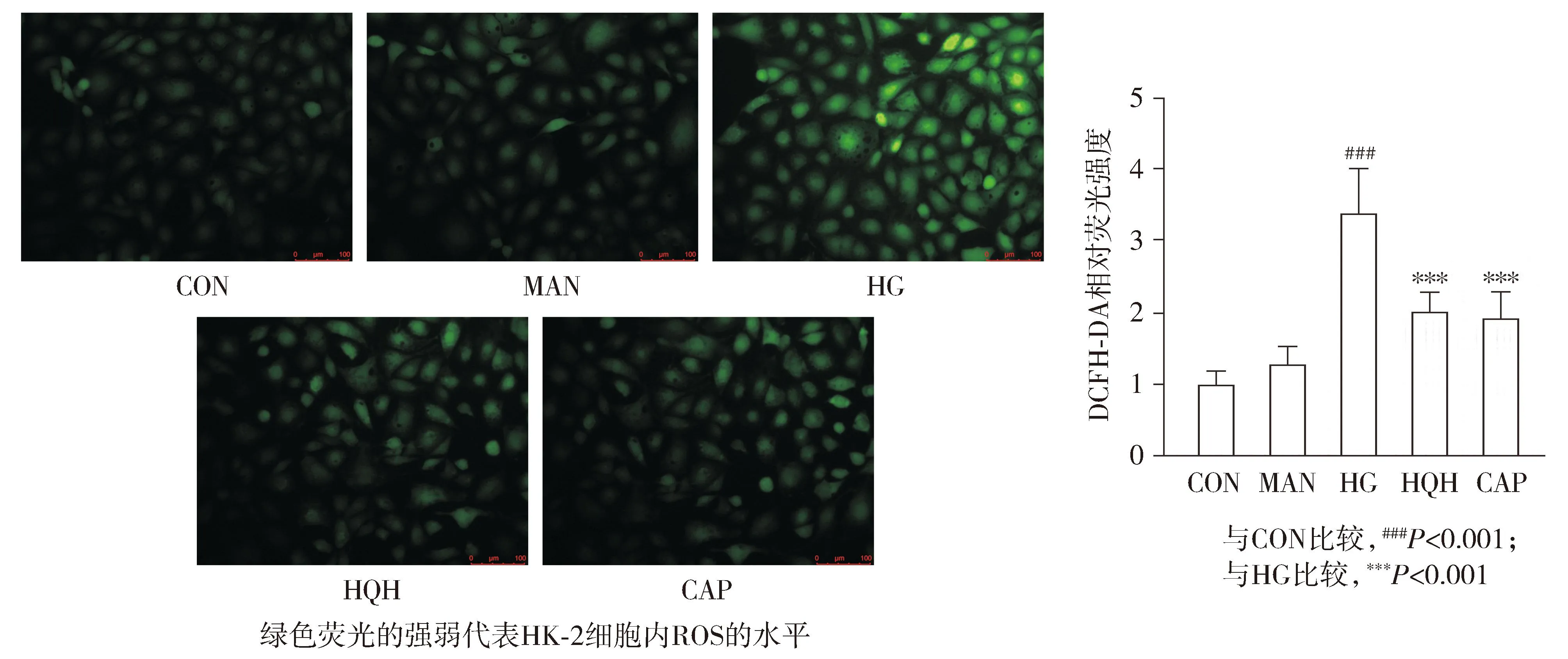
图2 DCFH-DA检测槐杞黄对高糖诱导HK-2细胞ROS表达水平的影响 (×200,n≥3)Figure 2 Effect of HQH on ROS expression in HK-2 cells induced by high glucose by DCFH-DA (×200,n≥3)

与CON比较,###P<0.001;与HG比较,***P<0.001图3 槐杞黄对高糖诱导HK-2细胞MDA和SOD含量的影响 (n=3)Figure 3 Effect of HQH on MDA and SOD contents in HK-2 cells induced by high glucose (n=3)
2.4 槐杞黄抑制高糖诱导的HK-2细胞凋亡
Western blot结果显示,与正常对照组相比,高糖模型组细胞中促凋亡蛋白Bax和cleaved-Caspase-3的表达水平显著增加(P<0.001),而抗凋亡蛋白Bcl-2的表达水平明显下调(P<0.001),同时Bcl-2/Bax比值也显著降低(P<0.001,见图4)。与高糖模型组相比,槐杞黄组和卡托普利组细胞中促凋亡蛋白Bax和cleaved-Caspase-3的表达水平显著下降(P<0.001),而抗凋亡蛋白Bcl-2的表达水平明显上调(P<0.01),同时Bcl-2/Bax比值也显著上升(P<0.001,见图4)。槐杞黄组与卡托普利组相比差异无统计学意义。
2.5 槐杞黄对AKT/GSK3β信号通路的调控效应
与对照组比较,高糖模型组p-AKT蛋白表达水平明显减少(P<0.001),p-GSK-3β蛋白表达水平明显增加(P<0.001);与高糖模型组比较,槐杞黄组和卡托普利组p-AKT表达上升(P<0.01),p-GSK-3β表达水平降低(P<0.01,见图5)。槐杞黄组与卡托普利组相比差异无统计学意义。
3 讨论
DKD是糖尿病最严重的并发症之一,并且是慢性肾脏病的最常见原因[11]。越来越多的证据表明,氧化应激和细胞凋亡与糖尿病诱导的肾损害有关[12,13]。肾小球系膜扩张、基底膜增厚和肾小管损伤是DKD的主要形态学改变,这些病理改变均与氧化应激和细胞凋亡有关[14,15]。在这种情况下,抗氧化应激和抗细胞凋亡可能为DKD的治疗提供有希望的策略[16,17]。近年来,中成药槐杞黄颗粒由于其具有抗氧化和抗凋亡特性而被广泛研究[18,19]。
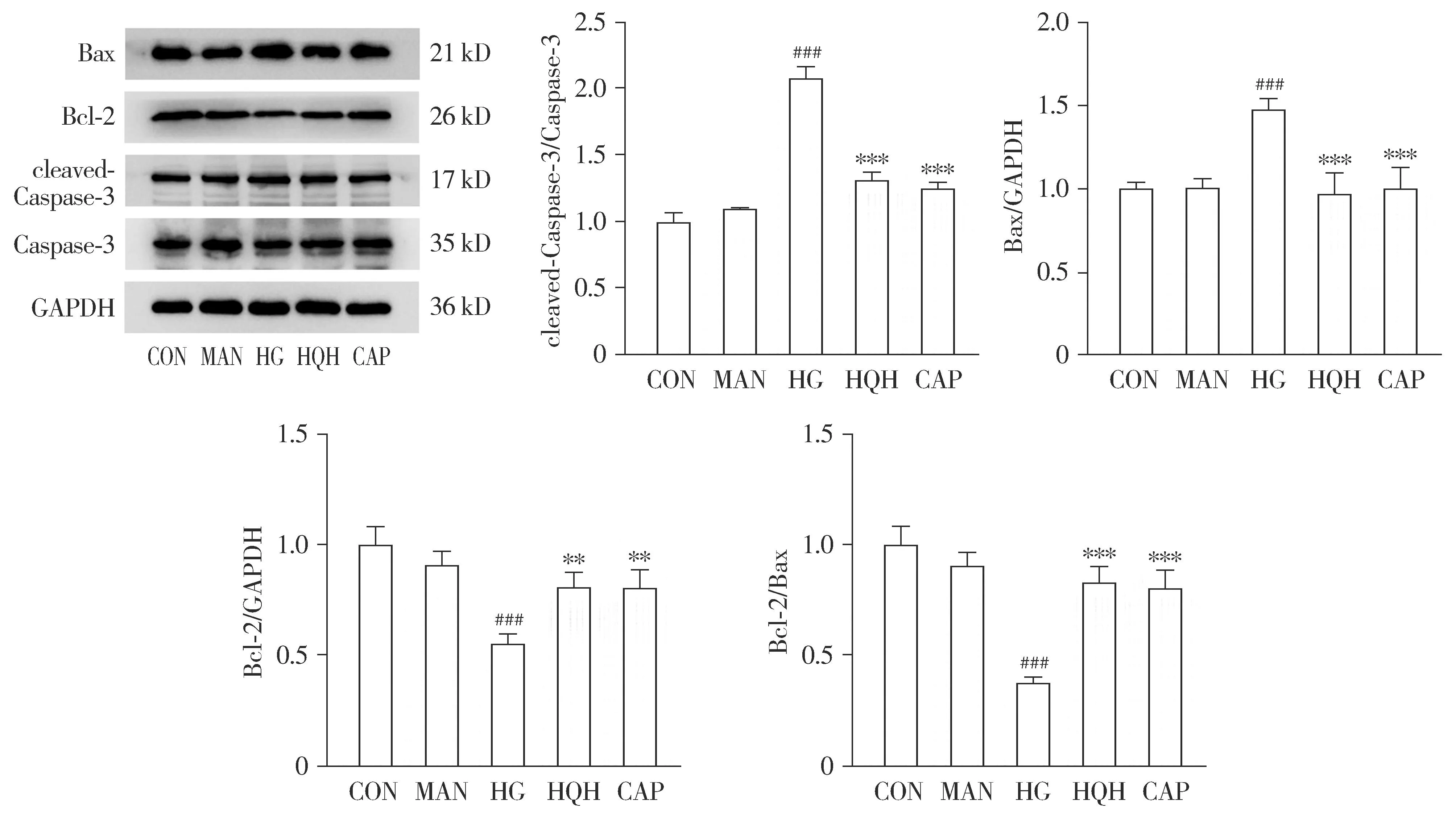
与CON比较,###P<0.001;与HG比较,**P<0.01,***P<0.001图4 Western blot法检测槐杞黄对高糖诱导HK-2细胞Bcl-2、Bax、Caspase-3和cleaved-Caspase-3表达的影响 (n=3)Figure 4 Effect of HQH on expressions of Bcl-2, Bax, Caspase-3 and cleaved-Caspase-3 in HK-2 cells induced by high glucose by Western blot (n=3)
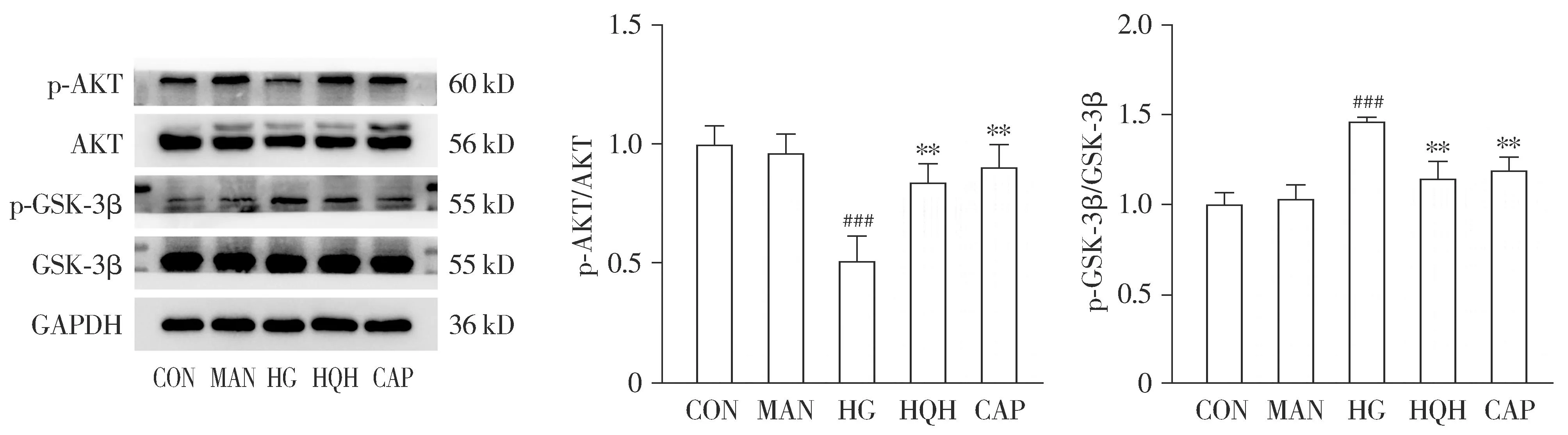
与CON比较,###P<0.001;与HG比较,**P<0.01图5 Western blot法检测槐杞黄对AKT/GSK3β信号通路的影响 (n=3)Figure 5 Effects of HQH on AKT/GSK3β signaling pathway by Western blot (n=3)
先前的研究指出,槐杞黄对肾脏疾病甚至多种癌症都有辅助治疗作用,其具体机制可能涉及氧化应激、免疫、自噬、凋亡、铁死亡和焦亡等[20,21]。在本研究中,高糖环境下HK-2细胞存活率显著下降,细胞受到生长抑制。细胞内氧化应激反应的增加导致细胞内产生大量的ROS,破坏细胞内稳态平衡。实时荧光定量PCR结果显示,高糖组肾小管损伤标记物(KIM-1)、中性粒细胞相关载脂蛋白(NGAL)mRNA表达水平增加,槐杞黄干预减轻了高糖对HK-2细胞存活率的抑制作用及其对肾小管的损害程度,以上结果说明槐杞黄对高糖诱导HK-2细胞损伤有明显改善作用。
来自体外和体内的大量数据表明,氧化应激与DKD的发病机制有关,抗氧化应激可能为预防和治疗糖尿病诱导的肾损伤提供新的治疗思路[22,23]。SOD是在各种器官中提供针对氧化应激的第一线酶促抗氧化防御的最重要的保护酶,MDA是膜脂质过氧化的终产物之一[24],已有研究表明肾损伤中SOD活性降低,MDA含量增加[25]。而本研究也通过对SOD活性和MDA水平的检测,发现高糖能够增加MDA含量,并减少SOD活性,引起细胞氧化损伤;而用槐杞黄药物进行干预后,受损的细胞内MDA含量降低,SOD活性升高。这些数据证实了槐杞黄可以通过提高HK-2细胞中SOD活性,抑制MDA含量,从而抑制高糖诱导的HK-2细胞氧化应激损伤。
以往的研究已经证实细胞凋亡在高血糖刺激后肾脏结构和功能损伤中起着至关重要的作用,但这种损伤和功能障碍的潜在机制尚未得到很好的解释[26]。为探讨槐杞黄对糖尿病肾病的保护作用及其减轻肾脏损害的具体作用机制,本研究采用免疫印迹法检测HK-2细胞中凋亡相关蛋白Bax、Bcl-2和cleaved-Caspase-3的表达。发现与对照组比较,高糖对HK-2细胞中Bcl-2蛋白表达水平具有显著抑制作用,对Bax和cleaved-Caspase-3蛋白水平具有明显的促进作用;而槐杞黄干预显著提高了Bcl-2蛋白的表达,并降低了Bax和cleaved-Caspase-3蛋白的表达。这表明槐杞黄能够抑制高糖诱导的HK-2细胞凋亡。AKT信号通路已被证实参与糖尿病肾病的发病机制。AKT磷酸化可以改善糖尿病动物的抗凋亡和抗氧化能力,但AKT磷酸化也可以被氧化应激抑制[27]。当AKT磷酸化降低时,其下游因子GSK-3β磷酸化被激活,其他凋亡相关因子如Bax和cleaved-Caspase-3表达增加[28]。为进一步验证槐杞黄对高糖诱导的HK-2细胞保护作用机制,我们又检测了AKT及其下游GSK3β的蛋白的表达水平,通过Western blot检测发现在高糖处理下,HK-2细胞中p-AKT表达降低,p-GSK-3β表达升高,高糖诱导HK-2细胞GSK-3β磷酸化水平增加,说明GSK-3β在高糖诱导的HK 2细胞中活性受到了抑制。而经槐杞黄处理后,p-AKT蛋白的表达显著提高,并p-GSK-3β蛋白的表达降低。上述结果揭示了槐杞黄治疗糖尿病肾病的分子机制,表明槐杞黄可能是通过激活AKT信号通路并抑制GSK3β磷酸化来调控细胞的氧化应激反应和凋亡过程。
综上所述,槐杞黄具有良好的抗氧化功能,并能够抑制高糖诱导的HK-2细胞凋亡,其机制可能与调控AKT/GSK3β信号通路有关。本研究局限于体外细胞水平,后续还需在体内实验深入研究HQH延缓糖尿病肾病的进展与氧化应激和凋亡的关系,以及其影响AKT/GSK3β信号通路的具体机制。
