金针菇菌糠纤维素降解菌的分离、生物学特性及酶活性分析
2024-01-12周云昊李小冬尚以顺刘凤丹裴成江李世歌刘军林
周云昊,李小冬,宋 莉,尚以顺,刘凤丹,裴成江,李世歌,刘军林
(1.贵州省农业科学院/贵州省草业研究所,贵州 贵阳 550006;2.贵州大学生命科学学院/贵州大学农业生物工程研究院/山地植物资源保护与种质创新教育部重点实验室/贵州省农业生物工程重点实验室,贵州 贵阳 550025;3.贵阳康养职业技术大学,贵州 贵阳 550000;4.威宁彝族回族苗族自治县山地特色农业科学研究所,贵州 威宁 553100)
食用菌的培养基质主要由木屑、棉籽壳、玉米芯等原料组成, 采摘食用菌后剩余的培养基即为菌糠。菌糠不仅含有丰富的粗蛋白质、粗脂肪和游离氨基酸等营养物质, 而且还含有菌糠多糖、黄酮、小肽、三萜类化合物等多种功能性成分,具有较高的饲料原料开发价值[1]。 菌糠木质纤维素含量较高, 作为饲料饲喂家畜时会影响采食量和饲料消化率,因此,筛选并研究高效的纤维素降解菌对促进菌糠资源饲料化利用具有重要意义。 已知能够产生纤维素降解作用的微生物主要有3 类:第一类是以木霉属、曲霉属、青霉属以及白腐真菌等为代表的真菌类,具有产酶量大、酶活性高等特点,是目前纤维素酶商品的主要生产菌种[2];第二类是以芽孢杆菌、纤维单胞菌、假单胞菌等为代表的细菌类,通常具有种类多、产酶量大、易于工业化发酵培养等特点, 因取样来源不同可筛选获得特定的高活性菌株,前人已分别从酒糟泥[3]、油菜秸秆[4]、红树林土壤[5]以及绵羊胃肠道[6]中分离筛选到高性能的纤维素降解菌,因此,特定环境下的纤维素降解菌的分离与鉴定是目前的研究热点领域之一;第三类是以链霉菌属为代表的放线菌,在极端环境中仍具有较高的纤维素降解活性[7],在医药[8]和生物能源[9]等领域具有应用价值。
目前针对食用菌菌糠来源的纤维素降解菌的筛选已有一些研究报道。 陶治东等[10]从香菇菌糠中筛选获得里氏木霉DGW1 株, 该菌株具有高效的纤维素降解活性;郭仲杰等[11]从双孢蘑菇培养料中筛选获得3 株相对高效的纤维素降解微生物,但未进行物种鉴定。目前关于食用菌菌糠的研究以香菇菌糠肥料化或者作为育苗培养基质利用为主,雷忠萍等[12]利用香菇菌糠和鸡粪混合发酵生产有机肥,在猕猴桃、苹果、葡萄等果树上应用增产和减病效果明显。宗玉丽等[13]将香菇菌糠、牛粪、米糠按体积比为6∶2∶2 混合均匀发酵后用于棚栽黄瓜试验,处理组的产量优于对照组,品质没有显著差异。 薄璇等[14]利用香菇菌糠为基质配合磷酸二铵、尿素、硫酸钾和硫酸锌等肥料用于油松育苗效果较好。 对利用纤维素降解菌发酵制备食用菌菌糠饲料的研究较少。 本研究以金针菇菌糠为原料分离筛选纤维素降解菌,通过16S rDNA 确定分离菌株的种属, 并测定候选菌株的生长特性及所产纤维素降解酶活性, 以期为金针菇菌糠的饲料化开发利用提供具有开发潜力的候选菌株。
1 材料与方法
1.1 试验材料
1.1.1 试验原料
于2020 年6 月从贵州省毕节市威宁县威宁雪榕生物科技有限公司种植基地采集金针菇菌糠,样品经自然腐败30 d 后用于纤维降解菌的分离与筛选。
1.1.2 试验试剂
LB 固体及液体培养基、 硝酸纤维素钠培养基、刚果红培养基参考姜立春等[15]报道的方法配制。 纤维素酶活性检测试剂盒购自北京索莱宝科技有限公司(货号:BC2545,规格:100T/48S)。
1.2 试验方法
1.2.1 样品处理
称取10 g 菌糠样品放入250 mL 无菌锥形瓶中,加入无菌水90 mL,于30 ℃恒温振荡培养箱中120 r/min 振荡培养2 h,使菌糠微生物群落被无菌水充分洗脱,形成筛选原始菌液,备用。
1.2.2 纤维素降解菌的初步分离
采用梯度稀释方法, 分别取10-1、10-3、10-5、10-7、10-9稀释度的菌液均匀涂布于硝酸纤维素钠培养基上,于30 ℃培养箱中倒置培养5 d。 挑出不同形态的单菌落,采用划线分离的方法纯化3 代,直至平板上的菌落形状、颜色一致,获得单一菌种。 将活化后的单一菌种液体培养物加入50%灭菌甘油,混合均匀后保存在-80 ℃冰箱中,备用。
1.2.3 分离菌株的纤维素降解能力初步筛选
吸取10 μL 活化菌液, 接种于刚果红培养基上,置于28 ℃培养箱中培养5 d,观察并记录菌落周围产生的透明圈直径大小(D)和菌落直径大小(d),计算其比值R=D/d。 根据R 值的大小初步确定菌株对纤维素的降解能力,每株菌设3 个重复。
1.2.4 分离菌株的16S rDNA 序列分析及生物安全性预测
参考曹波等[16]报道的方法,采用引物16S-27F、16S-1 492R 组合进行分离菌株的16S rDNA全长PCR 扩增,委托成都擎科生物有限公司进行16S rDNA 测序。 根据BLAST 结果构建系统发育树, 确定分离菌株的种属。 比对检索ATCC(https://www.atcc.org/)和CLIMA 2(https://bioinformatics.hsanmartino.it/clima2/)数据库,对菌种的生物安全性进行预测,评分越低,生物安全风险越低。 根据分离菌株的纤维素降解能力初筛结果及生物安全性预测结果, 选取具备一定纤维素降解能力且无潜在致病力的候选菌株进行后续试验。
1.2.5 纤维素降解菌的生理生化特性分析
候选菌株的生理生化特性分析具体参考张爽[17]报道的方法。 接触酶试验:用移液枪吸取30 μL 菌液均匀涂抹于滴有30 μL 3% H2O2溶液的载玻片上,25 ℃反应5 min 后观察是否有气泡产生,以无菌水作为阴性对照。 甲基红(MR)试验:接种30 μL 菌液到含1 mL LB 液体培养基的试管中, 分别在28 ℃恒温培养箱中培养12、72、120 h后,滴入3 滴甲基红试剂(甲基红0.1 g,95%乙醇溶液300 mL,蒸馏水200 mL),观察试管内颜色变化情况,红色为阳性,黄色为阴性。 二乙酰(VP)试验: 吸取30 μL 菌液接种于1 mL LB 液体培养基中,28 ℃静置培养48 h 后, 加入1 mL O′Meara 试剂(含0.3%肌酸的40%NaOH 溶液),充分振荡混匀,于36 ℃恒温培养箱中静置孵育10 min 后观察颜色变化,反应液呈红色,判定为阳性;不呈现红色时,再培养4 h 后继续观察其颜色变化,若4 h内不呈现红色,判定为阴性。 革兰染色:薄涂菌于固定涂片上,滴少许革兰染色液染色,约1 min 后水洗;用碘液冲去残留液体,待水分干后,缓慢滴入95%乙醇脱色30 s, 至紫色退去后用水轻微冲洗; 最后用番红染色液进行复染, 约1 min 后水洗,自然条件下晾干,用光学显微镜观察,若观察到菌体呈蓝紫色则为革兰阳性细菌, 红色为革兰阴性细菌。
1.2.6 纤维素降解菌的生长曲线测定
以LB 液体培养基为基质,探索候选菌株的最适培养温度。 接种活化的菌株液体培养物到50 mL培养基中, 设28、31、34、37、40 ℃共5 个温度梯度, 每个温度下振荡培养1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16 h 后分别取样, 通过利用酶标仪测定600 nm 波长处的吸光度值 (OD600nm值)来反映菌液浓度。 将测得的OD600nm值与相应的培养时间作图,绘制菌株生长曲线。
1.2.7 纤维素降解菌的酶活测定
参考冯欣欣等[18]报道的3,5-二硝基水杨酸(DNS)法测定候选菌株的纤维素降解酶活性。 分别配制1 mg/mL 的葡萄糖标准液,6.3 mg/mL DNS溶液,0.05 mol/L 的柠檬酸缓冲液 (pH 值=5.0)和0.02 mol/L 的醋酸缓冲液(pH 值=4.8),备用。 取1 mL 菌液样品接种至100 mL 液体产酶培养基中, 于40 ℃恒温摇床培养7 d, 培养期间每天取100 mL 菌液3 000 r/min 离心10 min,取上清液即为粗酶液。 对照菌株为前期筛选获得的枯草芽孢杆菌(Bacillus subtilis,B.subtilis)[19]。 采用葡萄糖标曲法测定各时间点筛选菌粗酶液的内切葡聚糖酶活性、外切葡聚糖酶活性、β-葡萄糖苷酶活性和滤纸酶活性,每个时间点每株菌设3 个重复。
1.3 数据处理
采用Excel 2010 和DPS 17.10 软件对试验数据进行整理及统计分析,结果采用“平均值±标准差”的形式表示。不同菌株的菌落直径和透明圈直径比较采用单因素方差分析,利用Duncan′s 法进行多重比较; 酶活性分析采用t 检验进行差异显著性分析。 P<0.05 表示差异显著。
2 结果与分析
2.1 纤维素降解菌的分离及纤维素降解能力初筛
以硝酸纤维素钠为唯一碳源, 从金针菇菌糠样品中分离筛选纤维素降解菌30 株。将菌株接种到刚果红培养基, 通过分析透明圈直径和菌落直径大小的比值初步鉴定各菌株的纤维素降解能力。 所有菌株形成的菌落周围都能产生明显的透明圈, 代表性菌株在刚果红培养基上的生长情况见图1。 由表1 可知,部分菌株的菌落直径及透明圈直径存在显著(P<0.05)差异;菌株JK-54、JK-56 和JK-65 的菌落直径最大,均为4.8 mm,表明这些菌株的生长活性较好; 菌株JK-56 的透明圈直径最大,为21.5 mm,其次为菌株JK-27 和JK-34,透明圈直径均为20.0 mm,表明这些菌株具有较强的纤维素酶分泌能力。 综合分析透明圈直径(D)和菌落直径(d)比值(R),纤维素酶分泌能力较强(R≥4)的菌株共有10 株,分别为JK-27、JK-32、JK-34、JK-25、JK-56、JK-22、JK-58、JK-3、JK-21、JK-66。
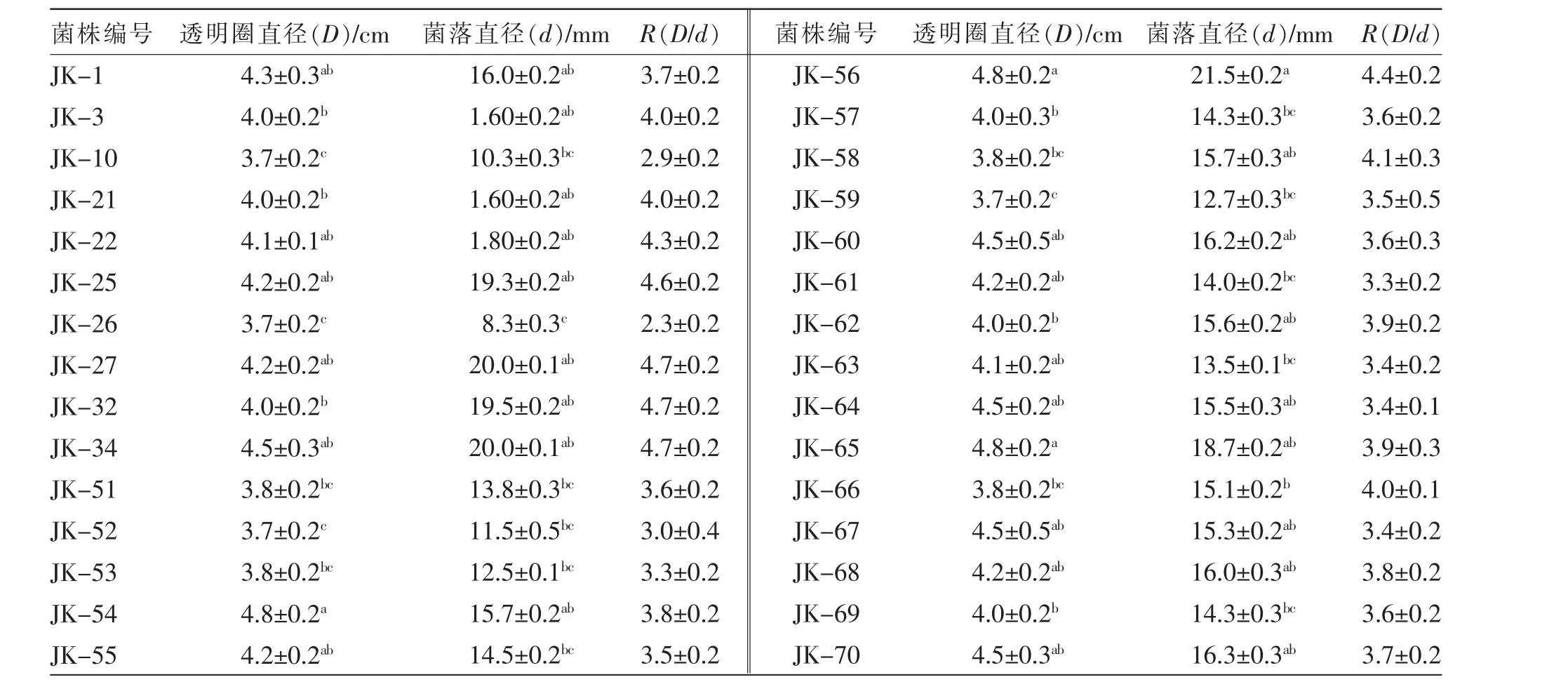
表1 30 株纤维素降解菌在刚果红培养基上的菌落和透明圈直径
2.2 16S rDNA 测序与序列比对分析
为确定分离菌株的种属,采用PCR 方法扩增了30 株分离菌的16S rDNA 序列全长并进行测序,然后分别在NCBI 数据中进行BLAST 比对,与已报道菌种的16S rDNA 序列构建系统进化树。分析结果显示,30 株分离菌被鉴定为韩国假单胞菌(Pseudomonas koreensis,n=4)、 松 鼠 葡 萄 球 菌(Staphylococcus sciuri,n=2)、中间布鲁菌(Brucella intermedia,n=3)、 明 斯 特 小 陌 生 菌(Advenella mimigardefordensis,n=3)、深红沙雷菌(Serratia rubidaea,n=6)、 马葡萄球菌 (Staphylococcus equorum,n=1)、Joostei 金杆菌(Chryseobacterium joostei,n=1)、腐生葡萄球菌(Staphylococcus saprophytics,n=5)、黏质沙雷菌(Serratia marcescens,n=5)共9 个菌种 (见表2)。 通过检索ATCC(https://www.atcc.org/) 和CLIMA 2(https://bioinformatics.hsanmartino.it/clima2/) 数据库发现, 中间布鲁菌与Joostei 金杆菌的生物安全性评分分别为3 和2,提示其为潜在的致病菌,不适用于后续研究。

表2 纤维素降解菌代表性菌株种属鉴定及生物安全性分析
综合生物安全性预测结果和分离菌株的纤维素降解能力初筛结果, 测序为同一个菌种的选取R 值相对较大的株系用于后续分析, 其中松鼠葡萄球菌因保存失误导致菌种丢失,故选取6 株(菌株编号分别为JK-32、JK-52、JK-56、JK-57、JK-62、JK-66) 具有一定纤维素降解活性且不具有生物安全风险的菌株作为候选菌株进行后续试验。
2.3 候选菌株的生理生化特性分析
参照《常见细菌系统鉴定手册》[20],对6 株候选菌株进行生理生化特性分析(见表3)。MR 试验结果显示,候选菌株JK-32、JK-52、JK-56、JK-57、JK-62 和JK-66 在孵育24、48、120 h 后的鉴定结果均为阴性。 接触酶试验结果显示,菌株JK-52、JK-56、JK-57、JK-62、JK-66 和JK-32 均为阳性。VP 试验结果显示, 候选菌株JK-52、JK-56、JK-57、JK-62、JK-66 和JK-32 均为阴性。革兰染色结果显示,JK-57 株和JK-62 株为革兰阳性,其余菌株均为革兰阴性。

表3 6 株纤维素降解菌候选菌株的生理生化特性分析
2.4 候选菌株的生长曲线绘制
为明确候选菌株的最适生长温度,在28、31、34、37、40 ℃共5 个温度下分析候选菌株在LB 液体培养基中的生长情况(见图2)。 在28 ℃生长条件下,除JK-57 株外,所有候选菌株在培养后2 h进入对数生长期;JK-56 株与JK-66 株在培养后7 h 达到平台期,生长趋于稳定,且最终细菌浓度低于其余菌株,而其余菌株在培养后13 h 才达到平台期。 在31 ℃生长条件下,不同菌株的生长速率存在差异,JK-56 与JK-52 株在培养早期阶段生长速率较其他菌株慢,进入对数生长期相对较晚(培养后4 h), 其余菌株在培养后1~2 h 进入对数生长期;在整个培养过程中,JK-56 株的生长速率和最终细菌浓度低于其他菌株。 随着培养温度的升高(34~40 ℃),不同菌株间的生长速率和最终细菌浓度的差异减小,在培养1~3 h 后进入对数生长期,7~9 h 进入平台期。 综合来看,JK-62 株的生长受温度影响较小,28~40 ℃生长条件下生长特性比较稳定, 细菌生长速率和最终细菌浓度在所有菌株中表现较好;而JK-56 株的生长受温度影响较大,在温度较低(28~34 ℃)的培养条件下,其生长速率和最终细菌浓度均低于其他菌株; 当培养温度上升到40 ℃时,JK-56 株和其他菌株的生长速率相近,并且最终细菌浓度较高。

图2 纤维素降解菌候选菌株在不同培养温度下的生长曲线
2.5 候选菌株的纤维素降解酶活性测定
以已报道的具有较好纤维素降解能力的枯草芽孢杆菌(B.Subtilis)[17]为对照,分析对照菌株CK和候选菌株JK-32、JK-52、JK-56、JK-57、JK-62和JK-66 的内切葡聚糖酶活性、 外切葡聚糖酶活性、β-葡萄糖苷酶活性和滤纸酶活性的动态变化。4 种酶活性在不同纤维素降解菌株中表现出相同的变化趋势, 都是随着培养时间的延长先升高再降低,在培养第3 天达到峰值,然而不同纤维素降解酶的活性在各菌株之间也存在差异。
如图3A 所示, 在整个检测过程中,JK-56 株的内切葡聚糖酶活性在所有菌株中均最高, 在培养第2~5 天显著(P<0.05)高于CK 菌株;JK-52 株的内切葡聚糖酶活性始终处于最低或较低水平,在不同检测时间点均显著(P<0.05)低于CK 菌株;在培养第2、4、5 天,JK-66 株的内切葡聚糖酶活性显著(P<0.05)高于CK 菌株;在培养第3 天,JK-57 株和JK-62 株的内切葡聚糖酶活性显著 (P<0.05)高于CK 菌株;在培养第5~7 天,JK-32 株的内切葡聚糖酶活性显著(P<0.05)低于CK 菌株。
如图3B 所示,JK-52 株与JK-66 株的外切葡聚糖酶活性在所有菌株中始终处于较高水平,在不同检测时间点均显著(P<0.05) 高于CK 菌株;JK-57 株的外切葡聚糖酶活性始终处于最低水平,在不同检测时间点均显著(P<0.05)低于CK 菌株;在培养第2~4 天,JK-56 株的外切葡聚糖酶活性显著(P<0.05)高于CK 菌株。
如图3C 所示,JK-57 株的β-葡萄糖苷酶活性始终处于最低水平, 在不同检测时间点均显著(P<0.05) 低于CK 菌株,JK-52 株的β-葡萄糖苷酶活性在整个检测过程中也显著 (P<0.05) 低于CK 菌株;JK-62 株和JK-66 株的β-葡萄糖苷酶活性在6 株候选菌株中始终处于较高水平, 在培养第3~5 天,二者的β-葡萄糖苷酶活性均稍高于CK 菌株,JK-62 株在培养第5 天差异达显著水平(P<0.05),其余时间点差异不显著(P>0.05);在培养中后期(第3~7 天),JK-56 株的β-葡萄糖苷酶活性有所提高, 在6 株候选菌株中仅次于JK-62株和JK-66 株;而在培养早期和晚期(第1 天和第7 天),JK-32 株和JK-56 株的β-葡萄糖苷酶活性均显著(P<0.05)低于CK 菌株,此外,JK-32 株的β-葡萄糖苷酶活性在培养第4、5、6 天也显著(P<0.05)低于CK 菌株。
如图3D 所示,在培养早期(第1 天),各候选菌株的滤纸酶活性均显著(P<0.05)低于CK 菌株,而在培养后期(第6~7 天),除JK-57 株外其余候选菌株的滤纸酶活性与CK 菌株差异均不显著(P>0.05);JK-57 株在整个培养过程中滤纸酶活性显著(P<0.05) 低于CK 菌株; 在培养第2~5 天,JK-56 株的滤纸酶活性在6 株候选菌株中处于最高水平,在培养第5 天时显著(P<0.05)高于CK 菌株,在此期间,JK-66 株的滤纸酶活性也处于较高水平。
综上所述, 在6 株候选菌株中, 深红沙雷菌JK-56 株和黏质沙雷菌JK-66 株的4 种纤维素降解酶活性整体水平较高, 特别是在内切葡聚糖酶和外切葡聚糖酶活性方面表现突出, 提示其具有较强的纤维素降解能力。
3 讨论
3.1 纤维素降解菌的分离与培养
自然界中有丰富的纤维素降解微生物, 其对纤维素的降解能力受微生物种类及其生长环境和利用底物的影响[21]。 前人已经分别从酒糟、醋渣、堆肥以及秸秆等中分离鉴定了大量的纤维素降解微生物,种类包括真菌、细菌和放线菌等,活菌制剂或其提取物已经在造纸、生物燃料、纺织、食品与饲料等行业中开展应用[2,22]。本研究从金针菇菌糠中分离筛选获得了9 种具有纤维素降解能力的细菌,分别为韩国假单胞菌、松鼠葡萄球菌、中间布鲁菌、明斯特小陌生菌、深红沙雷菌、马葡萄球菌、Joostei 金杆菌、腐生葡萄球菌、黏质沙雷菌等,初步筛选均表现出较明显的降解作用。武凤霞等[23]从水稻秸秆样品中筛选获得了1 组纤维素降解菌群,其中沙雷菌是核心菌种之一,本研究也筛选获得了黏质沙雷菌和深红沙雷菌, 且具有较强的纤维素降解能力,与其结果相互印证。赵寅锋等[24]从发酵菌糠中筛选获得了1 株高效纤维素降解菌K-3 为鲍曼不动杆菌。 王雪郦等[19]从废弃菌糠中分离筛选获得了7 株具有较好纤维素降解能力的细菌,分别属于枯草芽孢杆菌和解淀粉芽孢杆菌,与本研究筛选的菌种不一致, 可能与采样菌糠来源及培养方式差异有关。 王雪郦等[19]发现以羟甲基纤维素钠和纤维素粉两种不同碳源筛选获得的纤维素降解菌也不相同。
3.2 纤维素降解菌生长与环境温度的关系
培养基组成、培养方式、培养温度等是影响纤维素降解菌生长速率和酶活性的主要因素, 前人根据利用目的和利用场景选择性筛选高温、 低温以及常温纤维素降解菌。 江高飞等[25]从秸秆堆肥中筛选到耐高温的纤维素降解菌在55~80 ℃仍具有较好的纤维素降解能力。 张楠等[26]从牛粪堆肥中也筛选获得耐高温的纤维素降解菌株, 但其最适生长温度为45~55 ℃, 可以用于堆肥及环保等领域。岳林芳等[27]从腐殖土、稻草、羊粪、驴粪等样品中分离获得了常温和低温纤维素降解菌, 其中常温条件下第一优势菌属为芽孢杆菌, 而在低温条件下,第一优势菌属为假单胞杆菌。说明在不同生长温度下, 纤维素降解菌的优势菌群结构可能存在较大差异。 单一菌种的生长速率和最终浓度也受培养温度的影响,周毅峰等[28]发现桐粕降解菌DBTM6 在45 ℃培养条件下的最终菌体浓度(OD600nm吸光值) 显著高于30 ℃和50 ℃培养条件。 本研究的目标是针对常温条件下的纤维素降解菌的筛选和利用, 因此重点分析候选菌株在28~40 ℃条件下的生长曲线变化,发现随着温度升高, 各细菌的生长速率和最终浓度均有不同程度的增加,这与阳刚等[29]关于白酒糟纤维素降解菌的最优生长条件模型研究的结论基本吻合。此外,本研究还发现深红沙雷菌和黏质沙雷菌的生长速率受低温影响较明显, 在温度较高时与其他纤维素降解菌差异不显著, 从侧面反映其为高温偏好型细菌,与武凤霞等[23]的研究结论一致。
3.3 纤维素降解菌的酶活性分析
目前纤维素降解机制的主流模型是协同作用模型,由内切葡聚糖酶、外切葡聚糖酶以及β-葡萄糖苷酶等协同作用将纤维素降解为葡萄糖[30]。与真菌类纤维素降解菌相比, 产纤维素酶细菌的酶体系相对不够完善、 水解纤维素的效率相对较低, 在实际应用中往往需要多种细菌协同作用提高纤维素降解效率[31]。 李静等[32]研究发现由3 种菌组成的复合菌系比单菌株菌剂秸秆降解率提高了50.71%,说明单个细菌可能只在纤维素降解过程中的某个或某些环节起主要作用。 本研究比较了筛选的6 个候选菌株与已知的枯草芽孢杆菌纤维素降解酶活性差异, 在产酶的高峰期 (培养第3~5 天), 深红沙雷菌(JK-56 株) 和黏质沙雷菌(JK-66 株,除第3 天外)的内切酶活性显著高于枯草芽孢杆菌(CK);明斯特小陌生菌(JK-52)、深红沙雷菌(JK-56 株,除培养第5 天外)和黏质沙雷菌(JK-66 株)的外切酶活性显著高于枯草芽孢杆菌;而所有的候选菌株中,除深红沙雷菌(JK-56株)、黏质沙雷菌(JK-66 株)和腐生葡萄糖球菌(JK-62 株) 的β-葡萄糖苷酶与芽孢杆菌差异不显著外, 其余菌株均不同程度弱于对照芽孢杆菌或与其相近,因此在滤纸酶活性分析中,除深红沙雷菌(JK-56 株)外,其余候选菌不同程度弱于对照芽孢杆菌,随着培养时间延长,候选菌株各功能酶活性增强后趋于稳定, 候选菌株与对照菌株间的差异也逐渐减少。综合分析,深红沙雷菌和黏质沙雷菌对金针菇菌糠有较强的纤维素降解能力,如果能够配合具有较强β-葡萄糖苷酶活性的菌种配合成复合菌系可能有更好效果。
4 结论
从金针菇菌糠中分离筛选获得了6 株纤维素降解菌候选菌株,其中,深红沙雷菌JK-56 株和黏质沙雷菌JK-66 株纤维素降解酶活性整体水平较高,且内切葡聚糖酶和外切葡聚糖酶活性表现突出,可以与具有较强β-葡萄糖苷酶活性的菌种配合成复合菌系应用于金针菇菌糠资源化开发利用。
