新疆维吾尔自治区和田地区规模化羊场腹泻羔羊源大肠杆菌的分离鉴定及毒力基因和耐药基因分析
2024-01-12于月通马志远盛光玉陶大勇
董 贵,于月通,马志远,王 尧,盛光玉,陶大勇,齐 萌
(1.塔里木大学动物科学与技术学院/新疆生产建设兵团塔里木动物疫病诊断与防控工程实验室, 新疆 阿拉尔843300;2.塔城职业技术学院,新疆 塔城 834700)
大肠杆菌(Escherichia coli)是引起羔羊腹泻的主要病原菌之一, 可导致腹泻羔羊50%以上的死亡率,常给羊养殖业造成较大的经济损失[1]。 根据Clermont 等[2]建立的分群方法,将大肠杆菌分为A 群、B1 群、B2 群和D 群, 不同群组间大肠杆菌携带的毒力基因具有一定差异。研究表明,大肠杆菌所携带的毒力基因种类与致病性有密切关系,其中肠细胞脱落位点(locus of enterocyteeffacement,LEE) 毒力岛、 耶尔森菌强毒力岛 (highpathogenicity island,HPI)可编码多种毒力基因,是致病性大肠杆菌重要的毒力因子[3]; 溶血素(hemolysin,Hlf)可溶解细胞,造成严重的细胞毒性,在大肠杆菌致病过程中起到了重要作用[4]。 由于临床生产中使用抗菌药物不合理, 导致大肠杆菌的耐药性不断增强, 给羊大肠杆菌病的防治带来较大的挑战。令人担忧的是,耐药的动物源大肠杆菌及其耐药基因可通过食物链、 生产链和粪便等途径传给人类,危害人类健康[5]。
随着新疆维吾尔自治区和田地区养羊业的快速规模化发展,圈养羊数量不断增加,羊腹泻发生较普遍,对养羊业的健康发展构成较大的威胁。生产中为治疗羊腹泻, 基层养殖人员大量使用抗菌药物,造成羊源大肠杆菌产生较多耐药株,其耐药机制也日趋复杂,呈现多种耐药现象,潜在影响了羊肉食品质量安全和环境卫生安全[6]。 本试验旨在分离鉴定和田地区规模化养殖场腹泻羔羊粪便中的大肠杆菌,检测其毒力基因和耐药基因,以期为该地区规模化羊场合理用药, 预防和治疗羔羊腹泻病提供有益参考依据。
1 材料与方法
1.1 试验材料
1.1.1 粪便样本来源
于2019 年1—9 月,分别在和田地区策勒县、和田县和于田县3 个规模化羊场收集40 日龄以内腹泻羔羊肛拭子样本共70 份,其中策勒县23份、和田县30 份和于田县17 份, 标记信息后置4 ℃冷藏箱,送至实验室,4 ℃冰箱保存。
1.1.2 主要试剂
Luria-Bertani(LB)液体培养基、麦康凯琼脂(MAC)培养基、伊红美兰琼脂(EMB)培养基,奥博星生物技术(北京) 有限责任公司产品;DL 2 000 Marker、2×Easy Taq PCR Super Mix(+dye)、细菌基因组DNA 提取试剂盒,全式金生物技术(北京)有限公司产品;细菌微量生化反应管,滨和微生物试剂(杭州)有限公司产品;革兰染色液,为笔者所在实验室自配。
1.2 试验方法
1.2.1 粪便样本处理
1.2.2 大肠杆菌的分离及形态学鉴定
取上述增菌液中的菌液分别划线接种于EMB 固体培养基、MAC 固体培养基,37 ℃恒温培养18 h,挑选在EMB 平板上呈现金属光泽的单一菌落和MAC 平板上玫红色疑似大肠杆菌的单一菌落,进行纯化。纯化完成后挑选形态良好的单菌落进行革兰染色, 经普通光学显微镜进行细菌形态学观察和鉴定。
1.2.3 大肠杆菌的生化鉴定
经形态学观察后,无菌吸取5 μL 增菌液,按照说明书操作, 置入生化管内,37 ℃恒温培养12 h,培养完成后观察并记录生化反应结果, 结果参照《常见细菌系统鉴定手册》[7]进行生化鉴定。
1.2.4 细菌基因组DNA 提取和PCR 扩增
经形态学和生化鉴定为疑似大肠杆菌的分离菌,按照细菌基因组DNA 提取试剂盒说明书对分离菌株进行DNA 提取。 参照刘肖利等[8]报道的序列,设计细菌线粒体16S rDNA 通用引物进行PCR扩增, 上游引物序列为27F:5′-AGAGTTTGATCCTGGCTCAG-3′, 下游引物序列为1 492 R:5′-CGGTTACCTTGTTACGACTTC-3′,引物由苏州金唯智生物科技有限公司合成。 PCR 反应体系为25 μL:2×EasyTaq PCR Super Mix(+dye)12.5 μL,上、下游引物各0.5 μL,ddH2O 10.5 μL,DNA 模板1 μL,阴性对照是将DNA 模板替换成ddH2O。PCR 扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,35 个循环;72 ℃延伸10 min。PCR 扩增结束后,吸取5 μL 产物进行1%琼脂糖凝胶电泳,使用凝胶成像仪拍照。 将PCR 阳性产物送至苏州金维智生物科技有限公司进行双向测序, 测序结果进行BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对分析后鉴定分离细菌的种类。
1.2.5 大肠杆菌系统发育群的鉴定
根据Clermont 等[2]报道设计大肠杆菌系统发育群基因引物序列,引物序列和目的片段见表1。PCR 反应体系为25 μL:2×EasyTaq PCR Super Mix(+dye)12.5 μL, 上、 下游引物各0.5 μL,ddH2O 10.5 μL,DNA 模板1 μL。 PCR 反应程序为:95 ℃预变性4 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,30 个循环;72 ℃延伸10 min。
因为人类生活的环境具有相似性,所以在交际过程中存在双方互明的共知环境,也就是相互认知环境。在电影字幕翻译中,如果新信息与译语观众过去的知识或经验是一致的或相关的,那么译语观众就可以理解源语作者的信息意图。心理学家巴特利特(Bartlett)将“对过去的反应和经验的积极组织”定义为图式。[5]因此,在这种情况下,译者可以通过激活译语观众的相关图式,从而使他们把握源语作者的信息意图,获得足够的语境效果。我们来看《英伦对决》电影中相关情况的一些例子。

表1 大肠杆菌系统发育群分型鉴定PCR 引物信息
根据电泳结果鉴定大肠杆菌的系统发育群分型,鉴定标准为:同时在chuA 和yjaA 基因位点或同时在chuA、TspE4.C2 和yjaA 基因位点PCR 扩增成功的分离菌属于B2 群; 仅在chuA 基因位点或同时在chuA 和TspE4.C2 基因位点PCR 扩增成功的分离菌属于D 群;仅在TspE4.C2 基因位点PCR 扩增成功的分离菌属于B1 群; 仅在yjaA 基因位点PCR 扩增成功或在3 个位点均PCR 扩增不出条带的分离菌属于A 群。
1.2.6 大肠杆菌毒力基因和耐药基因的PCR 扩增
分 别 参 考 孟 相 秋[9]和 刘 少 昆[10]的 报 道 设 计 大肠杆菌毒力基因和耐药基因引物, 引物序列和目的片段见表2 和表3。 PCR 反应体系均为25 μL:2×EasyTaq PCR Super Mix (+dye) 12.5 μL,上、下游引物各0.5 μL,ddH2O 10.5 μL,DNA 模板1 μL。PCR 反应程序为:95 ℃预变性5 min;94 ℃变性30 s,退火30 s(退火温度见表2 和表3),72 ℃延伸2 min,35 个循环;72 ℃延伸10 min。

表2 大肠杆菌毒力基因PCR 引物信息

表3 大肠杆菌耐药基因PCR 引物信息
2 结果与分析
2.1 分离菌株的形态学和生化鉴定
经形态学和生化鉴定,从70 份腹泻羔羊粪便样本中初步分离大肠杆菌38 株,分离率为54.3%(38/70)。 分离菌在MAC 培养基中呈红色透明菌落(见图1);挑取单个菌落革兰染色镜检,可见分离菌两端钝圆形,为红色短杆状的阴性菌。分离菌在EMB 培养基中呈金属光泽的菌落(见图2);挑取单个菌落进行革兰染色镜检, 同样可见分离菌为红色短杆状的阴性菌。

图1 分离菌株在MAC 平板上的菌落形态
图2 分离菌株在EMB 平板上的菌落形态
对38 株分离菌进行生化鉴定, 结果显示,分离菌均可发酵鼠李糖、木糖、蕈糖等糖;靛基质、MR 试验均显示阳性;尿素、硫化氢和VP 试验均为阴性,与《常见细菌系统鉴定手册》中大肠杆菌的生化鉴定结果相符合。
2.2 分离菌株的16S rDNA 序列PCR 扩增、测序及比对
对经形态学和生化鉴定初步鉴定为大肠杆菌的38 个分离菌, 采用PCR 法扩增其16S rDNA 序列。结果表明,38 株疑似大肠杆菌均扩增出1 500 bp左右的目的条带(见图3)。 38 份PCR 产物均成功测序,发现本试验所获分离菌的16S rDNA 序列与美国加利福尼亚州牛粪便来源大肠杆菌(GenBank登录号:CP050498) 的16S rDNA 序列同源性为99.3%~100%。 基于分离菌株形态学、生化鉴定和16S rDNA 序列鉴定结果, 可以确定分离的38 株菌均为大肠杆菌。

图3 分离菌株基于细菌16S rDNA 基因的PCR 扩增结果
2.3 大肠杆菌系统发育群分型鉴定
3 个基因位点的目的片段PCR 扩增结果见图4。 38 株大肠杆菌分离菌中, 仅在yjaA 基因位点PCR 扩增成功的分离菌共计10 株,鉴定为A 群,所占比例为26.3%(10/38);仅在TspE4.C2 基因位点PCR 扩增成功的分离菌共计26 株, 鉴定为B1群, 所占比例为68.4%(26/38); 同时在chuA 和TspE4.C2 基因位点PCR 扩增成功的2 个分离菌,鉴定为D 群,所占比例为5.3%(2/38);未检测到B2 群大肠杆菌。
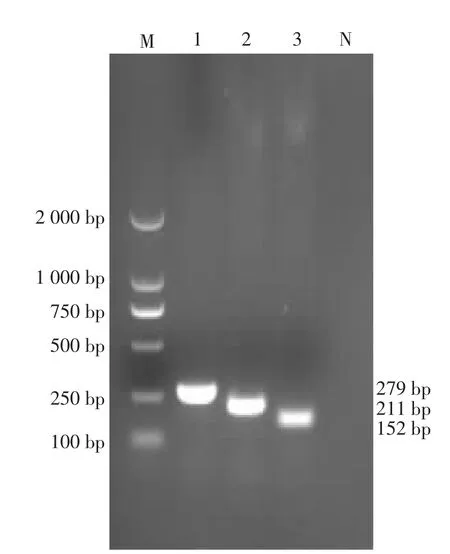
图4 系统发育群分型3 个基因位点PCR 扩增结果
2.4 大肠杆菌毒力基因的检测
采用PCR 法检测38 株大肠杆菌分离菌的8种毒力基因,结果检测到4 种毒力基因(见表4),其中以携带fimC 基因的菌株最多, 所占比例为92.1%(35/38),其余依次为irp2 基因[所占比例为47.4%(18/38)]、hlyF 基因 [所占比例为36.8%(14/38)]、 fyuA[所占比例为34.2%(13/38)];分离菌中未检测到大肠杆菌eaeA 基因、LT 基因、LT基因和Stx1 基因。
2.5 大肠杆菌耐药基因的检测
采用PCR 法检测38 株E.coli 分离菌的8 种耐药基因,结果检测到6 种耐药基因(见表5),其中以携带磺胺类耐药基因的菌株数最多,sul2 基因占42.1%(16/38);携带氯霉素类cmlA 基因和四环素类tet(B)基因的菌株数较少,所占比例分别为5.3%(2/38)和13.2%(5/38);分离菌均未检测到氨基糖苷类耐药基因。

表5 分离菌株不同大肠杆菌耐药基因检测结果
3 讨论
大肠杆菌是引起羔羊腹泻和死亡的主要病原之一, 在养殖生产中一定程度上制约着养羊业的健康发展。 江婉琳等[11]从新疆克拉玛依地区分离奶牛源大肠杆菌的系统发育群分型显示B1 群占70.9%,未检出B2 群。 顾晓晓[12]调查发现,新疆部分地区分离牛、 羊肠外致病性大肠杆菌系统发育群分型显示多属于A 和B1 群。 本试验分离得到的大肠杆菌的系统发育群分型结果显示,38 株大肠杆菌分离株具有多样性,B1 群占68.4%,同样未检出B2 群,提示新疆地区牛、羊源大肠杆菌以B1群为优势群。
大肠杆菌的致病性与携带的毒力基因密切相关。 刘英玉等[13]对库尔勒地区2 个育肥场、1 个繁殖场中分离到的185 份羊源大肠杆菌进行毒力基因检测,发现携带的毒力基因主要为Stx1 基因,为24.3%(45/185),未检测出eaeA 基因。 佟盼盼等[14]对新疆部分地区养殖场、 屠宰场和市场中收集的202 份羊源大肠杆菌进行毒力基因检测, 发现携带的毒力基因主要为Stx1 和hly, 所占比例为68.0%(17/25),未检测出eaeA 基因。 赵学亮等[15]对陕西部分地区分离得到的50 株腹泻羊源致病性大肠杆菌进行毒力基因检测发现,eaeA 基因所占比例为32.0%(16/50),未检出Stx1 基因。 王显峰等[16]对内蒙古扎兰屯地区45 株羊源大肠杆菌毒力基因检测发现,irp2、fyuA 基因检出率均为100%(45/45)、eaeA 基因为33.3%(15/45)、Stx1 为4.4%(2/45)。 本试验对38 株腹泻羊源致病性大肠杆菌毒力基因的检测结果显示,irp2 基因为47.4%(18/38)、hlyF 为36.8%(14/38), 未检测出Stx1 基因和eaeA 基因。上述研究结果表明致病性大肠杆菌菌株间携带的毒力基因不同可能与宿主来源和地区分布差异有关。
大肠杆菌耐药性的增强主要与菌株间的接合、转化及各耐药基因间的水平传播等有关,致使菌株呈现多重耐药性[17]。 陈家露等[18]检测西藏那曲市26 株羊源致病性大肠杆菌的耐药基因,发现β-内酰胺类耐药基因检出率为100%(26/26)。 刘正明等[19]检测内蒙古地区108 株羊源大肠杆菌的耐药基因发现,β-内酰胺类耐药基因检出率为99.1%(107/108),氨基糖苷类、磺胺类和喹诺酮类耐药基因检出率均在50.0%以上。 顾晓晓等[20]检测新疆石河子地区100 株羊源大肠杆菌氨基糖苷类耐药基因,发现aph 和aadA 基因的检出率分别为89%(89/100) 和98%(98/100)。 本试验检测和田地区38 株羊源大肠杆菌耐药基因,发现磺胺类耐药基因sul2 检出率为42.1%(16/38),β-内酰胺类耐药基因检出率为18.4%(7/38),未检出氨基糖苷类耐药基因,这与上述报道存在一定的差异,提示不同地区的羊源大肠杆菌耐药基因可能因羊的饲喂情况、用药情况、菌株地理分布等因素而存在差异。因此,在临床治疗羔羊腹泻时,应合理用药,避免更多耐药性的产生。
4 结论
该研究发现, 和田地区规模化养殖场腹泻羔羊大肠杆菌感染率较高, 系统发育群主要为B1群,可携带多种毒力基因和耐药基因,对绵羊的健康养殖存在一定危害。
