内蒙古呼伦贝尔地区本土牛牛肉黄脂现象的相关基因和代谢组学研究
2024-01-12苏少锋赵鸿雁左兰明梁智杰王金环田如刚
王 潇,李 慧,苏少锋,赵 濛,田 菁,赵鸿雁,左兰明,梁智杰,王金环,田如刚
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;2.鄂托克旗农牧技术推广中心,内蒙古 鄂托克旗 016199;3.赤峰市敖汉旗农牧局,内蒙古 敖汉旗 024300;4.赤峰市农牧技术推广中心,内蒙古 赤峰 024031;5.赤峰市农牧局,内蒙古 赤峰 024050)
内蒙古呼伦贝尔草原地处我国北疆, 地域辽阔,是世界著名的天然牧场,也是世界四大草原之一。在草场上自然放牧的本土牛,为当地特有的蒙古牛品种, 牛肉具有皮下脂肪呈浅黄色至深黄色的特点,成为当地牧民餐桌上的美食,用其烹饪的“南屯牛排”,更是宴请宾客的佳肴[1]。 呼伦贝尔地区本土牛牛肉黄色脂肪现象的主要原因是放牧饲养时牛进食大量牧草, 牧草中含有丰富的类胡萝卜素,特别是β-胡萝卜素,这些有色物质在体内沉积,从而导致皮下脂肪着色[2-4]。 此外,肉牛体内类胡萝卜素的沉积还受品种、屠宰季节、年龄等因素的影响[5-8]。
β-胡萝卜素进入机体后, 以不同密度的脂蛋白作为载体,转运到各组织器官中。 在肉牛体内,这类载体为高密度脂蛋白(HDL)。 由于具有相似的结构,β-胡萝卜素家族与胆固醇可以共享这类载体,二者之间存在竞争关系,因此,β-胡萝卜素代谢与体内脂代谢和与脂代谢相关的代谢过程之间存在密切联系[9]。 在基因调控方面,已有研究证实肉牛体内β-胡萝卜素的胞内降解主要由BCO2和BCMO1 酶控制[10-12],调控基因BCO2 的多态性对β-胡萝卜素代谢的影响最为显著[13], 此外,RDHE2 和PPAR 等基因也参与β-胡萝卜素的代谢调控[14-15]。 这些调控基因的异常表达可导致β-胡萝卜素代谢异常,进而导致大量β-胡萝卜素沉积在肝脏和皮下脂肪等组织中[16-17]。
在机体内,β-胡萝卜素除了可使脂肪组织黄染进而影响肉品质,还与抗氧化能力、免疫力和繁育性能有关[18]。另外,β-胡萝卜素在大部分动物体内不能由自身合成,需要通过食物获取[19],因此,对β-胡萝卜素代谢调控机制的研究具有重要的科学意义。 目前,对肉牛体内β-胡萝卜素代谢相关调控基因的研究主要围绕安格斯牛、 利木赞牛等国外引进品种, 对我国本土肉牛品种的研究较少。 本文从β-胡萝卜素的代谢调控机制入手,以内蒙古呼伦贝尔地区天然放牧的本土蒙古牛为研究对象,利用基因检测方法,探究具有不同脂肪颜色的呼伦贝尔本土牛样本中β-胡萝卜素调控基因的SNP 差异,并结合非靶向代谢组学技术,进一步探明黄色脂肪和白色脂肪在代谢物上的差异,从而为定向调控肉牛脂肪颜色提供科学依据。
1 材料与方法
1.1 试验材料
从内蒙古呼伦贝尔市某屠宰场随机选取72头本土牛(蒙古牛),每头牛均采集皮下脂肪组织和肝脏组织样本各0.5 g, 置于冻存管中后立即放入液氮速冻。每头牛另取皮下脂肪组织5 g 放入冰盒内,用于脂肪颜色评分判定。
1.2 试验方法
1.2.1 脂肪颜色评分
参照欧洲部分国家采用的5 分制主观评定方法完成脂肪颜色评分[5]。 由3 人组成脂肪颜色评分组,按照5 分制标准对皮下脂肪颜色进行评估,1 分为非常白,5 分为非常黄。 评定过程由3 人独立完成, 以3 人评定结果的中位数为某份样本的脂肪颜色评分, 据此完成72 份样本的脂肪颜色评分。
1.2.2 肝脏组织基因组DNA 提取
取出液氮冷冻保存的72 份肝脏组织,每份组织样本用电子天平称取30~50 mg, 使用动物组织基因组DNA 提取试剂盒[天根生化科技(北京)有限公司]提取基因组DNA,用1%琼脂糖凝胶电泳检测DNA 质量。
1.2.3 基于PARMS 技术的SNP 差异检测
利用武汉市景肽生物科技有限公司研发的五引物扩增受阻突变体系(penta-primer amplification refractory mutation system,PARMS),完成肝脏组织样本中β-胡萝卜素调控基因的单核苷酸多态性(SNP)差异检测。 以提取的肝脏组织基因组DNA为模板,利用等位基因特异荧光扩增引物,进行等位基因特异性的PCR 检测; 利用PARMS 的酶标仪进行荧光扫描; 对72 份肝脏组织样本的BCO2 SNPW80X、BCMO1 SNP4、RDHE2 SNP2、ALDH8A1 SNP16 和PPARCG1A SNP12 基因进行SNP 基因型检测。 5 个基因的SNP 特异性位点和扩增引物序列分别见表1 和表2。

表1 5 个基因的SNP 位点碱基变化情况

表2 5 个扩增基因的引物序列
1.2.4 BCO2 基因多态性的PCR 及测序验证
由于BCO2 基因的多态性对β-胡萝卜素代谢影响最为显著, 故利用PCR 扩增及直接测序法,对基于PARMS 技术的BCO2 基因分型结果进行验证。 选取不同脂肪颜色评分对应个体的肝脏组织共12 份,按照“1.2.2”项下方法进行肝脏组织基因组DNA 提取。 根据NCBI 的GenBank 数据库公布的BCO2 基因序列设计引物, 引物信息见表3。 以提取的肝脏组织基因组DNA 为模板, 采用PCR 法扩增BCO2 基因,反应体系见表4。 反应条件为:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min, 循环次数30 次;72 ℃最后延伸10 min。

表3 BCO2 基因PCR 扩增引物信息

表4 BCO2 基因PCR 扩增反应体系
将扩增得到的目的片段, 送至生工生物工程(上海)股份有限公司测序。 对测序结果中的序列和峰图用DNAStar 和Chromas 软件进行分析。
1.2.5 数据统计与相关性分析
利用SPSS 20.0 统计学软件分析基因频率及基因型频率,并与脂肪颜色评分进行相关性分析。
1.2.6 脂肪样本的非靶向代谢组学分析
根据脂肪颜色评分结果,分别选取白色(1~2分)、黄色(3~5 分)脂肪样本各6 个,每份样本称取50 mg,利用有机试剂沉淀蛋白法进行代谢物提取, 提取后分别在正负离子模式下进行液相色谱串联质谱联用仪(liquid chromatograph-mass spectrometer,LC-MS) 扫描检测。 利用主成分分析法(principal components analysis,PCA)对代谢物进行质控分析; 应用偏最小二乘回归分析法(partial least squares discriminant analysis,PLS-DA)进一步分析白色脂肪组与黄色脂肪组之间的差异趋势;采用单变量分析差异倍数法(fold-change)和t 检验方法, 结合人类代谢组数据库(Human Metabolome Database,HMDB) 和差异表达基因代谢途径分析 (Kyoto Encyclopedia of Genes and Genomes,KEGG) 对差异代谢物进行功能注释,并进行代谢通路富集。利用R 语言包ggplot2 绘制差异代谢物箱式图。
2 结果与分析
2.1 脂肪样本颜色评分与基因型关联分析
2.1.1 脂肪样本颜色评分情况
72 份皮下脂肪组织样本颜色评分分布情况如图1 所示。由图1 可知,呼伦贝尔地区本土牛皮下脂肪颜色以白色为主,评分在1~2 分的样本(n=50)占到69.45%;黄色脂肪样本(评分3 分及以上,n=22)占比30.55%。
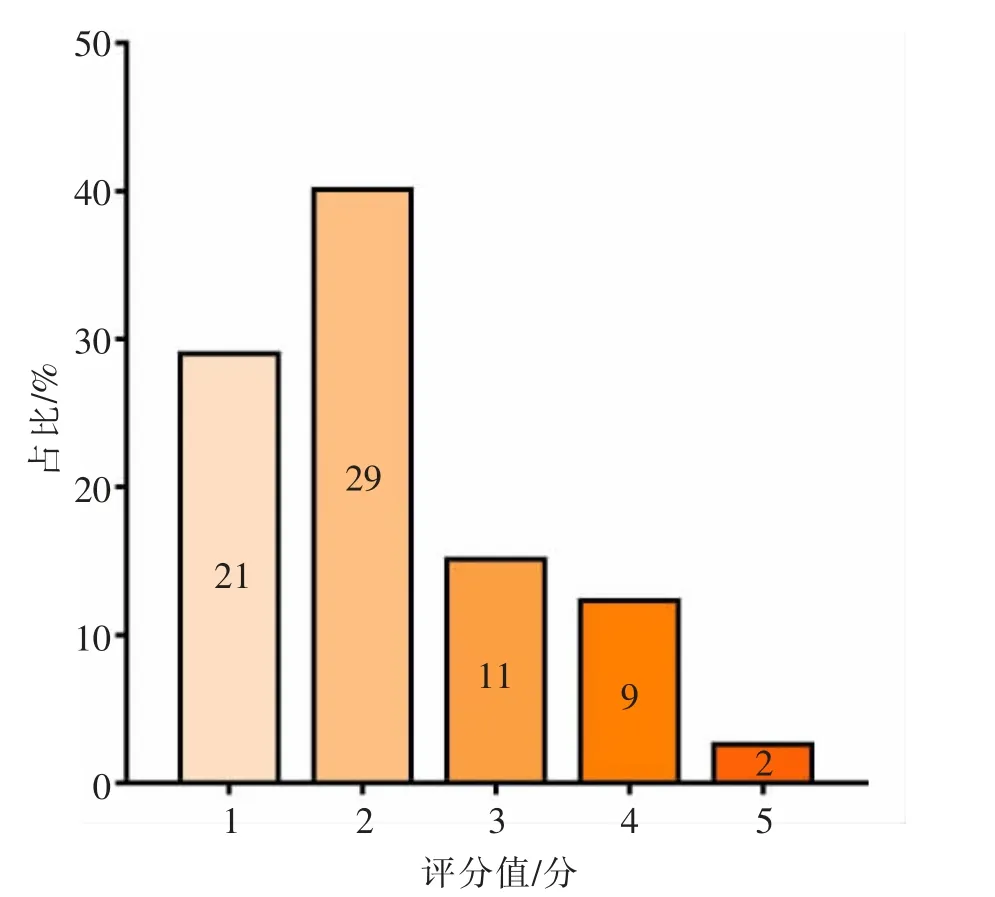
图1 不同脂肪样本颜色评分分布图
2.1.2 脂肪颜色与基因型关联分析
本研究选取目前已在其他品种肉牛中报道的β-胡萝卜素代谢过程相关通路中5 个关键基因的SNP 位点为研究对象, 开展脂肪颜色与基因型关联分析(见表5)。 从关联分析表(见表6)可以看出,5 个基因对脂肪颜色均无显著(P>0.05)影响,ALDH8A1 SNP2 多态性单一,均为AA 型,因此,未进一步进行关联分析。
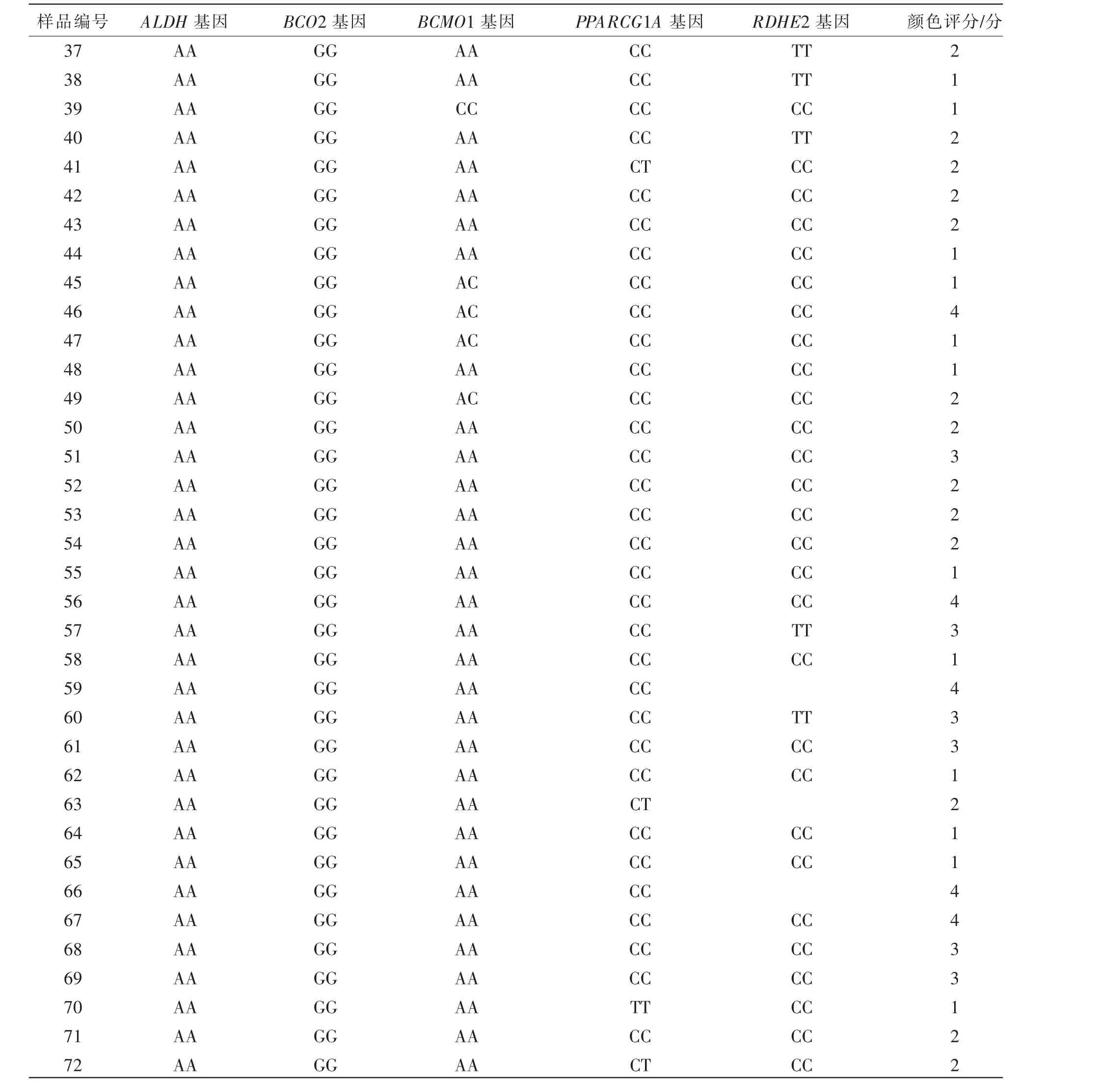
表5(续) 脂肪样本颜色评分与基因型对照表
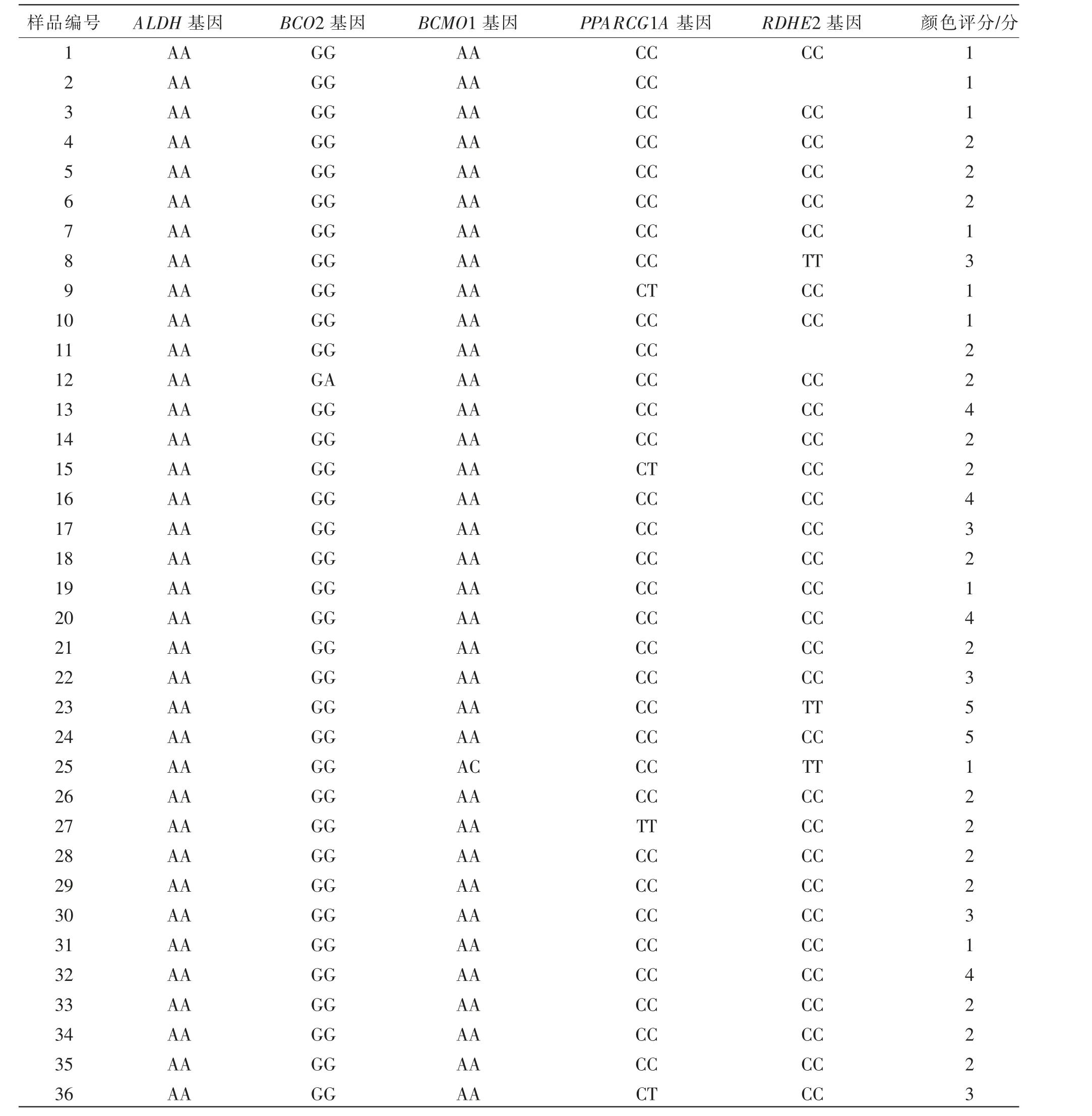
表5 脂肪样本颜色评分与基因型对照表
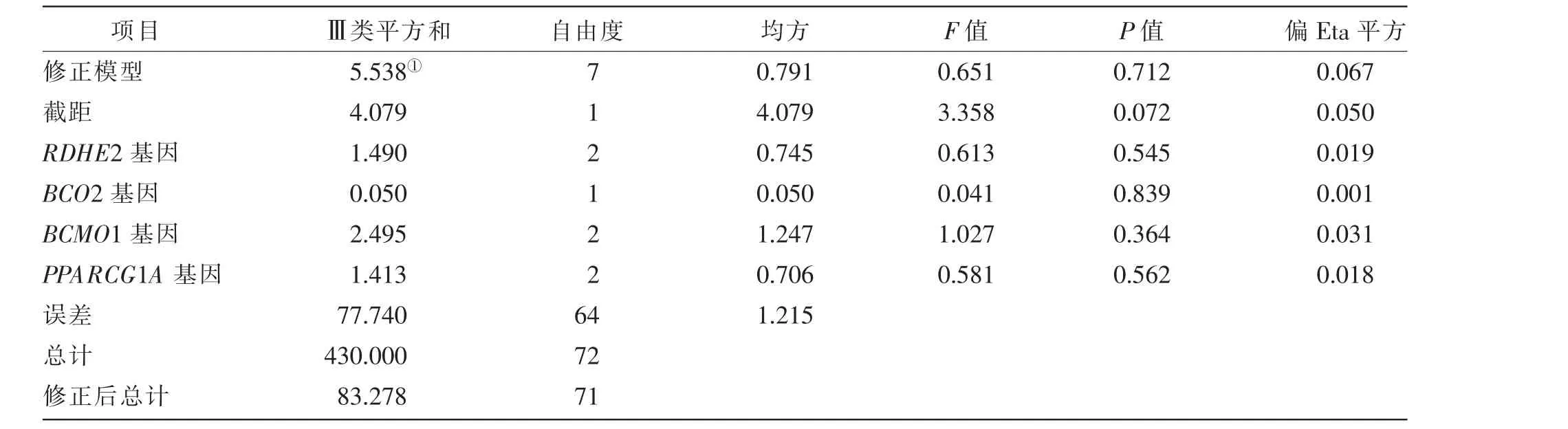
表6 脂肪颜色与基因型关联分析表
2.2 基因多态性分析
2.2.1 基因型频率分析
在检测的5 个基因中,ALDH8A1 SNP2 位点只有AA 基因型;BCO2 SNPW80X 位点包括GG和AG 2 种基因型;BCMO1 SNP4 位点包括AA、AC 和CC 3 种基因型;PPARCG1A SNP12 位点包括CC、CT 和TT 3 种基因型;RDHE2 SNP2 位点包括CC 和TT 2 种基因型(见表7)。
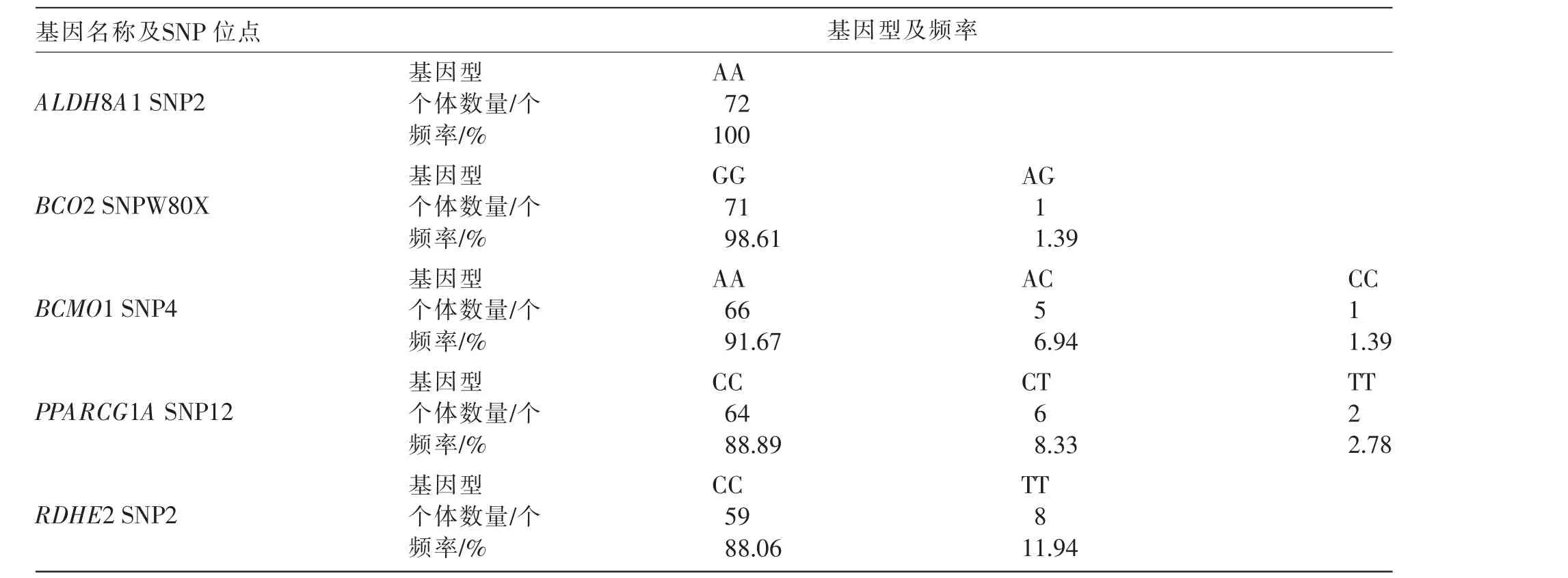
表7 5 个基因SNP 位点不同基因型频率
2.2.2 基因频率分析
各基因频率统计结果见表8。 由表8 可知,ALDH8A1 SNP2 位点上,A 等位基因为优势基因,未检测到其他基因的存在;BCO2 SNPW80X 位点上,G 等位基因为优势基因;BCMO1 SNP4 位点上,A 等位基因为优势基因;PPARCG1A SNP12 位点上,C 等位基因为优势基因;RDHE2 SNP2 位点上,C 等位基因为优势基因。

表8 5 个基因SNP 位点不同基因频率
2.2.3 BCO2 基因多态性的验证
经过PCR 扩增和1%琼脂糖凝胶电泳检测,可得到特异性目的片段。为进一步验证PARMS 技术基因分型结果, 采用直接测序法对BCO2 SNPW80X 位点进行了验证。直接测序验证结果与基于PARMS 技术的SNP 基因分型结果完全一致(见图2)。

图2 BCO2 基因直接测序峰图
2.3 非靶向代谢组学检测
2.3.1 建模可靠性分析
取等量制备好的白色脂肪和黄色脂肪组织样本,混合制成质控样本并进行PCA 分析,结果表明,质控样本有很好的聚集性,说明检测结果可信(见图3)。

图3 黄色脂肪和白色脂肪组织样本主成分分析图
从PLS-DA 分析图(见图4A)中可以看出,2组样品之间均有比较明显的分离趋势, 与白色脂肪组相比,黄色脂肪组内的聚集度更高。 从PLSDA 置换检验图中可见Q2<0(见图4B),说明模型不存在过拟合的情况,差异代谢物分析准确,建模可靠。

图4 黄色脂肪组与白色脂肪组比较的PLS-DA 分析图
2.3.2 差异代谢物分析
对黄色脂肪组和白色脂肪组样本(各6 个)的5 780 个正电荷代谢物和6 582 个负电荷代谢物进行组间差异分析, 结果表明, 与白色脂肪组相比,黄色脂肪组总共有235 个代谢物出现差异,其中,表达量上调的代谢物有163 个,表达量下调的代谢物有72 个(见图5)。

图5 黄色脂肪组与白色脂肪组比对后的差异代谢物数量
将不同物质在质谱仪中进行碎裂, 利用碎片信息生成二级谱图, 与公共数据库的标准品二级谱图进行匹配,并对匹配结果评分,最终得到代谢物的二级鉴定结果。 黄色脂肪组与白色脂肪组相比,得到5 个显著(P<0.05)差异的代谢物,其中,有1 个代谢物下调,4 个代谢物上调(见图6)。 对这些代谢物进行注释、分类和富集,可富集到4 个大类的7 个通路中(见表9)。
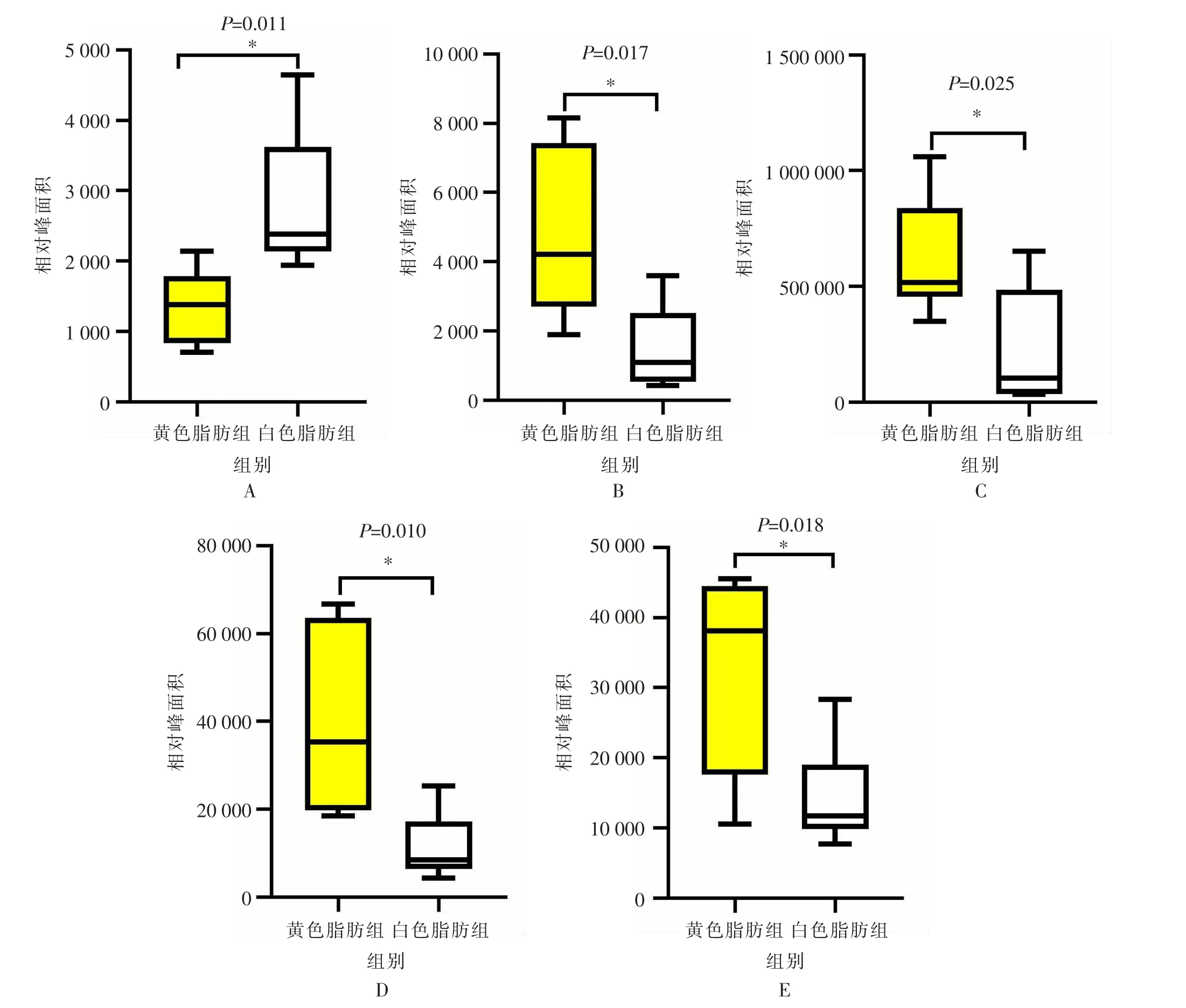
图6 黄色脂肪组与白色脂肪组之间二级差异代谢物箱式图

表9 黄色脂肪组与白色脂肪组比较差异代谢物富集情况
3 讨论
肉牛皮下脂肪着色主要是由于体内类胡萝卜素沉积所致,其中,β-胡萝卜素为沉积最主要的一类, 体内有多种酶参与β-胡萝卜素的代谢调控。BCMO1 和BCO2 基因编码的酶可通过对称裂解和非对称裂解,将β-胡萝卜素转化为全反式视黄醛和视黄酸,视黄醛和视黄酸可以转化为VA。 而RDHE2 基因编码的酶能够调节视黄醇和视黄醛的转化, 从而调节体内β-胡萝卜素的代谢[14]。PPAR 家族基因具有脂肪特异性,在脂肪代谢调节中起到重要作用, 可作为BCMO1 基因的转录因子,从而调控靶基因BCMO1 的功能活性[11,15]。
由β-胡萝卜素沉积导致黄染的皮下脂肪组织与未发生黄染的白色脂肪组织相比, 有多种代谢物发生变化, 表明代谢物的差异也可对脂肪颜色造成影响。
3.1 调控基因SNP 差异与肉牛黄脂的关系
已有研究证明,BCMO1 和BCO2 等基因的SNP 差异,可能会导致牛体内β-胡萝卜素的代谢差异。 Bertolini 等[20]通过对印度娟姗牛、荷斯坦牛和水牛的研究确定,发生在BCO2、BCMO1 基因部分SNP 位点的基因型差异可导致β-胡萝卜素代谢异常,进而影响所产牛奶的颜色。徐磊等[21]以西门塔尔牛为研究对象,发现BCO2 基因BV1 位点与脂肪颜色呈显著关联性。 此外,在人体内,BCMO1基因R267S 和A379V 位点的SNP 差异也会导致类胡萝卜素的代谢出现异常[22]。 PPARγ 的基因型差异对鲁西黄牛、秦川牛的脂肪生长均有影响[23]。脂肪的快速沉积会稀释体内的β-胡萝卜素,从而影响脂肪颜色。在本研究中,β-胡萝卜素代谢途径中选定的基因特异位点与脂肪颜色无明显相关性,表明肉牛体内β-胡萝卜素的代谢调节基因受到品种差异、基因分布、人为选择和基因漂移等多种遗传学因素的综合影响, 单独进行相关调控基因SNP 差异研究和基因型频率检测, 并不能够完全揭示黄脂现象的机制。
3.2 代谢物与肉牛黄脂的关系
3.2.1 cAMP 信号途径差异与肉牛黄脂的关系
机体内cAMP 信号途径可由G 蛋白偶联受体(G protein-coupled receptor,GPCR)介导。 已有研究发现β-胡萝卜素能够通过调控cAMP、PMKA等G 蛋白调控的信号途径显著抑制细胞外信号调节激酶(ERK1/2)的增殖和磷酸化[24]。在本研究中,黄色脂肪组与白色脂肪组相比,cAMP 信号途径中的3-羟基辛酸乙酯发生显著下调; 在通路上,该代谢物与PPARγ 基因的表达相关,PPARγ 家族基因不仅可以刺激脂肪酸的β 氧化从而导致脂肪酸的降解,在脂肪细胞分化中起到重要作用,而且其编码的PPARγ 蛋白还可以特异性地结合到BCMO1 基因的启动子区域, 正向调节BCMO1 基因的转录,进而影响机体内β-胡萝卜素代谢[11]。
3.2.2 不饱和脂肪酸生物合成途径与肉牛黄脂的关系
本研究中的代谢组学分析结果表明, 黄色脂肪组与白色脂肪组相比, 不饱和脂肪酸的表达量显著上升,此 结果与 木其尔[1]和Knight 等[25]的研究结果一致。 不饱和脂肪酸能够促进乳糜微粒的形成,从而促进β-胡萝卜素的转运[26]。此外,β-胡萝卜素的抗氧化作用也能保护机体内的不饱和脂肪酸被氧化,故笔者推测机体内β-胡萝卜素与脂代谢中不饱和脂肪酸的调控之间存在密切联系。研究表明,在肉鸡日粮中添加β-胡萝卜素和VK,可提高ω-3 多不饱和脂肪酸的稳定性, 如二十碳五烯酸[27]。在本研究中,黄色脂肪组与白色脂肪组相比,二十碳五烯酸表达量显著升高,这一结果与文献报道的结果一致。 BCMO1 基因表达量不仅与β-胡萝卜素代谢有关, 还与机体内甘油三酯的代谢密切相关[28-29],其表达量的下降在导致β-胡萝卜素沉积进而形成黄脂的同时, 也会造成甘油三酯的堆积,故BCMO1 基因与脂肪形成存在密切关系,相关机制需要进一步探明。
3.2.3 初级胆汁酸合成和胆汁分泌途径与肉牛黄脂的关系
胆汁分泌和胆汁酸合成在脂肪代谢和β-胡萝卜素吸收过程中起到重要作用[30]。在机体内,胆汁可使脂肪和β-胡萝卜素在十二指肠中一起乳化形成乳糜微粒, 这些乳糜微粒由不同类型的脂蛋白运输。 在牛体内,高达80%的β-胡萝卜素由HDL 运输, 且由于与胆固醇具有相似的类异戊二烯结构,二者可以通过同类受体完成转运[9]。 脂肪酸还参与胆固醇的调节, 而胆固醇在机体内转运时, 可能存在与β-胡萝卜素竞争HDL 载体的机制[31]。 在机体内,VA 和胆汁酸之间存在稳态,VA可促进胆汁酸的合成[32],BCMO1 和PPAR 基因可分别通过调节VA 和胆汁酸的合成维持稳态的平衡[33]。在本研究中,黄色脂肪组与白色脂肪组相比,位于初级胆汁酸生物合成和胆汁分泌途径上的代谢物甘氨胆酸均出现显著高表达, 高浓度的甘氨胆酸可正向调节胆汁酸受体 (FXR) 的表达,而FXR 可抑制维甲酸受体 (RXR) 的表达[34],与PPARγ 类似,RXR 也可特异性地结合到BCMO1 基因的启动子区域,正向调节BCMO1 基因的转录[11]。
3.2.4 甘油磷脂和胆碱代谢差异与黄脂的关系
在机体内,细胞膜的主要成分为磷脂,不饱和脂肪酸可作为骨架, 对细胞膜的双层结构起到支撑作用。 β-胡萝卜素的抗氧化特性在使不饱和脂肪酸受到保护的同时, 还可以参与磷脂双层膜的保护[35],对膜的流动性和稳定性起到维护作用[36]。在本研究中,黄色脂肪组与白色脂肪组相比,在甘油磷脂和胆碱代谢途径出现差异, 差异物磷脂酰胆碱为磷酸甘油酯的一种。已有研究证实,增加磷酸甘油酯的供给,可使细胞膜形态改变,机体内的β-胡萝卜素更容易被转运至细胞内, 进而导致细胞内β-胡萝卜素含量增加[37]。
4 结论
呼伦贝尔地区本土牛牛肉黄色脂肪组织样本与白色脂肪组织样本相比, 有多个代谢物存在差异,涉及的信号通路与脂肪形成、体内β-胡萝卜素转运和β-胡萝卜素跨膜运输之间存在密切关系,且与BCO2、BCMO1、PPARCG1A 等β-胡萝卜素代谢相关基因直接或间接相关。 后续可对相关分子调控机制开展进一步研究,可为含β-胡萝卜素饲料的制备和定向调节肉牛脂肪颜色提供理论基础。
