溃疡性结肠炎的肠道免疫研究进展❋
2024-01-11宋志前鲁欣悦彭诗涛宁张弛
李 洋,宋志前,鲁欣悦,王 淳,彭诗涛,张 婷,宁张弛△
(1.首都医科大学附属北京中医医院,北京 100010;2.中国中医科学院中医基础理论研究所,北京 100700;3.中国中医科学院广安门医院,北京 100053)
肠道是参与机体免疫的重要器官,可通过识别暴露在复杂生理环境中的抗原信息并做出适当响应来维持肠道稳态。肠道稳态的破坏会引起UC等IBD的发生[2]。近年来,随着免疫代谢研究领域的崛起,免疫细胞代谢重编程可以影响免疫细胞的增殖、分化以及免疫功能的发挥,但对于免疫细胞代谢调控机制的认识仍待进一步深入。虽然西药治疗可在短时间内缓解症状,但长时间服用存在不良反应及耐药性,对治疗效果造成一定影响[3]。中药具有用药灵活、个体化治疗等特点,在改善UC、预防复发方面有一定的优势[4]。
本文从肠相关淋巴组织以及固有层内多种免疫因素的角度,总结肠道免疫与UC发生发展的相关性。围绕与UC发生发展关系最为密切的免疫因素——辅助性T细胞(T helper cell, Th)17/调节性T细胞(T regulatory cells, Treg),深入细胞代谢重编程过程中的代谢表型变化,挖掘关键分子与信号通路和蛋白调控过程,归纳综述UC发生发展的各个环节。最后,从中药复方、中药配伍和炮制中药、中药有效部位和单体成分以及中西药的联合应用角度,探究肠道免疫调节治疗UC的现状,以期为UC的相关研究提供参考。
1 UC与肠道免疫
肠道免疫与肠相关淋巴组织以及固有层内多种免疫因素相关,肠道免疫细胞可分泌多种细胞炎症因子来参与免疫功能的调节。肠道免疫细胞及因子构成了复杂而精密的免疫调控网络,协同抵御病原的入侵,对于维持肠道免疫稳态具有重要意义[5-7]。
1.1 肠相关淋巴组织与UC发生发展
肠相关淋巴组织(gut associated lymphoid tissue,GALT)是位于肠黏膜下的淋巴组织,由派伊尔结(Peyer's patch,PP)和肠系膜淋巴结(mesenteric lymphoid node,MLN)以及其他肠淋巴组织和免疫细胞组成,是机体抵抗病原体侵袭的关键因素,见图1。PP是肠黏膜免疫细胞识别抗原和活化的主要部位。肠道免疫系统按解剖和功能可分为诱导部位和效应部位[8],诱导部位主要包括肠上皮细胞、PP以及MLN;效应部位主要包括上皮内和固有层的淋巴细胞。

图1 肠相关淋巴组织及免疫因素示意图
PP位于肠黏膜下,含有微皱褶细胞(micro fold cell,M细胞)、树突状细胞(dendritic cell,DC)、巨噬细胞、T细胞和B细胞,是启动肠黏膜免疫应答的重要部位。M细胞与肠上皮细胞紧密排列在一起,是一种特化的上皮细胞,其基部胞膜呈穹隆状突起形成“口袋”样结构,包含T细胞等其他细胞[9],具有摄取和转运肠腔内抗原的功能。M细胞摄取抗原后将其传递至DC等抗原呈递细胞,从而进一步诱导肠黏膜免疫应答[10]。PP中T细胞和B细胞在抗原提呈细胞的作用下活化,可进入黏膜组织释放炎性因子从而介导炎性损伤。MLN通过输入淋巴管与PP相连,含有DC、巨噬细胞、T细胞和B细胞等,是启动肠道抗原免疫应答和诱导黏膜耐受的重要场所。
UC通过影响PP与MLN中免疫细胞及相关细胞因子的分泌,驱动初始T细胞向Th1、Th2、Th17、Treg细胞极化,调控Th反应类型及免疫应答从而调节UC肠道免疫稳态[11]。有学者对MLN中Th1、Th17细胞在UC小鼠发病中的作用进行了研究,结果表明,MLN中Th1、Th17细胞可能通过释放白细胞介素(interleukin,IL)-17A和干扰素(interferon,IFN)-γ等细胞因子诱导巨噬细胞浸润、活化,从而介导UC小鼠的肠黏膜炎症反应和病理损伤[12]。另有研究表明,小鼠MLN中CD169+巨噬细胞亚群对于UC的进展起着关键的调控作用,其可能通过直接分泌细胞因子来参与炎症反应的调控[13]。
1.2 肠道固有层与UC发生发展
除了GALT外,肠道固有层中还存在着弥散的DC、巨噬细胞和T细胞等免疫细胞。在抗原提呈细胞的作用下,初始T细胞分化为Th1、Th2、Th17和Treg炎性T淋巴细胞,参与肠道炎症的发生发展。肠道固有层T细胞主要包括CD4+T细胞(Th1、Th2、Th17、Treg)以及CD8+T细胞,可产生IL-4、IL-10、IL-17、IL-21等细胞因子从而调节免疫应答。Th17和Treg细胞在生长分化过程中存在竞争机制,且与炎性细胞因子关系密切。如转化生长因子(transforming growth factor,TGF)-β既参与了Th17细胞的生长,又能够诱导Treg细胞的分化;IL-1、IL-21、IL-23对Th17细胞具有促进作用,而对于Treg细胞则具有抑制作用;IL-2、IL-12是Treg细胞的生长兴奋剂,但可抑制Th17细胞的发育成熟[14]。Th17和Treg细胞可通过不同的转录途径释放炎性细胞因子而调节肠道免疫。转录因子叉头框蛋白(forkhead bos protein,Foxp)3对Treg细胞的发育和功能至关重要[15],而表达视黄酸相关孤儿受体(retinoid-related orphan nuclear receptor,ROR)γt的Th17细胞可通过释放IL-17促使炎性疾病的发生[14]。此外,肠道中还存在浆细胞、嗜酸性粒细胞等其他细胞参与免疫调节。除发挥免疫功能外,GALT还能分泌IFN-γ、IL-2和IL-4等多种细胞因子,通过激活Janus(JAKs)激酶、信号传导与转录激活蛋白(signal transducer and activator of transcription, STAT)等转录蛋白来调节肠上皮细胞的再生和修复[16]。巨噬细胞对免疫应答具有双向调节作用,M1型巨噬细胞为经典活化巨噬细胞,倾向于引起慢性炎症和组织损伤;M2型巨噬细胞为替代活化巨噬细胞,倾向于消除炎症反应和促进伤口愈合。两种活化形式的巨噬细胞共同发挥作用,维持体内的免疫平衡,任何一方免疫调节异常都会破坏免疫稳态,引发相关疾病[17]。有研究表明,刺激大麻素受体(cannabinoid receptor, CB)2可以使结肠中巨噬细胞的极性从M1型向M2型转化,同时M1标志物水平下降,M2标志物水平升高,从而改善肠道炎症程度[18]。
2 Th17/Treg细胞免疫细胞代谢重编程与UC发生发展
在UC研究中,Th17细胞和Treg细胞是近年来受关注较多的两种T细胞亚群。Th17细胞是肠黏膜表面促炎反应的关键启动子,并通过向受感染的组织招募中性粒细胞和巨噬细胞而在宿主防御和抗感染中发挥重要作用[19]。Treg细胞不发挥效应功能,而是以效应细胞为作用对象,调节免疫应答和自身免疫耐受。
抢险救援组组长由县公安局局长担任;副组长由县交通局、卫生局、公路局、城市管理行政执法局、各乡镇等单位主要领导担任;县公安局、消防大队、国土局、住建局、卫生局、供电公司、水电公司、电信公司、移动公司、联通公司等单位明确领导干部担任副组长。
生命活动离不开代谢,代谢是维持机体生长、繁殖及其他生命活动的重要环节。正常状态下,细胞能量代谢协调、稳定进行。当机体处于炎症、肿瘤等状态时,细胞发生代谢重编程。细胞通过消耗葡萄糖、脂质等产生能量供给机体所需。葡萄糖无氧糖酵解、三羧酸(tricarboxylic acid,TCA)循环以及脂肪酸氧化(fatty acid oxidation,FAO)是细胞进行能量代谢的主要通路,形成了错综复杂的能量代谢网络结构。研究表明,Th17/Treg细胞与UC的发生发展密切相关,而二者之间的诱导分化受到代谢重编程的调控。
2.1 Th17/Treg细胞代谢重编程
T细胞在肠道免疫中发挥着重要作用,代谢重编程是免疫细胞活化的重要特征,见图2。初始T细胞主要通过TCA循环和氧化磷酸化(oxidative phosphorylation,OXPHOS)来分解葡萄糖和脂肪酸等生成三磷酸腺苷(Adenosine Triphosphate,ATP)。激活后,初始T细胞进行扩增和分化。为了满足生物合成和能量的需求,T细胞发生代谢重编程。Warburg最先发现了在氧气充足的条件下,癌细胞代谢依赖于有氧糖酵解的现象,又称“Warburg效应”[20]。有氧糖酵解与OXPHOS相比可加速ATP的生成,但产生ATP的效率较低。活化的T细胞通过OXPHOS和有氧糖酵解以满足能量需求[21]。此外,线粒体功能的正常是细胞能量代谢与生物合成的关键,线粒体OXPHOS衍生的活性氧(reactive oxygen species,ROS)可促使T细胞的活化和增殖[22]。
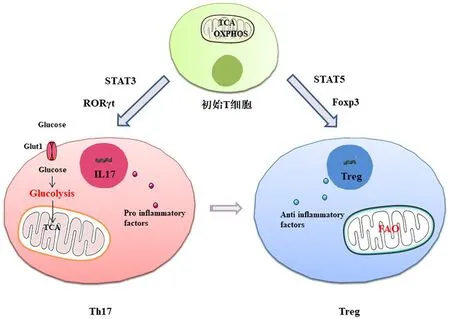
图2 Th17/Treg细胞分化影响因素及主要代谢方式
T细胞亚群通过表达不同的转录因子进行分化,转录因子STAT3、RORγt在Th17细胞的分化和生物功能的调控方面发挥重要作用,而STAT5、Foxp3则对于Treg细胞分化及功能调控至关重要[23-24]。研究表明,天然胆固醇衍生物是RORγt的有效激活剂,其可直接与RORγt配体结合域结合,以RORγt依赖性方式增强Th17细胞的分化,而胆固醇关键酶CYP27A1缺失时,产生IL-17的细胞则显著减少[25]。Th17细胞分化后发生了代谢重编程,与Warburg效应相似,以糖酵解的方式产生ATP以维持细胞增殖及生物合成[26-27]。Treg细胞可抑制免疫反应及炎症过程,具有调节免疫应答和自身免疫耐受的作用,在功能上与Th17细胞相对立[28]。FAO过程是Treg细胞能量代谢的主要方式[29]。此外,在一定条件下,Th17还可转化为Treg细胞来抵抗病原入侵并维持上皮屏障功能[26-27]。
2.2 Th17/Treg细胞代谢重编程调控蛋白及相关信号通路
2.2.1 PI3K/AKT/mTOR 雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)可感知营养物质和生长因子等多种微环境信号,其中多数由磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI3K/AKT)途径输入,最终激活mTOR,见图3。在Th17分化过程中,由TCR受体及周围免疫环境等协同刺激,触发PI3K/AKT/mTOR信号的调节。mTOR是细胞生长和代谢的中央调节器[30]。mTOR信号通过mTORC1和mTORC2两种复合物传递[31]。相关研究表明,mTORC1对于Th17细胞的分化至关重要,在由Th17细胞介导的人类自身免疫性疾病中已观察到mTORC1上调[32]。抑制mTOR活性靶点可诱导Treg细胞关键转录因子Foxp3表达从而促进Treg细胞增殖[33-34],而mTOR激活后可抑制Treg细胞的产生[35]。mTOR活性异常升高通常与适应性免疫疾病相关[30]。

图3 Th17/Treg细胞代谢重编程关键信号通路及调控蛋白
2.2.2 HIF-1α 低氧诱导因子(hypoxia inducible factor,HIF)-1α是促炎基因表达的关键因子,在T细胞、巨噬细胞及DC等多种免疫细胞中发挥作用[36]。免疫细胞根据其激活状态而具有不同的能量需求,由此引发了细胞的代谢重编程。T细胞中的HIF-1α可驱动Th17细胞分化,促进IL-17的产生[37],同时通过维持活化T细胞中的糖酵解活性而抑制Treg细胞诱导[27]。HIF-1α通过调控RORγt的活化而影响Th17细胞的分化过程。研究表明,HIF-1α缺乏可阻碍Th17细胞的发育及效应功能的发挥,HIF-1α可通过直接作用于Foxp3而阻碍Treg细胞的发育[26]。HIF-1α是T细胞发挥免疫功能的关键调控蛋白,对于调节Th17/Treg平衡以及免疫稳态具有重要作用。研究表明,小鼠Th17细胞中HIF1α mRNA和蛋白表达均高于其他T细胞亚群(Th1,Th2和Treg)[38]。敲除HIF-1α会降低多种糖酵解相关蛋白的表达[39],同时Th17细胞分化减弱并增强Treg细胞的诱导[26-27]。
2.2.3 AMPK AMP蛋白激酶(AMP-activated protein kinase,AMPK)在细胞低能状态时激活,并受到肝激酶(liver kinase ,LK)B1调节,可使结节性硬化病(tuberous sclerosis complex,TSC)1/2复合物磷酸化来抑制mTOR信号传导。在T细胞中,AMPK的上游调节因子LKB1和AMPK的下游靶标TSC-1对AMPK的抑制作用使初始T细胞易分化为Th17细胞[40-41]。相反,利用二甲双胍等AMPK激活剂则导致Th17分化受阻,其机制与抑制mTOR及其下游靶标HIF-1α相关[42]。AMPK激活除了可以抑制mTOR-HIF-1α和糖酵解外,还可增加FAO,FAO是一种分解代谢过程,对Th17等效应T细胞具有抑制作用。PI3K/AKT/mTORC1和LKB1/AMPK途径对于Th17/Treg细胞代谢重编程具有重要作用。AMPK激活后抑制了Th17细胞中乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)1的表达,导致RORγt下调,Th17细胞分化降低,Treg细胞分化增加[43]。FAO是Treg细胞的主要代谢方式,棕榈酸转移酶(carnitine palmitoyltransferase,CPT)1A是线粒体FAO的限速酶,在脂质代谢时被诱导激活[44]。
2.2.4 其他信号通路及蛋白 丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)是糖酵解途径中的关键酶,可以将丙酮酸在线粒体中进行TCA循环和OXPHOS。丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDHK)1可通过阻断PDH抑制丙酮酸氧化,并促进其向乳酸转化而间接促进糖酵解。研究发现,PDHK1仅在Th17中表达,在Treg中的表达水平较低,抑制PDHK1后可促进Th17向Treg分化[45]。活化的T细胞除了进行葡萄糖代谢外,还进行脂质代谢以满足T细胞增殖的能量需求[46]。Th17细胞中存在脂肪酸合成(fatty acid synthesis,FAS),FAS由乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)1介导[47]。Th17细胞中ACC1的缺失或被抑制可阻止其生长而促进Treg表型的分化。在Th17细胞中,糖酵解产物丙酮酸被转移到线粒体中形成乙酰辅酶(Acetyl Co)A,进一步形成柠檬酸盐,再从线粒体移出至细胞质中转化为Acetyl CoA,随后为FAS提供燃料[47]。脂肪酸合成酶(fatty acid synthase,FASN)也影响着Th17细胞的分化[45]。
2.3 Th17/Treg细胞代谢重编程与UC
UC是自身免疫性疾病,患者多伴随免疫功能的紊乱,Th17细胞与UC等自身免疫性疾病关系密切[48]。Treg细胞可抑制Th17细胞的功能,在自我耐受和免疫调节中发挥重要作用[49]。细胞代谢重编程可以影响Th17和Treg细胞的分化及功能。UC状态时,由自身免疫反应、组织损伤等多种因素产生的炎症病灶给细胞营造了特殊的生存环境。结肠炎的特点是同时发生炎症和缺氧[50],相关研究报道,人源T细胞在体外暴露于炎症和缺氧的微环境时,HIF-1α表达增加、糖酵解作用增强,同时AMPK活性降低、OXPHOS作用减弱,其原因可能与缺氧增加线粒体ROS、影响HIF-1α作用而促进有氧糖酵解有关[51]。Th17细胞的分化受到HIF-1α的调控,可影响细胞表面蛋白的表达而调节Th17细胞炎症因子的分泌[52]。Treg细胞与Th17细胞可以相互转化,研究表明,肠道炎症会诱导Treg细胞发生代谢重编程成为产生IL-17的细胞,而维生素A对肠道中Treg细胞的代谢重编程具有抑制作用;在体外实验中,IL-2可以阻碍Treg细胞向Th17细胞的转化,但是IL-2和视黄酸在Th17极化条件下可协同维持Foxp3的表达[53]。
UC患者罹患结直肠癌(colorectal cancer,CRC)的风险增加。UC所产生的炎性微环境长期刺激细胞可发生一系列级联反应,从而启动肿瘤的发生发展[54]。在炎症条件下,细胞代谢类型向有氧糖酵解转变,使葡萄糖转运、乳酸合成等糖酵解相关酶保持在较高水平,这些结果也表明,细胞代谢可能在炎症致癌转化的过程中,而不是在肿瘤发生的后期阶段重新编程[55]。此外,缺氧微环境还可能影响HIF-1α的稳定性而增加糖酵解能力,降低线粒体作用[56]。Th17和Treg细胞在CRC免疫调节中具有潜在的重要作用[57]。有报道揭示了IL-6/STAT3通路可能与结肠炎致癌转化有关[58],而STAT3是影响Th17细胞的主要转录因子。研究发现,CRC早期结肠黏膜发生Warburg效应,表现为糖酵解相关蛋白HIF-1α、葡萄糖转运蛋白(glucose transporters,GLUT)、M2型丙酮酸激酶(pyruvate kinase isozymes M2,PKM2)和乳酸脱氢酶(lactate dehydrogenase A, LDHA)的表达变化,为临床CRC生物标志物的开发及药物治疗提供了新的思路和方向[59]。有报道表明,补中益气汤可通过下调糖酵解关键酶己糖激酶(hexokinase,HK)2、LDHA的水平,抑制IL-6/STAT3/细胞-髓细胞瘤病病毒致癌基因(cellular-myelocytomatosis viral oncogene,c-Myc)信号转导通路从而调控细胞代谢重编程,有效阻碍结肠炎致癌的演进过程[60]。
3 基于免疫调控的中药治疗UC
3.1 基于免疫调控的复方中药治疗UC
参苓白术散对葡聚糖硫酸钠(dextransulfatesodium,DSS)诱导的UC小鼠具有治疗作用,与模型组相比,参苓白术散给药组小鼠血清中促炎因子肿瘤坏死因子(tumor necrosis factor,TNF)-α、巨噬细胞移动抑制因子含量显著降低,抗炎因子IL-10、表皮生长因子(epidermal growth factor, EGF)含量明显上升,结肠组织中核因子(nuclear factor,NF)-κB、Toll样受体(toll-like receptor,TLR)4蛋白表达下调,提示参苓白术散可能通过调节TLR4/NF-κB通路及相关炎症因子减轻肠道炎症反应和缓解肠黏膜损伤[61]。网络药理学研究表明,乌梅丸可能通过影响与UC相关的Toll样受体、T细胞受体以及NF-κB等多个信号通路,调控免疫炎症反应、细胞增殖和凋亡以及ROS代谢等多个生物过程从而发挥治疗UC的作用[62]。化浊解毒方能够明显降低血清中促炎因子IL-6含量、升高抗炎因子IL-10含量、调节结肠黏膜T淋巴细胞的表达,从而有效改善UC大鼠结肠病理损伤[63-64]。槐花散合桃花汤加减用于UC活动期寒热错杂证患者,可诱导UC进入缓解期,并通过降低TNF-α、IL-8促炎因子水平和提高抗炎因子IL-10水平而减轻炎症反应、促进肠黏膜愈合,其临床疗效优于5-氨基水杨酸/糖皮质激素的西医治疗方案[65]。参榆灌肠方能够降低2,4,6-三硝基苯磺酸诱导的UC大鼠结肠组织中IL-6含量,促进TGF-β表达,起到减轻炎症、修复肠黏膜的作用[66]。玉屏风散总多糖能显著提高小鼠PP淋巴细胞活性,促使其分泌IL-2、IL-4、IFN-γ,影响PP淋巴细胞中T、B淋巴细胞的比值,从而增强肠黏膜免疫功能[67]。铁皮石斛多糖可以通过改变小鼠肠黏膜形态结构,促进肠黏膜固有层浆细胞合成分泌型免疫球蛋白(secretory immunoglobulin, SIg) A,调节PP和MLN中免疫细胞因子的分泌从而实现对肠黏膜免疫活性的调节作用[68]。大黄牡丹汤是临床用于治疗UC的常用方剂。研究表明,大黄牡丹汤可显著减轻UC小鼠的结肠病理变化,增加肠道菌群丰度,恢复肠道中短链脂肪酸的含量,并通过调节MLN中IL-17α和Foxp3的表达及相关细胞因子水平而恢复Th17/Treg平衡[69]。四神丸可调节PP中CD4+/CD8+T细胞比例,并通过影响RORγt和STAT5α的表达而调节Treg/Th17平衡,从而发挥对结肠炎的治疗作用[70]。另有研究表明,溃结灌肠液可能通过影响MLN中CD4+CD25+Foxp3+Treg细胞和CD3+CD4+IL-17A+Th17细胞数量及相关细胞因子水平,调控Treg/Th17免疫平衡来治疗UC[71]。溃克灵对UC大鼠有明显的治疗作用,提高UC大鼠外周血和MLN中CD4+CD25+Treg细胞数量可能是其治疗机制之一[72]。香参丸可通过调节小肠PP中T细胞亚群平衡以及相关炎症因子的表达来减轻UC大鼠肠道炎症损伤[73]。
3.2 基于免疫调控的中药配伍和炮制中药治疗UC
甘草炮制雷公藤后可使DSS诱导的UC小鼠血清中的TNF-α和IL-6细胞因子水平显著降低,T细胞浸润减少,抑制性T细胞增加,从而使炎症细胞浸润减少,结肠炎症状明显减轻[74]。中药黄连、干姜的主要成分黄连素和6-姜烯酚均能减轻UC小鼠炎症损伤,且黄连素和6-姜烯酚联合应用具有显著的协同增效作用,其机制与抑制TLR4/NF-κB通路的过度活化进而调节肠道非可控性炎症有关[75]。黄连和吴茱萸不同的配伍比例均可以降低DSS诱导的小鼠UC严重程度,不同配伍比例对肠黏膜免疫反应的调节作用相似,主要区别在于对IL-1β及IL-10的作用差异[76]。
3.3 基于免疫调控的中药有效部位及单体成分治疗UC
黄芪多糖可通过降低CD4+T细胞、Th17淋巴细胞水平,提高CD8+、CD25+T淋巴细胞水平,降低CD4/CD8和升高CD25/Th17来调节T淋巴细胞亚群的平衡,从而降低异常免疫反应、减轻炎症损伤而有效治疗UC[77]。连翘酯苷A可使UC大鼠血清IL-4含量、CD4+/CD8+比值升高,血清IgA、IgG、TNF-α和IL-2含量降低,从而增强氧自由基清除力和免疫功能,抑制炎症反应并有效减轻结肠病变[78]。人参皂苷Rg3对DSS诱导的UC小鼠有明确的治疗作用,其机制可能是通过调节Th1/Th2平衡、抑制NF-κB活化从而调节肠道免疫和促进肠道黏膜修复[79]。小檗碱也可以通过修饰肠道菌群和调节Treg/Th17平衡来改善UC[80]。白藜芦醇可以提高CD4+CD25+Foxp3+Treg数量,调节机体和肠道免疫功能,对UC的治疗发挥了一定的作用[81]。
3.4 基于免疫调控的中西药联合使用治疗UC
在西医常规治疗的基础上使用中药显示出更具优势的UC治疗效果。黄芩汤加减联合补脾益肠丸相比于单纯西医治疗UC临床效果更佳,其作用机制可能与抑制血清TLR4/髓样分化因子88信号通路活化进而降低炎症因子水平有关[82]。美沙拉嗪与葛根芩连汤联合治疗UC总有效率高于单纯美沙拉嗪治疗,联合治疗组CD8+、自然杀伤细胞水平高于单纯美沙拉嗪治疗对照组,而IL-8、IL-6、TNF-α水平低于对照组,表明葛根芩连汤联合美沙拉嗪可有效调节机体免疫功能进而减轻炎性反应[83]。美沙拉嗪加用荆芥连翘汤加减有效率高于单纯美沙拉嗪治疗,两组患者的肠黏膜屏障功能均有所改善,联合治疗组TNF-α、IL-8、β-内啡肽、血清丙二醛、过氧化脂质显著低于单纯美沙拉嗪治疗对照组,而IL-2、超氧化物歧化酶显著高于对照组,表明荆芥连翘汤加减内服治疗UC效果较好,其机制可能与纠正机体的免疫状态及降低肠黏膜氧化应激水平有关[84]。在常规西医治疗的基础上,肠炎清合剂[85]及溃结平方[86]均对UC显示出较好的疗效,其机制均与肠道免疫因素有关。研究发现,结肠癌小鼠肠道PP面积明显减少,环磷酰胺进一步抑制了其本已受损的黏膜免疫功能,而环磷酰胺加Rg3可改善结肠癌小鼠黏膜局部免疫功能的抑制作用[87]。
4 结语
虽然关于Th17/Treg细胞代谢重编程的研究已取得一定进展,但是对于UC状态下Th17/Treg细胞代谢变化以及UC治疗过程对Th17/Treg细胞代谢产生的影响仍不完全清楚。免疫功能是肠道的重要功能之一,肠道内包含T细胞、巨噬细胞以及DC等多种免疫细胞,肠道免疫细胞代谢重编程受多种信号分子共同调控,构成了复杂而精密的肠道免疫调控网络。阐明肠道免疫细胞代谢重编程的相关调节机制,对于UC等自身免疫性疾病的治疗具有重要意义。
UC与CRC的发生发展关系密切,随着免疫学的进步以及科学研究的深入,肿瘤微环境中细胞发生代谢重编程已经明确。然而,关于炎症到癌症的演变过程中,肠上皮细胞以及肠道免疫细胞代谢重编程以及相关调控因子发生了哪些变化,文献鲜有报道。针对炎症到癌症转变过程中肠道细胞代谢重编程及相关指标的变化进行研究,对可能存在的相关机制进行分析和探讨,有利于为UC及CRC的临床治疗及相关研究提供新的思路。
中医药具有用药灵活、个体化诊疗等特点,对于改善UC具有一定优势。针对UC状态时细胞代谢重编程的相关蛋白及通路作为药物作用靶标开展相关研究,是未来治疗UC的理想策略,对于探索更安全、有效的UC治疗方案具有重要意义。中药具有多成分、多途径、多靶点的特点,同时也由于其药物组成与机体作用的复杂性为研究带来诸多困难。从中药及复方干预细胞代谢重编程的角度开展相关研究,可更好地阐释中医药治疗UC的科学性与可靠性,有利于中医药现代化的发展。
