中医药调节铁死亡防治缺血缺氧性疾病的研究❋
2024-01-11肖孟勇骆亚莉齐晓风周世琴安方玉刘永琦
肖孟勇,骆亚莉,3△,齐晓风,周 雯,周世琴,刘 凯,安方玉,刘永琦,3
(1.甘肃中医药大学,兰州 730000;2.甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室,兰州 730000;3.甘肃省中医药防治慢性疾病重点实验室,兰州 730000)
缺血缺氧广泛存在于多种临床疾病的发生发展过程中,可引起全身组织器官的损伤,目前缺乏有效的治疗手段。铁死亡是一种铁依赖性调控性细胞死亡方式,胱氨酸/谷氨酸逆转运系统和氧化应激等途径是铁死亡发生的重要分子机制[1]。目前铁死亡研究还处于初期阶段,临床研究及应用更为鲜见。近年研究证实,铁死亡参与缺血缺氧性疾病的发展过程。线粒体破坏是铁死亡的典型形态学改变。中医藏象实质细胞生物学假说认为,线粒体与中医脾为“气血生化之源”所行使的功能相通[2]。中医药具有多点起效、安全廉价的特点,在调节铁死亡方面具有明显优势,加快相关中药研发具有重要意义。本文归纳近年来中医药抑制铁死亡防治缺血缺氧性疾病的相关文献,以期为基础研究和临床治疗提供新的方向及理论支持。
1 铁死亡概述
铁死亡是一种不同于凋亡、坏死和自噬的新型细胞死亡方式,细胞线粒体表现为皱缩状态,线粒体嵴减少或消失。2003年,美国Sonam D研究团队在研究诱导致癌基因RAS突变导致肿瘤细胞死亡的作用机制时,发现这种异于凋亡的细胞死亡过程[3]。2012年,Dixon等[4]将铁依赖性脂质过氧化、活性氧(reactive oxygen species, ROS)堆积、P53介导的细胞死亡命名为铁死亡。铁蓄积是铁死亡的必要条件,铁死亡参与炎症、心血管等疾病的病理改变[5-6]。
2 铁死亡相关机制研究进展
2.1 胱氨酸/谷氨酸逆转运系统
胱氨酸/谷氨酸逆转运系统(membrane Na+-dependent cystine / glutamate reverse transporter,System Xc-)与细胞对铁死亡的敏感性密切相关。研究发现抑制此系统可导致细胞半胱氨酸(cysteine, Cys)或谷胱甘肽(glutathione, GSH)消耗,破坏细胞氧化还原稳态,导致铁死亡[7]。胱氨酸(cystine, Cys-Cys)通过System Xc-进入到细胞内并被还原为Cys,参与GSH的合成,谷氨酸(glutamic acid, Glu)以1:1的比例交换Cys-Cys,因此Glu水平会影响System Xc-的功能[8]。Glu升高会抑制System Xc-的活性并阻止Cys-Cys的摄取,引起铁死亡。System Xc-在阻止脂质过氧化物介导的铁死亡中发挥显著作用。
2.2 核因子-红细胞-2相关因子2
核因子-红细胞-2相关因子(nuclear factor-erythroid 2 related factor, Nrf)2是抗氧化反应的主要调节因子,其下游靶基因参与阻止细胞中的氧化还原失衡。Nrf2可以被p62-Keap1相互作用激活,与铁和抗氧化系统相关的抗氧化反应原件(anti-oxidative response element, ARE)同时增加[9]。氧化刺激条件下,Nrf2反式激活选择性自噬接头蛋白(sequestosome, SQSTM)1编码p62蛋白,p62积累促进Keap1的p62依赖性自噬降解,进而抑制Keap1介导的Nrf2降解[10]。Nrf2是由Keap1介导经泛素-蛋白酶体途径降解的。实验证明,Nrf2激活剂可以预防铁死亡诱导的神经退行性病变[11]。综上,Nrf2调控因子在铁死亡中的作用不容忽视。
2.3 谷胱甘肽过氧化物酶4
谷胱甘肽过氧化物酶(glutathione peroxidase, GPX) 4是一种细胞内硒蛋白抗氧化酶。Yang等[12]发现GSH的缺失会导致GPX4酶的失活,GPX4的敲低或者过表达可以调节铁死亡诱导剂的致死率。GPX4和铁死亡抑制蛋白(ferroptosis suppressor protein, FSP)1可以清除脂质ROS。GPX4是哺乳动物细胞中唯一负责磷脂氢过氧化物 (phospholipid hydroperoxide, PLOOH)还原的酶,且能抑制花生四烯酸活化,在保护细胞免受氧化损伤方面发挥至关重要的作用[13]。豆类蛋白酶促进分子伴侣介导的GPX4自噬,可以促进肾小管细胞铁死亡[14]。因此GPX4是铁死亡的关键调控因子之一。铁死亡的分子机制见图1。
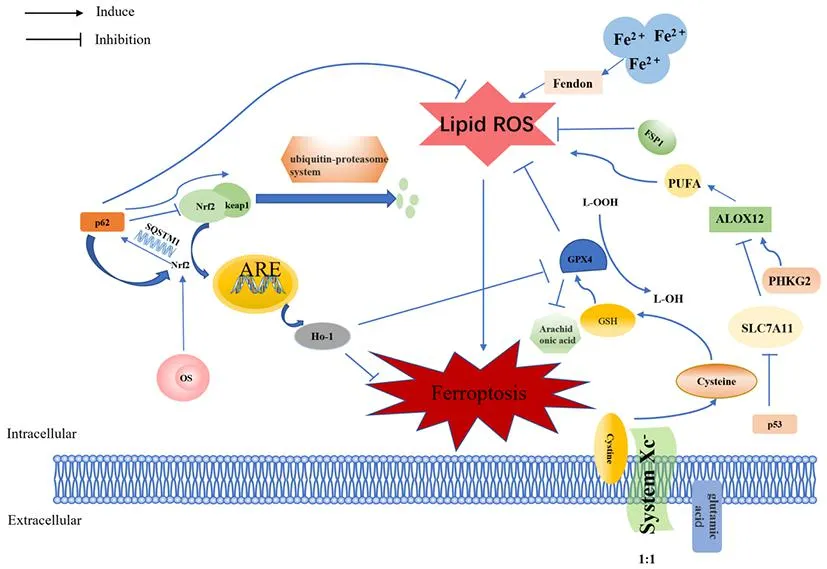
图1 铁死亡的分子机制
2.4 铁代谢
铁的吸收、利用平衡中断,亚铁离子Fe2+积累会催化Fenton反应。铁代谢关键蛋白有铁蛋白、转铁蛋白(transferrin, TF)、二价金属转运体(divalentmetal-ion transporter, DMT)1及溶质载体蛋白7家族成员(solute carrier family 7 member, SLC7A)11。SLC7A11的功能是输入Cys-Cys进行GSH生物合成和抗氧化,其过表达可以抑制铁死亡[15]。p53能够抑制SLC7A11的转录间接激活脂氧合酶(lipoxidase, ALOX)12的功能,导致ROS应激时发生ALOX12依赖性铁死亡[16]。
2.5 脂质过氧化
多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)是铁死亡过程中最易受过氧化影响的脂质。磷酸化酶激酶γ(phosphorylase kinaseγ, PHKG)2调节ALOX,进而通过双烯丙基位置的 PUFA的过氧化作用驱动铁死亡[17]。ALOX可以使PUFA与氧自由基结合生成脂质过氧化物[18]。ALOX在脂质过氧化中扮演着重要的角色。
3 缺血缺氧与铁死亡
缺血缺氧可以引起全身各组织器官的损伤。在低氧条件下,抗氧化蛋白Sestrin2可通过Nrf2通路减少ROS的生成发挥保护作用[19]。在缺血缺氧状态下,微环境会释放大量有毒物质、炎症递质及促凋亡因子,如促凋亡基因Bax、T淋巴细胞及趋化因子等。有研究显示,铁死亡与缺血缺氧所致多器官缺血再灌注(ischemia/reperfusion,I/R)相关[20]。
3.1 心脑血管疾病与铁死亡
心肌细胞和神经元死亡涉及包括铁死亡在内的多种机制。缺氧的心肌细胞ROS含量显著增加。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)的过度表达可以抑制ROS的产生,保护心肌细胞免受铁蓄积和铁死亡的影响[21]。mTOR的下游效应器核糖体蛋白S6激酶(ribosomal protein s6 kinase, S6K)1和真核翻译起始因子4E结合蛋白(eukaryotic translation initiation factor 4e binding protein, 4EBP)1可以调节蛋白质生成和细胞周期,恢复心肌梗死的心室功能[22]。另外,血红素加氧酶(heme oxygenase, HO)-1上调可降解血红素并释放心肌细胞中的游离铁,导致线粒体铁超载和脂质过氧化,引起心肌细胞铁死亡[23]。
脑卒中也存在铁死亡现象。酰基辅酶A合成酶长链家族成员(acyl-CoA synthetase long chain family member, ACSL)4可增强脂质过氧化促进铁死亡,还能促进胶质细胞产生促炎性细胞因子肿瘤坏死因子(tumor necrosis factor, TNF)-α、白细胞介素(interleukin, IL)-6和IL-1β。在脑缺血早期,缺氧诱导因子(hypoxia inducible factor, HIF)-1α可调节氧糖剥夺(oxygen-glucosedeprivation, OGD)降低ACSL4的表达[24]。ACSL4过表达会引起氧化还原反应失衡,释放大量ROS,进一步加重炎症反应。超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、GSH组成机体的抗氧化系统,GSH可激活下游信号分子GPX4,抑制脂质过氧化,抗氧化系统受损会促进铁死亡。铁死亡在心脑血管疾病中的作用机制见图2。
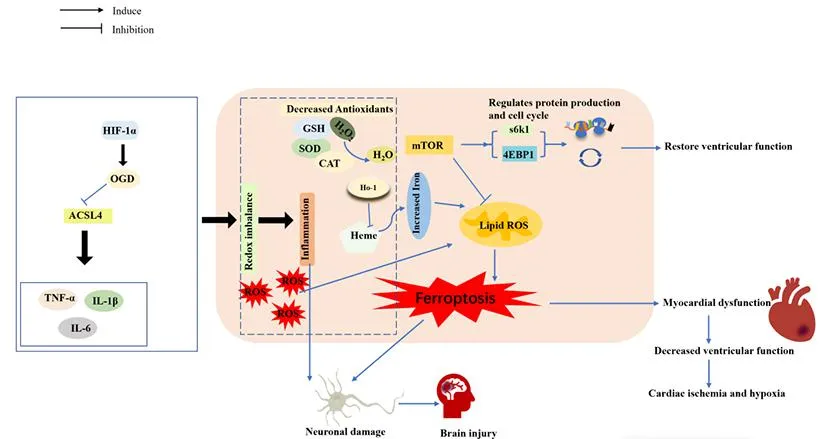
图2 铁死亡在心脑血管疾病中的作用机制
3.2 呼吸系统疾病与铁死亡
呼吸系统疾病中铁死亡相关研究多集中在肿瘤疾病[25-26]。急性肺损伤(acute lung injury, ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)相关研究较少。在油酸诱导的ALI小鼠模型中,肺泡Ⅱ型上皮细胞出现线粒体皱缩和线粒体膜破裂,丙二醇(malondialdehyde, MDA)、前列腺素内过氧化物合酶(prostaglandin endoperoxide synthase, PTGS)2上调,铁蛋白、GSH、GPX4降低,肺细胞内铁含量增多[27]。铁过量可发生Fendon反应产生大量ROS,加剧氧化损伤,进一步促进IL-1β、TNF-α等炎症因子和MDA、4-羟基壬烯醛等毒性脂质过氧化产物的产生[28]。当外来病原体入侵时也会诱导炎性免疫反应,产生不同的细胞因子、趋化因子、干扰素、ROS等,参与肺部炎症反应。铁死亡在呼吸系统疾病中的作用机制见图3。
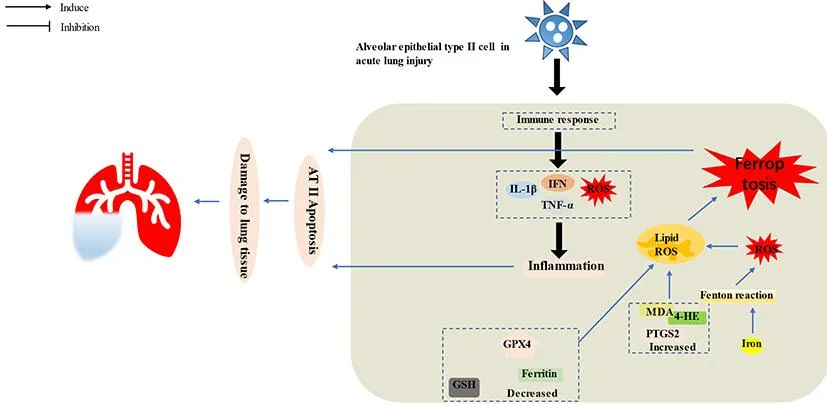
图3 铁死亡在呼吸系统疾病中的作用机制
西医治疗缺血缺氧性疾病主要采用的方法有强心、利尿、扩血管、机械通气、改善微循环等,在一定程度上可纠正缺血缺氧,但是对于慢性持续存在的缺血缺氧相关疾病如肺纤维化、慢性心力衰竭、脑梗死等疗效有限。研究显示,铁死亡参与缺血缺氧性疾病的发展,铁死亡抑制剂的开发可能为缺血缺氧性疾病治疗提供新的思路。目前,铁死亡抑制剂主要有铁螯合剂去铁胺(deferoxamine, DFO)、去铁酮(deferiprone, DFP)及地拉罗司(deferasirox, DFX);抗氧化剂Trolox、GSH、ferrostatin-1及N-乙酰半胱氨酸这2类。有调查研究发现,DFP易致粒细胞缺乏症等不良反应[29]。由于铁死亡机制未完全阐明,铁死亡抑制剂尚未在临床中广泛应用。然而中药具有多靶点、协同增效、安全等优势,因此开发抑制铁死亡的天然药物具有重要意义。
4 中医药调节铁死亡防治缺血缺氧性疾病
4.1 基于中医气血理论对铁死亡的认识
铁死亡主要发生在线粒体中,以线粒体破坏为标志性特征,线粒体是调节铁和产生ROS的主要细胞器。线粒体是真核细胞腺苷三磷酸(adenosine 5'-triphosphate,ATP)的生产基地,与气血生化之源“脾”有着共通之处[30]。线粒体损伤会引起机体功能低下,这与脾虚所致肢体倦怠、神疲乏力症状十分契合。刘友章教授于1991年首次提出“中医脾-线粒体”假说[31],线粒体能量代谢障碍是脾虚病机的生物学表现之一。因此铁死亡与脾虚关系密切。肾为先天之本,主纳气;脾为后天之本,主气血生化。先天得后天之充养,后天得先天之资助,相互资生、相互促进而生生不息[32]。脾虚损及肾脏会引起缺血缺氧性疾病的发生,健脾益气、调理气血可以为调节铁死亡防治缺血缺氧性疾病提供新的见解。
气血属于阴阳的范畴,所谓“阴阳为纲,气血为本”。相关研究表明中药复方、中药活性成分均可以调节铁死亡,提示调控铁死亡可能是中医药治疗多种疾病的重要机制,总体原则为调整阴阳[33]。同阴阳交感、消长、对立制约的恒动过程相似,生命、疾病一直处于“涨落”的动态变化中。如细胞增殖、凋亡正是在人体阴阳的调控下有序进行,一旦阴阳失衡,就会出现疾病。中医理论认为凡运动、上升、兴奋属阳;相对静止、下降、抑制属阴。铁死亡(阴)是细胞死亡的特殊形式。铁死亡抑制剂旨在调整阴阳,抑制铁死亡可保护正常组织免受伤害,相当于中医的抑阴扶阳理论。中医气血理论对铁死亡的认识见图4。
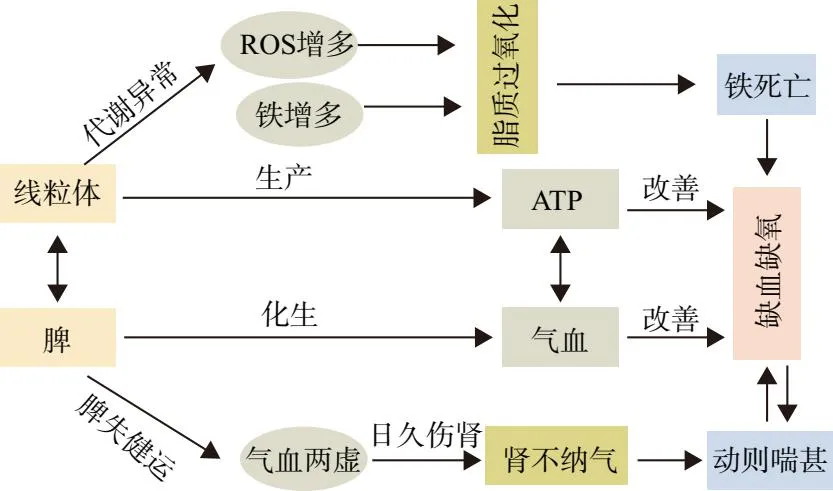
图4 中医气血理论对铁死亡的认识
4.2 中医药调节铁死亡防治心脑血管疾病
4.2.1 中药活性成分抑制铁死亡 目前有关研究表明,中药活性成分可通过抑制铁死亡防治心血管疾病。研究证实,丹参酮ⅡA可激活Nrf2通路抑制冠状动脉内皮细胞发生铁死亡,为动脉粥样硬化疾病治疗提供了新的思路[34]。另有研究发现,黄芪甲苷可以通过激活Nrf2信号通路、增加GPX4的表达抑制铁死亡,从而减弱心肌病带来的损害[35]。红花黄色素可以抑制Fe2+和ROS的积累,逆转血清中GSH、SOD和MDA水平[36]。黄芩苷可以清除脑组织内铁沉积,减少ROS的产生,发挥对脑出血模型小鼠脑损伤的保护作用[37]。白藜芦醇可通过减轻氧化应激、降低Fe2+保护心肌I/R损伤[38]。Liu等[39]报道葛根素能够抑制脂质过氧化和铁过载,抗心肌细胞死亡。综上可见,中药活性成分可以调控Nrf2、GPX4表达及铁代谢、脂质过氧化,降低ROS产生和MDA水平,进而改善心脑血管疾病。
4.2.2 中药复方抑制铁死亡 越来越多的研究表明,中药汤剂及注射液在心脑血管疾病动物/细胞模型中同样发挥显著的作用。研究发现参麦注射液可降低心肌Fe2+和MDA含量,上调Nrf2和GPX4蛋白表达,减少心肌梗死面积[40]。用脑泰方治疗大脑中动脉栓塞(middle cerebral artery occlusion, MCAO)大鼠发现,其可通过SCL7A11/GPX4途径抑制神经元铁死亡[41]。何信用等[42]发现二陈汤合桃红四物汤能明显改善小鼠模型的动脉粥样硬化,其机制是通过调控p53/SLC7A11介导的氧化损伤、降低铁蛋白含量抑制铁死亡。实验证实,复方通络汤可通过抑制内质网应激和铁蛋白生成,抑制脑梗死疾病中的铁死亡[43]。大量实验发现,中药复方通过上调Nrf2、GPX4表达,降低Fe2+、铁蛋白、MDA、P53水平,进而改善心脑血管疾病症状。复方中药具有多种中药生物活性成分,体现出其多靶点、多环节发挥抑制铁死亡的作用特点。心脑血管疾病辨证为血瘀证时,无论急性期或恢复期,均可采用活血化瘀法[44]。归纳发现上述中药多为活血药,如丹参、红花、川芎、桃红四物汤等。进一步加深对活血类中药调节铁死亡的相关研究,有助于完善此类中药治疗心脑血管疾病的药效及其分子机制。
4.3 中医药调节铁死亡防治呼吸系统疾病
目前关于铁死亡如何参与呼吸系统疾病发生发展的研究较少,中医药的相关研究更为鲜见。Lu等[45]在ALI小鼠模型研究中发现,牡荆素可以通过激活Nrf2/HO-1通路,降低ROS保护细胞免受脂质过氧化来抑制ALI中的铁死亡。人参环氧炔醇可以上调Keap1-Nrf2/HO-1通路从而减轻ALI的铁死亡[46]。姜黄素可以通过降低MDA、SOD水平抑制脂质过氧化,缓解大鼠骨骼肌I/R所致肺损伤[47]。
肺主气,司呼吸,主行水;脾为气血生化之源,主运化水液,因此肺和脾的关系就是气和水的关系。肺脾功能受损可致各脏腑功能不协调,防御能力不足,邪气频犯而导致慢性肺部疾病[48]。脾虚则水液运化失常,出现痰饮、湿浊、水肿等病理产物,影响肺的肃降,则出现咳、痰、喘。肺脏虚损,肺气不利,气滞血瘀,瘀久化热,酝生毒邪,痰湿瘀毒互结,严重者会出现肺间质瘀血、渗出,甚至呼吸衰竭,相当于西医中ALI、ARDS等重症。前文论证了铁死亡与脾的关系,肺与脾在病理生理上相互影响,因此铁死亡在呼吸系统疾病中发挥的作用及机制值得进一步探索,期望筛选出可特异性抑制铁死亡的中药防治呼吸系统疾病。中药抑制铁死亡防治缺血缺氧性疾病的相关机制见表1。

表1 中药抑制铁死亡防治缺血缺氧性疾病的相关机制
目前中医药抑制铁死亡防治缺血缺氧性疾病的研究多侧重于动物水平。大多数研究者采用“疾病-方药-指标”的传统药理学实验方法,疾病模型主要有心脏缺血再灌注、动脉粥样硬化、脑卒中、急性肺损伤等,中药主要通过干预脂质过氧化、铁代谢等通路发挥作用。然而对铁死亡动物模型及细胞的研究匮乏,较少涉及心、脑、肺以外的器官,后续可以进一步加深中药调节铁死亡的机制研究。
5 结语
基于“气血理论”及中医脾与线粒体的关系,从脾虚探讨铁死亡的可能机制,有助于为进一步探讨铁死亡参与缺血缺氧性疾病的发生发展机制奠定中医理论基础。虽然近年有研究显示,脂质过氧化、ROS等参与铁死亡的形成过程,但铁死亡分子机制研究还很局限,因此中药铁死亡抑制剂的研发受到严重阻碍。下一步研究考虑可建立缺血缺氧性疾病动物模型,综合应用蛋白组学、基因工程干预等现代分子生物学技术,开展疾病模型的组织器官形态结构、功能代谢等多方面的综合评价,有助于深入探讨铁死亡的分子机制。在此基础上,结合分子对接、计算机模拟筛选等现代药物研究技术,应用健脾益气、补血活血类中药及其有效成分开展干预研究,进行药效评价分析其对铁死亡的作用,可为研发提高缺血缺氧性疾病防治疗效的天然药物提供实验依据。
