基于转录组测序和RT-qPCR技术的烟草糖酯合成基因挖掘
2024-01-11黄申闫茗熠陈梦月尚紫博杨晨张金林褚智国毛多斌
黄申,闫茗熠,2,陈梦月,尚紫博,杨晨,张金林,褚智国,毛多斌
1.郑州轻工业大学 烟草科学与工程学院,河南 郑州 450001;2.山东中烟工业有限责任公司 济南卷烟厂,山东 济南 250000;3.山东中烟工业有限责任公司 技术中心,山东 济南 250000
0 引言
在烟草中,由烟叶表面腺毛细胞分泌的糖酯[1-2]是一类重要的香味前体物,也是烟用香精香料的重要组成部分之一,对烟叶的香气品质有积极影响[3-5]。在卷烟燃烧时,糖酯的裂解产物主要是3-甲基丁酸、3-甲基戊酸、异丁酸、异戊酸等挥发性酸性物质,可以提升卷烟香气,使香气更加浓郁[6]。糖酯还能够在烟草叶面上生成一层油水相隔的双分子层保护膜,具有保润、保香作用[7-9],相较于其他保湿剂,其更具安全性且不易影响烟草本香。此外,烟草糖酯还能够调节植物生长,具有抗虫、抗菌活性,因其作用广泛而被学者关注[10]。
糖酯的合成机制较为复杂,主要分为酰基链合成和酰基链与蔗糖底物羟基的连接两个步骤。目前,对与烟草同属茄科的番茄、牵牛花等植物糖酯合成途径的关键基因和分子机制的研究已取得重要进展[11-13],但对调控烟草糖酯合成途径关键基因的研究仍较为缺乏。因此,深入探索烟草中参与糖酯形成的基因,对进一步揭示烟草糖酯合成调控的分子机制,以及对糖酯的进一步开发利用具有重要意义。
通过转录组测序可以分析组织内所有转录产物(RNA),从而获得组织内基因表达水平[14-15]。荧光实时定量PCR(RT-qPCR)技术能够定量评估特定基因在样品中的表达水平,可作为转录组测序分析更加精准的技术补充[16]。基于此,本文拟对比分析烟草腺毛细胞和叶细胞的转录组数据,以筛选与糖酯合成相关的功能基因,并通过RT-qPCR对这些基因表达水平进行验证,以期初步挖掘烟草糖酯合成基因,进而为研究糖酯的代谢调控提供理论基础。
1 材料与方法
1.1 材料、试剂与仪器
主要材料:K326烤烟中部烟叶,生长于河南省平顶山市,生长周期为90 d,长度为40~50 cm。
主要试剂:RNeasy Plant mini Kit 试剂盒,上海恒斐生物技术有限公司;PrimeScript TM 1st stand cDNA Synthesis Kit 试剂盒,宝日医生物技术北京有限公司;二氯甲烷,分析纯,山东禹王和天下新材料有限公司;BSTFA-TMCS、DMF,均为分析纯,美国默克生命科学技术有限公司。
主要仪器:Agilent 8890型气相色谱质谱-联用(GC-MS)仪,美国安捷伦科技有限公司;Mini Pro 300V Power Supply型电泳仪,上海器仁仪器有限公司;Tanon2500型凝胶成像系统,上海天能科技有限公司;Labnet Sub System 70型电泳槽,苏州赛恩斯仪器有限公司;TIB8600型实时荧光定量PCR仪,泰普生物科学中国有限公司;Lieca DM750型常规正置光学显微镜,德国徕卡显微系统公司。
1.2 实验方法
1.2.1 烟叶表面糖酯的提取及GC-MS分析采用浸提法从新鲜烟叶样品中提取糖酯[17],将烟叶样品在3个盛有25 L二氯甲烷的不锈钢桶中按顺序分别浸提3次,每次2~3 s,合并和过滤二氯甲烷浸提液,在40 ℃条件下旋转蒸发浓缩,将浓缩液于60 ℃条件下干燥,即得烟叶表面浸提物。取少量浸提物加入0.2 mL BSTFA-TMCS和 DMF体积比为1∶1的溶液中,密封,在70 ℃水浴中保温1 h进行衍生化处理[18]后,进行GC-MS检测。
GC条件为:HP-5 MS毛细管色谱柱(30 m×250 μm×0.25 μm);初温120 ℃保持3 min,以10 ℃/min的速率升温至270 ℃,再以3 ℃/min的速率升温至300 ℃保持20 min,结束;汽化室温度300 ℃;载气为高纯He(99.999%);流速1.0 mL/min;进样量为1.0 μL,分流比1∶1。
MS条件为:电离方式电子轰击(EI);电子能量70 eV;传输线温度280 ℃;四极杆温度150 ℃;电子倍增器电压1.34 kV;扫描范围40~900 amu;全扫描模式。
1.2.2 细胞样品制备及转录组测序显微镜下烟叶表面腺毛形态如图1所示。采用冷刷法[19]分离腺毛,将在液氮中冷冻后的叶片置于倾斜的不锈钢板上,用合适的毛刷刷洗,并将分离出的腺毛和刷洗后的叶片分别作为腺毛细胞样品(Y1,Y2,Y3)与叶细胞样品(C1,C2,C3)保存于液氮中。使用RNeasy Plant mini kit试剂盒的标准方案提取细胞样品总RNA,通过甲酰胺凝胶电泳评估RNA的质量和数量。将所得RNA干冰保存送至南京派森诺基因科技有限公司进行转录组测序及基本数据分析。每个样品的测序量为6.8~8.0 Gb。采用 DESeq 对腺毛细胞组和叶细胞组基因表达进行差异分析,根据倍性变化(Fold Change,FC)和P值筛选差异表达基因,筛选条件为:表达差异倍数 |log2(FC)|>1 ,显著性P<0.05。
1.2.3RT-qPCR分析使用PrimeScript TM 1st stand cDNA Synthesis Kit 试剂盒合成cDNA.,扩增体系和反应程序如下:反应体系为 20 μL,其中2×SYBR real-time PCR premixture 10 μL,10 μmol的正反向引物各0.4 μL,cDNA 模板 1 μL,ddH2O 8.2 μL。将配制的PCR反应溶液置于实对荧光定量PCR仪上进行PCR反应,反应程序为:95 ℃ 5 min;95 ℃ 15 s、60 ℃ 30 s,40个循环。每个样品重复3次。
2 结果与讨论
2.1 烟叶表面糖酯GC-MS分析结果
烟叶表面浸提物衍生化后GC-MS总离子图如图2所示。由于标准谱库中没有相应的衍生物的标准MS图,因此,通过解析MS碎片并与文献[20-21]中报道的数据对照进行定性分析,确认了保留时间为36~47 min的一系列峰为烟草糖酯中主要成分(蔗糖四酯,STE)的特征峰。由图2可知,烟叶样品在该生长发育期具有蔗糖酯生物合成活性,可作为转录组测序和RT-qPCR分析的样品。
2.2 差异表达基因筛选及其功能分析
2.2.1 测序结果统计学分析6个样品的Q30碱基均达90%,采用 Cutadapt 去除 3′ 端带接头的序列,去除平均质量分数低于 Q20 的序列,通过对转录本数据的合并组装,拼接后共得到 73 945 条序列,过滤后数据统计见表1。

表1 过滤后序列数据统计表Table 1 Statistics of sequence data after filtering
对腺毛细胞和叶细胞样品的基因进行统计学分析,结果如图3所示。由图3a)可知,同类样品间相似性高,符合后续研究要求。由图3b)可知,腺毛细胞组织和叶细胞组织的基因表达水平表现出明显差异。

图3 腺毛细胞和叶细胞样品基因统计学分析结果Fig.3 Gene statistical analysis of glandular hair cells and leaf cell samples
2.2.2 差异表达基因分析腺毛细胞和叶细胞之间差异表达基因如图4所示。由图4可知,叶细胞组和腺毛细胞组之间共有11 962个差异基因的表达显示出差异,腺毛细胞中有5145 个(43%)上调表达基因、6817 个(57%)下调表达基因。
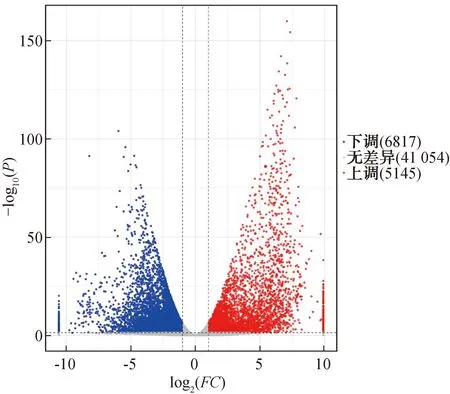
图4 腺毛细胞和叶细胞之间差异表达基因Fig.4 Differentially expressed genes between glandular hair cellsand bundle sheath cells
2.2.3 功能分析为了解腺毛细胞基因的差异表达情况,对上调表达基因进行GO富集分析,根据GO数据库,所有具有GO分类信息的基因被分配到3个主要的类别共3797个条目中,包括生物学进程(2265个条目)、分子功能(1169个条目)和细胞成分(363个条目),每个类别富集最显著的10个功能条目,结果如图5所示。由图5可知,分子功能主要包括氧化还原酶活性、四吡咯结合,细胞成分主要包括叶绿体、质体相关、类囊体膜等,这些基因与糖酯合成的相关度较小。生物学进程中可能与糖酯合成相关的条目主要有氧化还原过程(包含1915个基因)、碳水化合物代谢过程(包含967个基因)、代谢过程(10450个基因)、催化活性(8836个基因)等,后续将在这些基因中作进一步的筛选。

图5 GO功能富集结果Fig.5 GO functional classification
根据KEGG pathway数据库,可将生物学进程相关基因定位到122个具体的代谢通路,根据参与的代谢通路将基因分为3个分支,环境信息处理(Environmental Information Processing),人类疾病(Human Diseases)和代谢(Metabolism)(见图6)。由图6可知,其中于糖酯合成相关的糖酵解/糖异生(Glycolysis/Gluconeogenesis,307个)、淀粉和蔗糖代谢(Starch and Sucrose Metabolism,337个)、苯丙烷类生物合成(Phenylpropanoid Biosynthesis,480个)代谢通路被高度富集,且所包含基因较多,酰基糖通路显著上调。同时还富集到与脂质代谢相关的脂肪酸延长(Fatty Acid Elongation,77个)、不饱和脂肪酸生物合成(Biosynthesis of Unsaturated Fatty Acids,54个)和甘油脂代谢(Glycerolipid Metabolism,166个)等通路。

图6 KEGG 通路富集结果Fig.6 KEGG functional classification
2.3 糖酯合成基因筛选结果
相关研究[22-26]已鉴定了一类糖酯合成关键基因属于酰基转移酶家族(BAHD家族),在腺毛中特异性表达,可催化酰基-CoA与蔗糖骨架上的羟基发生酯化反应,形成不同类型的糖酯。本文对比了烟草腺毛转录组和叶细胞转录组数据,筛选出20个可能与糖酯合成相关的烟草腺毛上调表达基因(见表2)。将20个上调表达基因在红花烟草参考基因组(Nicotiana Tabacum Reference Genome Ntab-TN90)数据库中进行比对,剔除致病相关蛋白(gene50509)和脯氨酸富集蛋白(gene73405)等8个和烟草糖酯合成不相关的基因,发现剩余的12个高表达基因(gene53224、gene16194、gene63826、gene54958、gene19020、gene58818、gene65489、gene40415、gene37511、gene9182、gene42122和gene69978)与已报道BAHD家族基因[27]相似性较高,功能上与酰基转移酶相关,推测其可能与烟草糖酯合成相关。
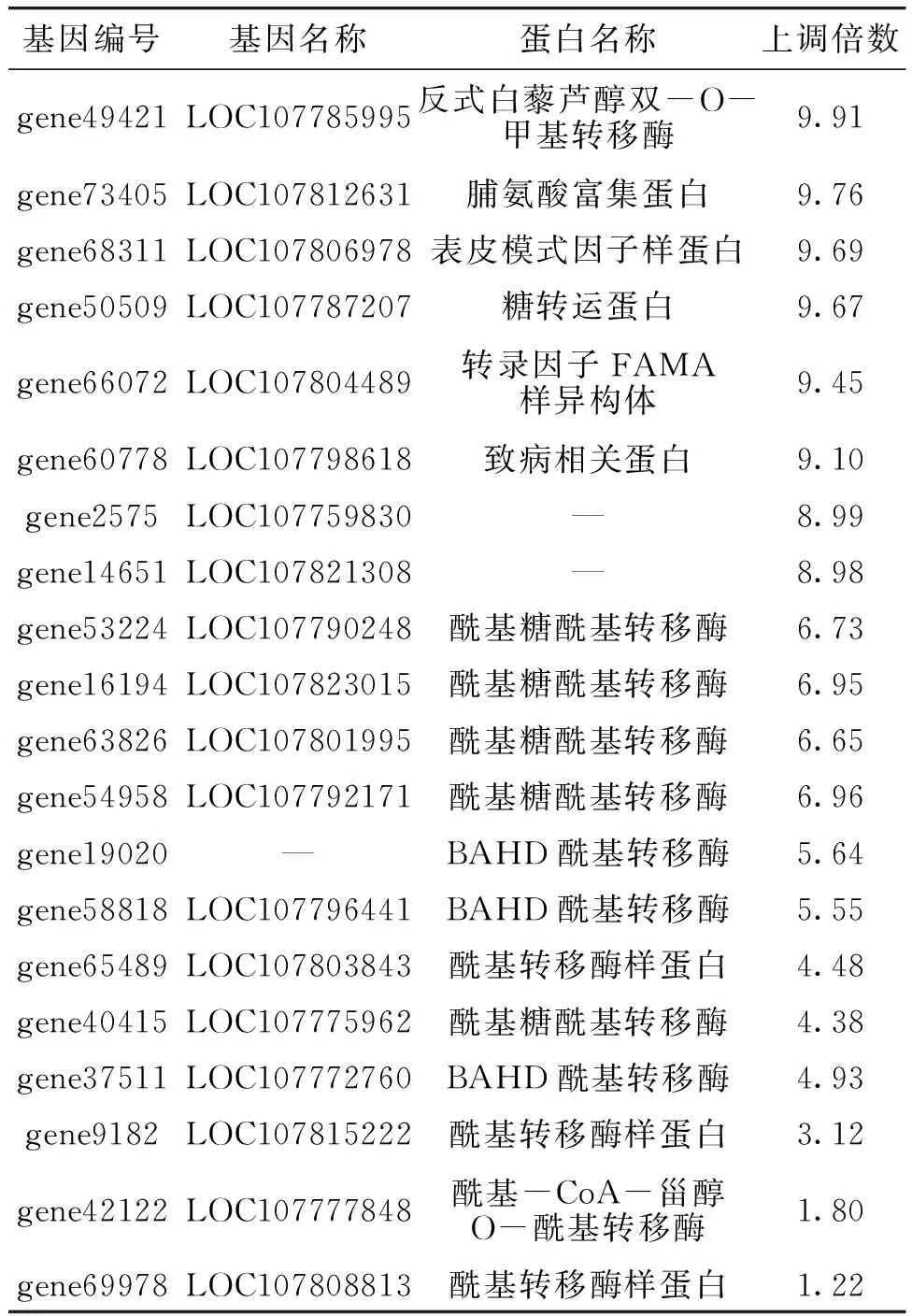
表2 20个上调差异表达基因Table 2 The 20 up-regulated DEGs
2.4 RT-qPCR验证结果
为进一步验证上文筛选得到的这12个差异表达基因的准确性,进行 RT-qPCR 分析,所用引物信息见表3。差异表达基因在腺毛细胞和叶细胞中的相对表达量结果见图7,其中ns表示没有差异;*表示P<0.05,差异显著;** 表示P<0.01,差异极显著;*** 表示P<0.001,差异极显著。由图7可知,12个差异表达基因中,除gene53224外的其他11个基因在腺毛细胞中的表达明显上调,gene63826、gene16194和gene37511表达上调倍数较大,分别为195.79倍、166.23倍和132.65倍,这表明转录组测序数据基本可靠。
表3 差异表达基因RT-qPCR所用引物Table 3 Primers used for RT qPCR of differentially expressed genes
3 结论
本研究通过DESeq对烟草叶片的腺毛细胞和叶细胞进行转录组测序分析,共获得73 945条序列,通过差异表达基因分析在腺毛细胞中筛选到5145 个上调表达基因、6817 个下调表达基因。上调表达基因主要包括生物过程、分子功能、细胞成分三大类,可将基因序列定位到122条代谢通路中,其中与糖酯合成相关的糖酵解/糖异生、淀粉和蔗糖代谢、苯丙烷类生物合成被高度富集。结合其他植物腺毛转录组分析结果和红花烟草参考基因组发现gene73405、gene68311、gene66072等12个上调表达基因可能与糖酯合成有关。RT-qPCR验证分析进一步表明,这12个基因中除gene73405外的其他11个基因在腺毛细胞中的表达明显上调,其中gene63826、gene16194和gene37511的表达分别上调195.79倍、166.23倍和132.65倍,转录组测序数据基本可靠。本文从烟草腺毛细胞转录组数据库中发掘到一系列与烟草蔗糖四酯类化合物生物合成相关的酶基因,有助于从分子水平上解析烟草蔗糖四酯的生物合成途径,为其进一步研究提供理论基础。
