基于改进G-四链体DNA酶的电化学适配体传感器构建及卡那霉素高灵敏检测
2024-01-11伍永梅朱肖倩方娇白艳红
伍永梅,朱肖倩,方娇,白艳红
1.郑州轻工业大学 食品与生物工程学院,河南 郑州 450001;2.河南省冷链食品质量安全控制重点实验室,河南 郑州 450001;3.食品生产与安全河南省协同创新中心,河南 郑州 450001
0 引言
卡那霉素(Kanamycin,KANA)是一种氨基糖苷类抗生素,可以抑制革兰氏阳性和革兰氏阴性细菌蛋白质的合成,常作为兽药广泛用于畜牧业中奶牛的饲养[1]。但过量使用会导致牛奶中的抗生素残留,残留的KANA通过食物链进入人体,经过长时间的体内积累对人体造成损伤。传统的抗生素检测技术主要包括高效液相色谱(HPLC)法[2]、液相色谱-质谱(LC-MS)法[3]、毛细管电泳(CE)法[4]、酶联免疫分析(ELISA)法[5]、气相色谱-质谱(GC-MS)法[6]。但这些技术均存在预处理步骤繁琐、操作成本高昂等问题[7]。因此,开发一种快速、可靠、便捷的抗生素检测方法具有重要意义。
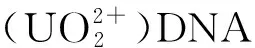
G-四链体(G4)是由一段富含鸟嘌呤(G)碱基的寡核苷酸序列组成[13],可以在单价阳离子(如Na+、K+)的作用下与卟啉铁(Hemin)结合,形成具有辣根过氧化物酶(HRP)活性的模拟酶,即Hemin/G4 DNAzyme[14]。Hemin/G4 DNAzyme具有成本低、稳定性好、催化活能高等优点,可催化底物H2O2加速电子转移,显著增强电化学信号[15],但比天然HRP活性低。鉴于此,本文拟以KANA为目标物,将多肽(Peptide)与G4 DNAzyme共价组装得到高活性的G4 DNAzyme-peptide复合物,以Hemin为电子媒介体构建电化学适配体传感器,考查该复合物对电化学适配体传感器响应性能的影响,并将该传感器应用于牛奶中KANA的检测,以期为食品中抗生素的高灵敏检测提供新思路。
1 材料与方法
1.1 主要材料与试剂
牛奶,郑州市高新区大张超市;卟啉铁(Hemin)、6-巯基己醇(6-Mercaptohexyl Alcohol,MCH)、三(2-羧乙基)膦酸盐(Tris-(2-carboxyethyl)-phosphine Hydrochloride,TCEP)、氯金酸(HAuCl4),均为分析纯,Sigma-Aldrich公司;组氨酸多肽(Peptide),上海科肽生物技术有限公司(中国);卡那霉素(KANA)、妥布霉素(Tobramycin,TOB)、链霉素(Streptomycin,STR)、四环素(Tetracycline,TET),均为标准品,上海阿拉丁生化科技股份有限公司;5×TBE缓冲液,海生工生物工程有限公司;抗生素适配体序列[16](Aptamer,Apt:5′-TGGGGGTTGAGGCTAAGCCGA-3′,解离常数为78.8 nmol/L)、模板DNA序列(Template,TP:5′-CCCGCCCTACCCACAGTGAT-CGGCTTAGAGGACTACCCCCA-3′)、辅助探针序列(Assistant Probe,AP:5′-GTCCTCTAAGCCGATCACTGTGGGTAGGGCGGG-3′)、捕获探针序列(Capture Probe,CP:5′-SH-AGTGATCGGAAAAAA-SH-3′)、叠氮(N3)标记的含G碱基的DNA序列(N3-G4 DNA:5′-N3-CCGATCACTGTGGGTAGGGCGGGTTGG-3′)、二苯并环辛炔(Dibenzocyclooctyne,DBCO)标记的多肽序列(DBCO-peptide:5′-HHHHHHAAA-DBCO-3′),上海生工生物工程有限公司。其他实验常用试剂均为分析纯。
1×TE缓冲液(pH=8.0):由10 mmol/L Tris-HCl与1.0 mmol/L EDTA混合配制,用于溶解和保存寡核苷酸;PBS缓冲液(pH=7.4):由0.1 mol/L KCl、0.1 mol/L Na2HPO4与0.1 mol/L NaH2PO4混合配制。
1.2 主要仪器与设备
CHI660e型电化学工作站,上海辰华仪器有限公司;三电极体系(由玻碳电极、铂丝电极和Ag/AgCl电极组成),上海辰华仪器有限公司;ME204/02型电子分析天平,上海梅特勒-托利多仪器有限公司;KQ5200DE型超声波清洗器,昆山市超声仪器有限公司;PHS-3C型酸度计,上海仪电科学仪器股份有限公司;Sub Cell GT型核酸电泳仪,伯乐生命医学产品有限公司;Image Lab 4.0型凝胶成像系统,美国Bio Rad公司。
1.3 实验方法
1.3.1Apt+TP+N3-G4复合探针的制备分别取5 μL浓度均为200 μmol/L的 Apt、TP和N3-G4混合于485 μL的 1×TE缓冲液中进行退火杂交,即得Apt+TP+N3-G4复合探针。
1.3.2 电化学适配体传感器的构建与工作原理图1为基于改进G4 DNAzyme的电化学适配体传感器的构建及其工作原理。由图1可知,首先设计1条包含立足点(toehold)区域的单链DNA模板(TP),使其能够部分杂交抗生素Apt和N3-G4,以形成稳定的Apt+TP+N3-G4复合探针;然后进行玻碳电极(GCE)预处理,用氧化铝抛光粉(0.5 μm)对GCE进行打磨,用水和乙醇超声清洗以除去残留铝粉,于室温下晾干,备用;再将GCE置于HAuCl4中进行电化学沉积实验(沉积电位为-0.2 V,时间为30 s)得到AuNPs/GCE电极;于4 ℃条件下用CP(2 μmol/L,10 μL)孵育该电极表面16 h,得到CP/AuNPs/GCE电极;最后用MCH(1 mmol/L,10 μL)封闭电极表面剩余的活性位点,即得MCH/CP/AuNPs/GCE电极。
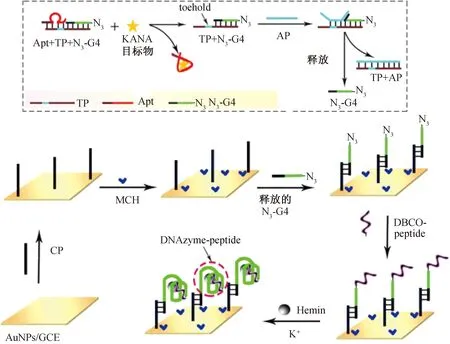
图1 基于改进G4 DNAzyme电化学适配体传感器的构建及其工作原理示意图Fig.1 Schematic diagram of the fabrication of the electrochemical aptasensor based on the improved G4 DNAzyme and its working principle
传感器的工作原理如下:当目标物KANA存在时,KANA与Apt+TP+N3-G4复合探针中的Apt进行特异性结合,导致 toehold 区域的暴露;引入 AP后,AP与toehold序列开始进行杂交,通过链置换反应置换出N3-G4;释放出的 N3-G4与电极表面的CP杂交而被固定至MCH/CP/AuNPs/GCE电极上;将DBCO-peptide孵育至电极后,peptide末端修饰的DBCO与G4末端的N3发生点击化学反应,使peptide与G4 共价组装,从而在K+和Hemin存在下形成G4 DNAzyme-peptide复合物。Hemin具有较强的氧化还原活性,可以提供电化学信号,DNAzyme-peptide催化底物H2O2则可进一步放大电化学信号,从而实现对KANA的高灵敏检测。
1.3.3 凝胶电泳实验凝胶样品的制备:分别将5 μL浓度为5 μmol/L的Apt、TP、N3-G4、Apt+TP+N3-G4、Apt+TP、TP+N3-G4于95 ℃水浴锅中加热5 min;于25 ℃金属振荡器中振荡2 h;采用1×TBE配制12%非变性聚丙烯酰胺凝胶。每份样品取10 μL,将其与2 μL 6×上样缓冲液混合,之后转移到凝胶电泳系统中,在120 V恒定电压下电泳70 min,并用 1%的Gel Red染色液染色30 min;使用凝胶成像系统成像。
1.3.4 电化学测量方法利用循环伏安(CV)法,在含有5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]的PBS缓冲液中对电化学适配体传感器的制备过程进行表征。其中,扫描速率为50 mV/s,电位范围为-0.2~0.7 V。
采用差分脉冲(DPV)法测量电化学适配体传感器对卡那霉素检测的响应性能,扫描电位范围为0.1~-0.6 V,振幅为0.05 V,脉冲宽度为0.05 s,采样宽度为0.016 7 s。
采用CV法在含有5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]的PBS(pH=7.4,0.1 mol/L)缓冲液中,考查不同浓度CP(0.2 μmol/L、0.5 μmol/L、1.0 μmol/L、1.5 μmol/L、2.0 μmol/L、2.5 μmol/L)对电流信号的影响。
为了考查电化学适配体传感器的选择性,在相同条件下,将该传感器应用于同类抗生素妥布霉素(TOB,50 nmol/L)和链霉素(STR,50 nmol/L),非同类抗生素四环素(TET,50 nmol/L)及KANK与上述抗生素的混合物(KANA+Mixture)的检测,采用差分脉冲(DPV)法考查传感器对不同抗生素的响应性能。
1.3.5KANA的检测将10 μL不同浓度的KANA目标物(0 pmol/L、0.06 pmol/L、0.10 pmol/L、2.00 pmol/L、2.00×102pmol/L、2.00×103pmol/L、2.00×104pmol/L)与10 μL Apt+TP+N3-G4(2 μmol/L)复合探针进行混合,于37 ℃恒温摇床中孵育90 min。加入10 μL AP(1 μmol/L),继续孵育30 min,得到含有N3-G4的混合溶液。将混合溶液孵育至MCH/CP/AuNPs/GCE电极上,接着滴涂5 μL的DBCO-peptide(1 μmol/L)。将所得电化学适配体传感器置于含有H2O2(2 mmol/L)的PBS缓冲液中进行检测。检测限LOD的计算公式为3δ/k,其中,δ为3个空白样品的标准差,k为标准曲线的斜率。
1.3.6 加标回收实验为了验证电化学适配体传感器在食品中抗生素的检测能力,在牛奶样品中加入不同浓度梯度(1.0×10-4nmol/L、2.0×10-3nmol/L、0.2 nmol/L、2.0 nmol/L、5.0 nmol/L)的KANA进行加标回收实验。
1.4 数据处理
所有实验均重复 3 次,通过 Origin 2019 软件绘制图表,使用Adobe Photoshop CS6绘制传感器的工作原理图。
2 结果与讨论
2.1 凝胶电泳实验结果分析
为验证Apt+TP+N3-G4复合探针的成功制备与目标物诱发的链置换反应,进行了聚丙烯酰胺凝胶电泳(PAGE)实验,结果见图2。其中,M为DNA标准参照物的电泳条带,泳道1、泳道2和泳道3分别为TP、Apt和N3-G4的电泳条带,泳道4是Apt+TP+N3-G4复合探针的电泳条带,泳道5是将KANA与Apt+TP+N3-G4复合探针孵育后的电泳条带。由图2可知,泳道4上方有一条明亮清晰的条带,滞后于泳道1、泳道2和泳道3的条带,说明Apt+TP+N3-G4复合探针成功制备;泳道5上方出现一条亮带,下方出现一条暗带,证明KANA可以特异性结合Apt+TP+N3-G4复合探针中的Apt,使Apt从复合探针中释放,导致toehold区域暴露,进一步引发后续的链置换反应。
2.2 适配体传感器的电化学表征
图3为适配体传感器的CV曲线,其中a为裸玻碳电极(GCE),b为 AuNPs/GCE,c为CP/AuNPs/GCE,d为MCH/CP/AuNPs/GCE,e为N3-G4/MCH/CP/AuNPs/GCE,f为DBCO-peptide/ N3-G4/MCH/CP/AuNPs/GCE。由图3可知,在裸玻碳电极上可以观察到[Fe(CN)6]3-/4-电子对的特征氧化还原峰(a曲线);将AuNPs沉积于裸玻碳电极,由于AuNPs能够促进电子传输,CV响应电流值有所增加(b曲线);当CP被固定在AuNPs/GCE电极表面时,由于磷酸骨架带负电荷,对[Fe(CN)6]3-/4-起排斥作用,峰电流显著降低(c曲线);用MCH封闭CP/AuNPs/GCE电极后,又因MCH是电惰性小分子,峰电流再次降低(d曲线);当卡那霉素目标物与Apt+TP+N3-G4复合探针中的适配体发生特异性识别后,释放的N3-G4通过碱基互补配对原则与CP进行杂交,从而被组装至MCH/CP/AuNPs/GCE电极表面,导致电极表面负电荷磷酸骨架数量的增多,使峰电流再次降低(e曲线);在N3-G4/MCH/CP/AuNPs/GCE电极上孵育DBCO-peptide后,由于探针上的磷酸骨架和多肽都会阻止电极表面的电子传递,导致峰电流进一步降低(f曲线)。
2.3 适配体传感器的电化学性能分析
采用DPV法考查不同适配体传感器在含有H2O2(2 mmol/L)的PBS(pH=7.4)中的电化学响应性能,以验证实验方案的可行性,结果如图4所示。由图4a)可知,适配体传感器在未孵育抗生素时,由于传感器界面缺乏电活性物质,因此没有观察到明显的电流信号。当将抗生素(5 nmol/L,10 μL)孵育至传感器后,产生了显著的电流信号,这是由于抗生素可以和Apt+TP+N3-G4复合探针中的适配体(Apt)进行特异性识别,导致 N3-G4的释放,而释放的N3-G4 通过与传感器表面的CP进行杂交,并与Hemin进一步结合,从而将电化学活性物质Hemin捕获至传感器的界面上,这也证明了传感器对抗生素具有良好的响应性能。由图4b)可知,传感器在无Peptide时产生的电流信号较小,与之相比,将Peptide引入传感器系统后,电流信号显著增强,证明多肽能显著增强传感器对抗生素的响应电流,大大提高抗生素检测的灵敏度。
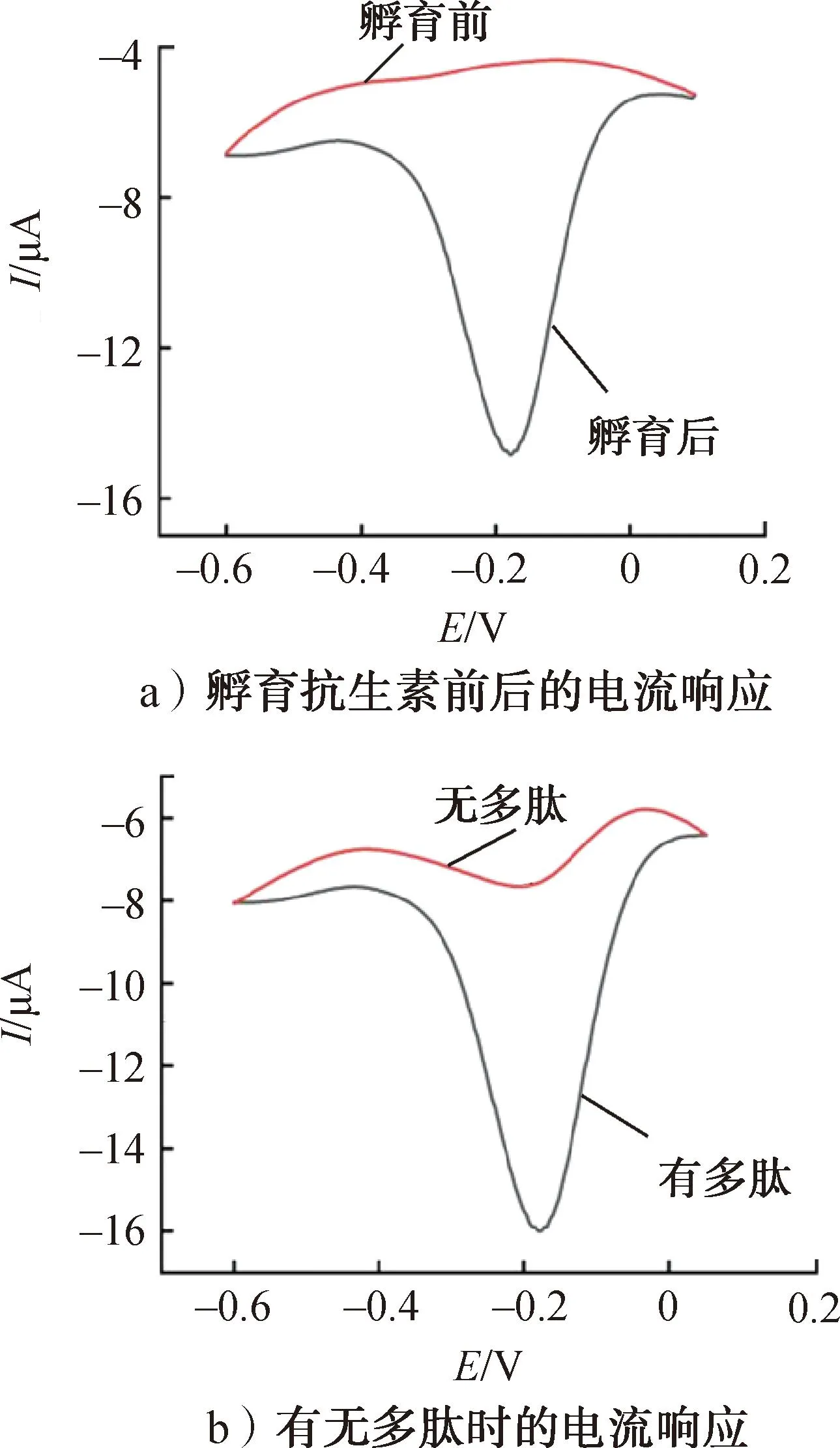
图4 不同适配体传感器在含有H2O2的PBS中的电流响应Fig.4 Current responses of different aptasensors in PBS containing H2O2
2.4 电极表面CP浓度的优化
电极表面CP浓度的优化结果如图5所示 。由图5可知,随着CP浓度的增加,AuNPs/GCE电极的电流信号先降低后逐渐趋于平稳,这是因为CP的负电荷磷酸骨架会对[Fe(CN)6]3-/4-产生电子排斥现象,从而使响应电流下降。当CP浓度超过2.0 μmol/L时,电流信号基本保持不变,所以CP的适宜浓度为2.0 μmol/L。

图5 CP 浓度对电流信号强度的影响Fig.5 Effect of capture probe concentration on current intensity
2.5 适配体传感器对KANA的响应性能
图6为适配体传感器对不同浓度KANA的电化学响应图,其中a—g分别对应KANA浓度0 pmol/L、0.06 pmol/L、0.10 pmol/L、2.00 pmol/L、2.00×102pmol/L、2.00×103pmol/L、2.00×104pmol/L。由图6可知,随着KANA浓度的提高,峰电流强度越来越大,表明释放的N3-G4不断增加,使电极表面Hemin的固载量增加,电流信号不断增强。

图6 电化学适配体传感器对不同浓度KANA的DPV响应曲线Fig.6 DPV response curves of the aptasensor to different concentrations of KANA
图7为KANA浓度对数值与电流信号强度间的线性关系图。由图7可知,KANA浓度对数值与电流信号强度具有良好的线性关系,线性回归方程为Ι=-1.591 0 lgc-13.574 2,线性相关系数R2=0.995 6,检测限(LOD)为0.02 pmol/L。

图7 KANA浓度对数值与电流信号强度间的线性关系图Fig.7 The linear relationship between the logarithm of KANA concentration and the current signal strength
表1为本文方法与其他KANA检测方法的分析对比结果。由表1可知,与其他KANA检测方法相比,本文方法的LOD更低,这说明所构建的电化学适配体传感器有望成为一种高灵敏检测食品中抗生素残留的新方法。

表1 本文方法与其他KANA检测方法的分析对比结果Table 1 The analysis performance of this method is compared with other KANA detection methods
2.6 电化学适配体传感器的选择性
图8为电化学适配体传感器对不同抗生素电化学响应结果。由图8可知,KANA存在时电化学适配体传感器产生了明显的电化学信号,而在干扰物TOB、STR和TET中,电化学信号微乎其微。然而,当这些干扰物与KANA共存时,与单独存在的KANA相比,电化学信号没有明显的变化。以上结果表明,该适配体传感器对检测KANA具有良好的选择性,这归因于适配体对KANA的特异性识别作用。
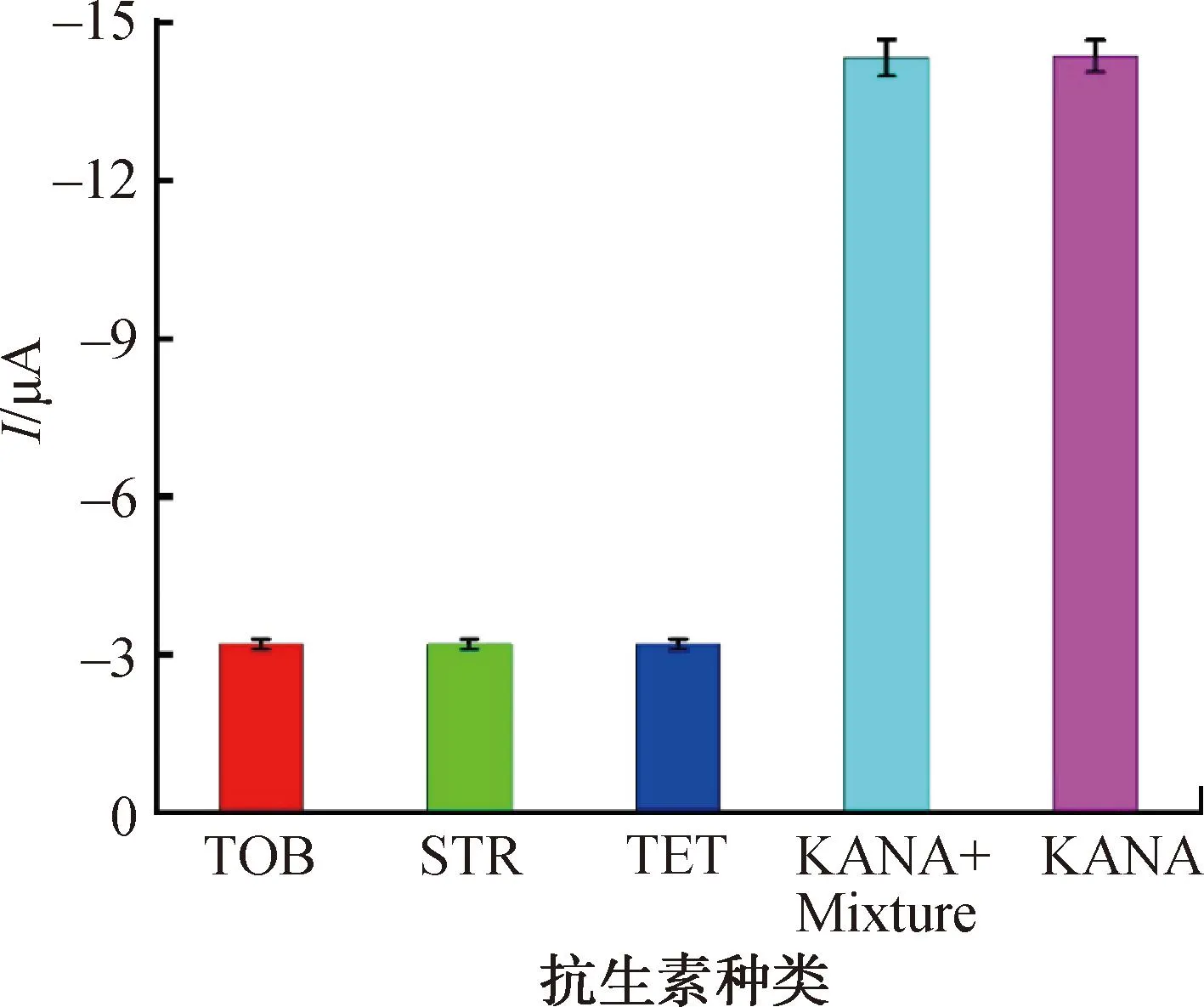
图8 适配体传感器的选择性Fig.8 The selectivity of aptasensor
2.7 电化学适配体传感器在实际样品中的验证试验
牛奶样品中KANA的加标回收实验结果见表2。由表2可知,该方法在牛奶中的加标回收率为97.1%~105.5%,相对标准差(RSD)为3.60%~5.74%,表明该电化学适配体传感器适用于牛奶中KANA的检测。
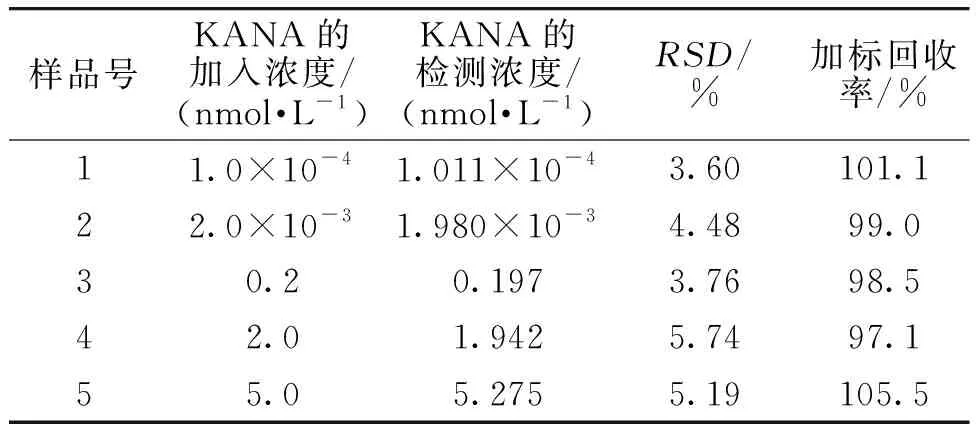
表2 牛奶样品中KANA的加标回收实验结果Table 2 Sample labeling recovery experiment
表3为该电化学适配体传感器与ELISA法测定牛奶样品中KANA的对比实验结果。由表3可知,两种方法的相对偏差为-3.90%~2.83%,表明本方法与ELISA法结果相一致,说明该电化学适配体传感器能够实现牛奶中KANA的快速准确检测。
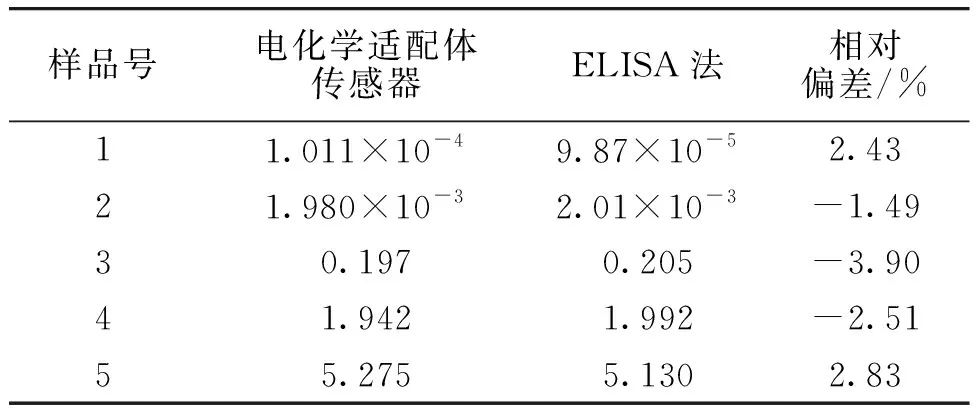
表3 电化学适配体传感器与ELISA法测定牛奶样品中KANA的对比实验结果Table 3 Comparison experimental results of the aptasensor and ELISA method for determining KANA in milk nmol/L
3 结论
本文将Peptide与G4 DNAzyme共价组装得到高活性的DNAzyme-peptide复合物,以Hemin为电子媒介体成功构建了一种新型电化学适配体传感器,采用DPV法考查该传感器的电化学响应性能,并将其用于牛奶中KANA的检测分析。结果表明:与传统的G4 DNAzyme相比,G4 DNAzyme-peptide的催化性能明显增强,可以显著提高传感器的灵敏度;在CP最优浓度(2.0 μmol/L)下,该传感器用于KANA检测时呈现较宽的检测范围(0.06 pmol/L~20 nmol/L)和较低的检测限(0.02 pmol/L),优于其他KANA检测方法;该传感器对KANA具有良好的选择性,用于牛奶实际样品分析时,加标回收率为97.1%~105.5%,RSD为3.60%~5.74%,且检测结果与ELISA法相一致。因此,所构建的电化学适配体传感器在实际食品安全检测中具有良好的实用性,为抗生素残留检测提供了一种新方法。
