健脾补肾益肺方减轻慢性阻塞性肺疾病小鼠氧化应激的实验研究*
2024-01-11吴峥嵘郝素英
李 渊 吴峥嵘 郝素英 何 明
(北京中医药大学东方医院,北京 100078)
慢性阻塞性肺疾病(COPD)的特征是持续存在的气流受限和相应的呼吸系统症状。2018 年“中国成人肺部健康研究”调查结果显示,我国20 岁及以上成人COPD患病率为8.6%,40岁以上人群患病率高达13.7%,估算我国COPD 患者数近1 亿[1],但我国COPD 知晓率、诊断率、治疗率低[2],故COPD 的防治是我国重要的公共卫生问题。
COPD 的发病机制复杂,吸入烟草烟雾等有害颗粒或气体可引起气道氧化应激、炎症反应以及蛋白酶/抗蛋白酶失衡等,这些途径参与了COPD 的发病[1],其中氧化抗氧化失衡受到广泛重视。Kelch 样ECH 相关蛋白1(Keap1)-核因子红系2 相关因子2(Nrf2)-抗氧化反应元件(ARE)信号通路可调节多种抗氧化基因的转录[3]。中医药在防治COPD 中显示出较强的优势。本课题组在前期临床研究中发现[4-5],健脾补肾益肺方能改COPD 患者的肺功能、6 min 步行试验,该方中多数中药具有抗氧化应激的作用。为进一步研究健脾补肾益肺方对COPD 的作用机理,本研究拟观察健脾补肾益肺方对COPD 小鼠Keap1-Nrf2-ARE 信号通路的影响。现报告如下。
1 材料与方法
1.1 实验动物 SPF 级C57BL/6J 小鼠7 周龄雄性30只,购自北京维通利华生物有限公司,许可证号SCXK(京)2021-0006。饲养条件:清洁级,室内温度20~25 ℃;相对湿度50%~70%。光照时间固定,每天昼夜各12 h,昼间照明时间为8∶00~20∶00。动物饮用水及笼具经高压灭菌锅灭菌处理,饲料及垫料均经辐照处理,水、食物自由摄取。小鼠饲养于北京中医药大学东方医院实验动物中心SPF 级动物房。适应性喂养7 d后开始实验。
1.2 试药与仪器 健脾补肾益肺方(生黄芪30 g,太子参30 g,熟地黄15 g,黄精15 g,白果10 g,地龙15 g),中药饮片购于北京中医药大学东方医院,水煎煮提取2 次,合并提取液,浓缩得浸膏;丙卡特罗25 μg/片,浙江大冢制药有限公司。主要试剂和仪器:脂多糖(LPS,美国Sigma 公司);大前门香烟(上海烟草公司,焦油量12 mg,烟气烟碱量0.9 mg,烟气一氧化碳量14 mg);活性氧(ROS)检测试剂盒(南京建成生物工程研究所)、丙二醛(MAD)检测试剂盒(南京建成生物工程研究所);Nrf2一抗(PTG 16396-1-AP);超氧化物歧化酶(SOD)一抗(PTG 10269-1-AP);血红素加氧酶1(HO-1)一抗(10701-1-AP);醌氧化还原酶1(NQO1)一抗(67240-1-IG);HRP 标记山羊抗兔通用二抗(DAKO K5007);免疫组化试剂盒DAB 显色剂(DAKO K5007)。电子天平称(万特1002);离心机(湖南平凡科技TG16W);气麻机(众实科技ZS-MV);病理切片机(上海徕卡仪器有限公司RM2016);涡旋混合器(天悦电子TYXH-Ⅱ);显微镜(CIC XSP-C204);自制透明有机玻璃烟熏箱:100 cm×100 cm×60 cm 箱,分上、下2层,底部网眼结构,上层放鼠,下层放烟。
1.3 分组与造模 将30 只小鼠按随机数字表法分为5 组,正常组、模型组、中药高剂量组、中药低剂量组、西药组,每组6 只。模型制备:参照文献[6],采用烟雾暴露联合LPS 气道内滴注造模。第1、14 日采用1.4%异氟烷吸入麻醉,4 号针头穿刺气管,滴注LPS 7.5 μg/50 μL。气管滴注当天不进行烟熏。第2 至13 日,第15 至90 日将小鼠置入烟熏箱内熏烟,每日2 次,上下午各1次,上下午间隔4 h,每次2 h(间隔换气20 min),每小时10 支烟,每周烟熏6 d。中药高剂量组、中药低剂量组、西药组造模方法同模型组。正常组:不用烟熏,气管内滴注50 μL生理盐水。
1.4 干预方法 中药高剂量组、中药低剂量组从造模第2 日开始,健脾补肾益肺膏方溶于生理盐水灌胃给药,中药低剂量组给药剂量为人临床用量的等效剂量,合生药量为14.95 g/(kg·d),中药高剂量组合生药量为29.9 g/(kg·d)。第14 日不灌服,给药至第90 日,每周称量体重,根据体质量变化调整给药剂量。西药组:从造模第2日开始,给予丙卡特罗[26 μg/(kg·d)]溶于同中药组等体积生理盐水灌胃,第14 日不灌服,给药至第90 日,根据体质量变化调整给药剂量。正常组:给予同中药组等体积的生理盐水灌胃。
1.5 标本采集与检测 1)各组小鼠肺功能指标测定。第91 日行肺功能检查并处死动物留取肺组织,采用1.4%异氟烷吸入麻醉,仰卧固定于操作台。于颈部正中剪开皮肤后逐层分离肌肉组织,暴露气管,插入气管插管,打结固定。将小鼠置入动物肺功能分析仪中,待小鼠与肺功能仪完全协调后,开始测定肺通气功能。测定小鼠用力肺活量(FVC)、第0.15 秒用力呼气容积(FEV0.15)、0.15 s 呼出容积占用力肺活量之比(FEV0.15/FVC)、用力呼出50%肺活量时的最大瞬间呼气流量(FEF50%)、用力呼出75%肺活量时的最大瞬间呼气流量(FEF75%)。2)各组小鼠肺泡灌洗液ROS、MDA 测定。肺功能测定完毕之后,迅速沿胸骨打开胸腔,止血钳夹闭左主支气管,用1 mL 注射器吸取0.5 mL PBS 后与气管插管相连,缓慢推注射器,待PBS 在左肺停留约10 s 后再回抽,反复抽吸3 次,回收肺泡灌洗液。在4 ℃、800 r/min 的条件下离心10 min,分离上清液放于-80 ℃冰箱保存待测。按照ELISA 试剂盒说明书检测肺泡灌洗液中ROS、MDA 水平。3)各组小鼠肺组织病理学观察。取各组小鼠右肺,置于4%多聚甲醛内固定,常规石蜡包埋、切片,根据HE 染色试剂盒说明书步骤HE 染色。每张切片任取5 个视野,以观察肺部病理变化。4)各组小鼠肺组织SOD、HO-1、NQO1、Nrf2免疫组织化学检测。将石蜡切片脱蜡至水,进行抗原修复,在切片上滴加一抗,切片平放于湿盒内4 ℃孵育过夜。滴加免疫组化试剂盒内与一抗相应种属的二抗(HRP 标记)覆盖组织。滴加新鲜配制的DAB 显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色。复染细胞核,脱水封片。显微镜镜检,采集图像。采用图像分析软件Image-pro pus 6.0对图像进行分析,以平均光密度值为指标对各组免疫组化染色进行定量分析。
1.6 统计学处理 应用SPSS17.0 统计软件。计量资料以(±s)表示,多组间均数比较采用Oneway ANOVA分析,方差齐时采用LSD法,方差不齐时采用Dunnett's T3法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠肺功能比较 见表1。与正常组相比,模型组、中药高剂量组、中药低剂量组、西药组FEV0.15/FVC%、FEF50%、FEF75%均显著降低(P<0.01);与模型组相比,中药高剂量组FEV0.15/FVC%、FEF50%、FEF75%显著增高(P<0.01),中药低剂量组、西药组FEV0.15/FVC%显著增高(P<0.01);与中药高剂量组相比,中药低剂量组、西药组FEV0.15/FVC%、FEF50%、FEF75%均显著降低(P<0.01)。
表1 各组小鼠肺功能比较(±s)

表1 各组小鼠肺功能比较(±s)
注:与正常组比较,*P <0.01;与模型组比较,△P <0.01;与中药高剂量组比较,▲P <0.01。下同。
组 别正常组模型组中药高剂量组中药低剂量组西药组n66666 FEV0.15/FVC%85.83±3.51 55.29±2.93*74.25±2.44*△62.41±1.02*△▲62.57±4.64*△▲FEF50%(mL/s)6.74±0.22 3.90±0.61*5.47±0.24*△4.15±0.14*▲4.11±0.49*▲FEF75%(mL/s)4.82±0.30 2.40±0.67*3.49±0.35*△2.35±0.22*▲2.37±0.42*▲
2.2 各组小鼠肺组织病理改变 见图1。正常组:小鼠肺组织肺泡结构正常,小气道支气管壁正常。模型组:小鼠肺泡结构不完整,部分肺泡壁增厚,可见大量炎性细胞浸润,部分肺泡壁断裂,肺泡腔扩大,小气道支气管壁增厚,气道周围炎症细胞浸润。中药高剂量组:小鼠肺组织病理改变相对模型组改善较为明显,绝大多数肺泡结构趋向正常。中药低剂量组:小鼠肺组织病理改变相对模型组有所改善,部分肺泡壁增厚,可见炎性细胞浸润,部分肺泡壁断裂,小气道支气管壁增厚。西药组:小鼠肺组织病理改变相对模型略有所改善,部分肺泡壁增厚,较多炎性细胞浸润,部分肺泡壁断裂。

图1 各组小鼠肺组织病理改变(HE染色,20倍)
2.3 各组小鼠肺泡灌洗液ROS、MDA含量比较 见表2。与正常组相比,模型组、中药低剂量组、西药组ROS、MDA 均显著增高(P<0.01),中药高剂量组ROS显著增多(P<0.01);与模型组相比,中药高剂量组ROS、MDA 以及中药低剂量组ROS 显著减少(P<0.01);与中药高剂量组相比,中药低剂量组、西药组ROS、MDA均显著增多(P<0.01);与中药低剂量组相比,西药组ROS显著增多(P<0.05)。
表2 各组小鼠肺泡灌洗液ROS、MDA含量比较(±s)

表2 各组小鼠肺泡灌洗液ROS、MDA含量比较(±s)
注:与中药低剂量组比较,★P <0.05。下同。
组 别正常组模型组中药高剂量组中药低剂量组西药组n66666 ROS(U/mL)5.17±1.00 17.47±1.34*8.40±1.14*△14.38±1.63*△▲16.52±2.49*▲★MDA(μmol/L)2.38±0.54 4.47±0.95*2.57±0.56△4.33±0.84*▲4.03±0.94*▲
2.4 各组小鼠肺组织SOD、HO-1、NQO1 平均光密度值比较 见表3、图2。与正常组相比,模型组、西药组SOD 均显著减少(P<0.01),中药高剂量组SOD 显著增多(P<0.01);与模型组相比,中药高剂量组及中药低剂量组SOD 均显著增多(P<0.01 或P<0.05);与中药高剂量组相比,中药低剂量组、西药组SOD 均显著减少(P<0.01)。与正常组相比,中药高剂量组HO-1、NQO1显著增多(P<0.01);与模型组相比,中药高剂量组HO-1、NQO1 显著增多(P<0.01);与中药高剂量组相比,中药低剂量组、西药组HO-1、NQO1 显著减少(P<0.01);与中药低剂量组相比,西药组HO-1显著减少(P<0.05)。
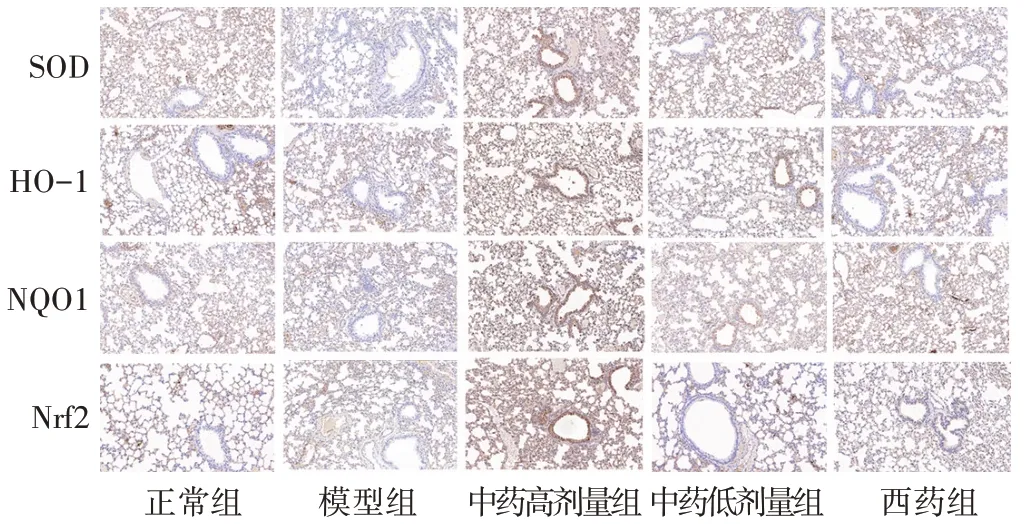
图2 各组小鼠肺组织SOD、HO-1、NQO1、Nrf2表达(免疫组织化学染色,20倍)
表3 各组小鼠肺组织SOD、HO-1、NQO1平均光密度值比较(±s)

表3 各组小鼠肺组织SOD、HO-1、NQO1平均光密度值比较(±s)
注:与模型组比较,△△P <0.05。
组 别正常组模型组中药高剂量组中药低剂量组西药组n66666 SOD 0.003 9±0.001 00 0.001 4±0.000 53*0.006 0±0.000 80*△0.002 7±0.000 82△△▲0.002 0±0.000 78*▲HO-1 0.002 3±0.000 80 0.002 4±0.001 50 0.006 4±0.001 10*△0.003 3±0.000 80▲0.002 1±0.000 85▲★NQO1 0.004 0±0.000 79 0.003 2±0.000 98 0.009 5±0.003 14*△0.004 2±0.000 70▲0.003 3±0.000 85▲
2.5 各组小鼠肺组织Nrf2 平均光密度值比较 见表4、图2。与正常组相比,中药高剂量组Nrf2 显著增多(P<0.01);与模型组相比,中药高剂量组Nrf2 显著增多(P<0.01);与中药高剂量组相比,中药低剂量组、西药组Nrf2显著减少(P<0.01)。
表4 各组小鼠肺组织Nrf2平均光密度值比较(±s)

表4 各组小鼠肺组织Nrf2平均光密度值比较(±s)
组 别正常组模型组中药高剂量组中药低剂量组西药组n66666 Nrf2 0.002 4±0.000 94 0.002 1±0.000 88 0.0102±0.00484*△0.0020±0.00081▲0.0028±0.00101▲
3 讨 论
该研究表明,健脾补肾益肺方可改善COPD 小鼠的肺功能,改善小鼠体内氧化应激程度,通过调控Keap1-Nrf2-AER 信号通路,增强抗氧化剂的表达,从而减轻小鼠氧化应激,保护小鼠的肺功能,减轻肺气肿程度,减少小气道壁的炎性浸润。COPD 发病中氧化应激机制是目前的研究热点,有关中药复方对COPD 小鼠氧化应激机制以及相关通路影响的研究目前还尚未深入,本研究揭示了健脾补肾益肺方可能通过调节COPD 小鼠Keap1-Nrf2-AER 信号通路从而减轻氧化应激程度。
本研究发现,健脾补肾益肺方能显著提高COPD小鼠的FEV0.15/FVC%、FEF50%、FEF75%,提示该方可改善COPD 小鼠的肺功能。前期临床研究[4-5]发现,健脾补肾益肺方治疗组患者的FEV1%、FEV1/FVC%显著高于正常组,提示该方可改善患者的肺功能。该方的临床疗效在动物模型上得到了验证。健脾补肾益肺方是何明教授在多年的临床实践基础上总结提炼而成的,方中太子参、黄芪补益肺气,健脾助运,熟地黄、黄精补肾益精,白果、地龙敛肺平喘。该方主要药物黄芪、太子参、熟地黄、黄精具有抗氧化作用[7-10],故笔者进一步探讨健脾补肾益肺方对氧化应激以及相关抗氧化通路的影响,从而揭示其抗氧化的机制,为指导中医药治疗COPD提供更多的证据。
COPD 小鼠存在氧化-抗氧化失衡。ROS、MDA 为氧化应激的生物标志物,ROS包括超氧阴离子自由基、羟基自由基、过氧化氢等,当ROS 生成过多时,可导致脂质、蛋白质和DNA 过氧化,MDA 是脂质过氧化的主要产物[11]。SOD、HO-1、NQO1则为重要的抗氧化剂[12]。此外HO-1 被报道是肺中的抗氧化剂,在保护肺细胞免受氧化应激及炎症损伤方面具有重要意义[13]。研究发现,模型组小鼠ROS、MDA 比正常组均显著增高,而模型组小鼠SOD 比正常组显著减少,两组HO-1、NQO1 无显著差异,说明模型组小鼠比正常组氧化应激生物标志物明显增多,而抗氧化剂却减少或与正常组无差异,证实模型组小鼠存在氧化-抗氧化失衡。
健脾补肾益方可减轻COPD 小鼠的氧化应激程度。健脾补肾益肺方高、低剂量组比模型组ROS 均显著减少,健脾补肾益肺方高剂量组MDA 比模型组显著减少,以上数据表明该方可减轻COPD 小鼠的氧化应激程度。本研究进一步探讨了健脾补肾益肺方减轻COPD 小鼠氧化应激水平的机理。Keap1-Nrf2-ARE是近年来抗氧化通路中的研究热点。在非应激条件下,Nrf2 的天然抑制剂Keap1 将Nrf2 隔离在细胞质中,并促进26S 蛋白酶体对Nrf2 的降解;在应激条件下[12,14-16],Nrf2 与keap1 分离,转位到细胞核内,激活ARE 依赖的一系列抗氧化蛋白基因的表达,包括HO-1、NQO1、SOD 等,即HO-1、NQO1、SOD 是Keap1-Nrf2- ARE 信号通路的下游产物。老年吸烟者和COPD 患者巨噬细胞Nrf2 表达降低[17]。Nrf2 系统的激活被认为是一种强大的细胞保护策略[18]。本研究表明,健脾补肾益肺方高、低剂量组SOD 均比模型组显著增多,健脾补肾益肺方高剂量组HO-1、NQO1 比模型组显著增多,说明该方具有增强COPD 小鼠抗氧化的作用。健脾补肾益肺方高剂量组Nrf2比模型组显著增多,说明该方可能通过激活Keap1-Nrf2-ARE 通路,上调Nrf2 的表达从而上调SOD、HO-1、NQO1 在肺组织中的表达。另外也有一些研究显示出了中药复方或单体对COPD 氧化失衡的作用。如补肺益肾方可提高COPD 大鼠Nrf2、HO-1 等的表达,降低血清过氧化物表达。红景天苷对COPD 小鼠肺损伤具有保护作用,对COPD 体外细胞模型也具有一定的保护作用,与其抗氧化应激作用密切相关[19-21]。
健脾补肾益肺方高剂量组比低剂量组Nrf2、SOD、HO-1、NQO1 显著增多,该方在调节Nrf2 与SOD、HO-1、NQO1 方面呈现出了量效关系。这与氧化应激水平的生物标记物ROS、MDA 在两组间的变化趋势相反,高剂量组比低剂量组ROS、MDA 显著减少;与肺功能在两组间的变化趋势一致,高剂量组比低剂量组FEV0.15/FVC%、FEF50%、FEF75%显著增高。中药高剂量组比西药组Nrf2、SOD、HO-1、NQO1 均显著增多,另外在降低COPD 小鼠ROS、MDA和提高肺功能方面,中药复方比西药组也显示出了优势。
综上所述,COPD 小鼠存在氧化和抗氧化失衡,健脾补肾益肺方可能通过激活COPD 小鼠Keap1-Nrf2-ARE 通路,上调Nrf2 的表达而增加该通路下游抗氧化剂的产生,从而减轻氧化应激程度,保护小鼠肺功能。
